RT-PCR法快速检测与鉴别诊断猪瘟病毒野毒株和三个兔化弱毒疫苗株的研究
2010-10-23颜其贵
万 莉 译,颜其贵 校
(四川农业大学动物医学院,四川 雅安 625014)
猪瘟以前又名烂肠瘟,是由黄病毒科黄病毒属的猪瘟病毒(CSFV)引起家猪和野猪的高度接触传染的严重传染病。属内其他两个成员为牛病毒性腹泻病毒和绵羊边界病病毒,也是能自然感染猪的重要动物病原微生物。从世界各地分离的CSFV株暂被分为3个主要基因群,每一个基因群有3~4个亚群,即 1.1、1.2、1.3;2.1、2.2、2.3;3.1 和 3.2、3.3、3.4。CSFV野毒株的系统发生分析揭示亚群2.1a、2.1b、2.2、3.4在台湾均确实存在。
CSFV兔化弱毒疫苗株免疫仔猪后,疫苗病毒在组织和血液能持续存在一段时间。用C株(ChineseCstrain)疫苗病毒接种仔猪,接种后2~16d(接种后天数,DPV)内均可在扁桃体或在血液中检测到疫苗病毒。C株可在8DPV的家猪器官中检测到,而野猪则在9DPV可检测到。南非使用的PAV-250疫苗株,用RT-PCR和荧光抗体试验(FAT)检测均显示,28DPV可在扁桃体中检出。用C-株疫苗病毒肌内注射断奶仔猪,通过实时RT-PCR检测,该病毒基因组可在扁桃体持续被检测到的时间长达42DPV。
采用遗传多样性的分子分析技术可以区分密切相关的病毒株。目前已经成功使用RT-PCR、RT-PCR/限制性内切酶分析、RT-PCR/核酸杂交试验,或实时RT-PCR法来鉴别猪瘟病毒、牛病毒性腹泻病毒和边界病病毒。猪瘟病毒基因组分型也是通过使用RT-PCR及E2基因的限制性片段长度多态性来进行的。RT-PCR/限制性内切酶分析用于鉴别猪瘟野毒和疫苗毒已有报道。采用RT-PCR扩增后直接测定扩增片段序列是对猪瘟病毒基因组遗传进行分析和鉴别野毒株和疫苗株目前使用最广泛的方法。最近有学者报道,依据单个核苷酸差异设计TaqManMGB探针,采用实时荧光RT-PCR技术用来鉴别韩国野毒株和弱毒疫苗株(LOM株)。多重巢式RT-PCR和多重实时荧光RT-PCR法用来检测和鉴别野毒株和疫苗病毒C-株亦有研究报道。

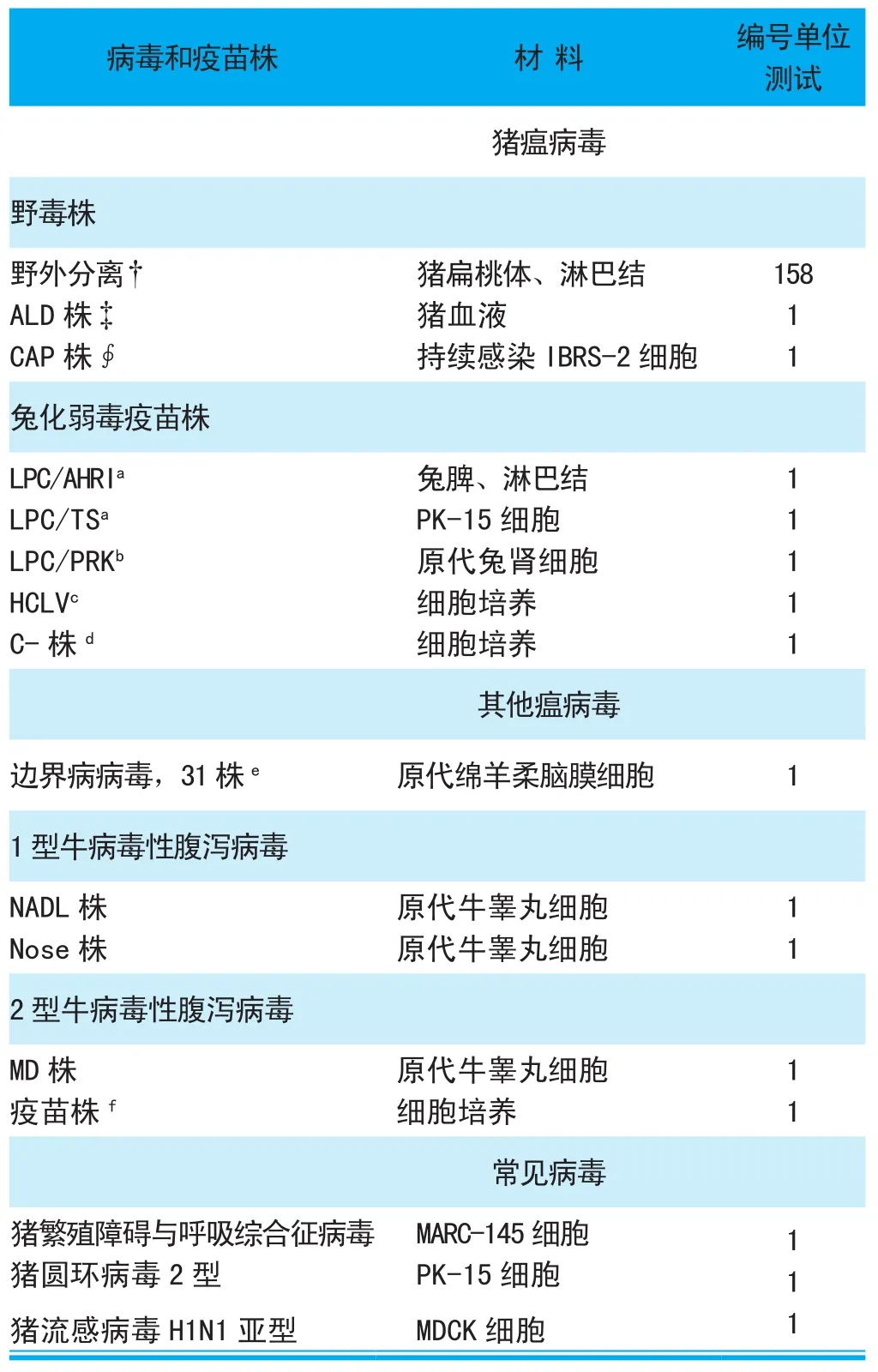
表1 用于本研究的病毒、疫苗株
当前预防控制猪瘟广泛采用免疫接种兔化弱毒疫苗,差异在于不同国家地区使用不同的兔化弱毒株,主要有 LPC 株(LapinizedPhilippinesCoronel)、HCLV 株(HogCholeraLapinizedVirus)、RiemsC 株(Chinese)、C株(ChineseCstrain)。 通 过 对 C 株、HCLV 株、LPC 株疫苗病毒全长cDNA序列比对分析发现,在其病毒基因组的3′NTR中均存在有12~13nt的富含T的插入序列。进一步对兔化弱毒Porcivac株、Rovac株、俄国LK株以及原始兔化弱毒疫苗株C株的3′NTR非编码区进行比对,结果显示4株疫苗病毒中均存在独特的长12~14nt富含T的插入序列。独特的长12~14nt富含T的插入序列在猪瘟病毒野毒株中缺失,极有可能是兔化弱毒疫苗株的一个遗传标记。因此,依据兔化弱毒疫苗株3′NTR序列差异,能够建立一种RT-PCR技术可以快速鉴别猪瘟病毒野毒株和兔化弱毒疫苗株。本研究是依据上述原理建立的一种简单、快捷RTPCR检测与鉴别技术,可以非常有效的应用于猪瘟病毒感染的常规检测诊断。同时,该方法不仅能够提高检测猪瘟病毒的灵敏度,而且可用于鉴别野毒株和兔化弱毒疫苗株。
1 材料与方法
1.1 病毒、疫苗株与临床样本
用于该项研究的病毒和疫苗株在表1中列出。来自不同免疫猪场的248个临床样本,是2004~2007年间由当地动物疾病控制中心做常规猪瘟诊断确定的样本并提交动物健康研究所的。所有的扁桃体和淋巴组织样品均使用MEM培养液制备成10%的悬液,采用RT-PCR检测以及病毒分离鉴定,在样品制备的悬液接种到细胞,培养2d后使用荧光抗体试验(FAT)进行病毒分离检验。
1.2 引物设计
从 GenBank上 下 载 72株 CSFV、11株 BDV、15株1型BVDV、8株2型BVDV的部分NS5B和3′-NTR 序 列, 使 用 MegAlign5.03 软 件 的 ClustalV功 能进行序列比对分析。依据72株CSFV保守的NS5B和3′-NTR序列设计两套简并的引物,用于鉴别猪瘟野毒株和兔化弱毒疫苗株。这些引物中包含兔化弱毒疫苗株特有的富含T的插入序列。同时设计两条上游引物,C5(5′-GTAGCAAGACTGGRAAYAGGTA-3′,Y=CorT,R=AorG;Alfort/187 株基因组位置 11874 ~ 11895bp),C3(5′-ACCCTRTTGTARATAACACTA-3′,Alfort/187株基因组位置12106~12126bp),和一条下游引C6(5′-AAAGTGCTGTTAAAAATGAGTG-3′,Alfort/187基因组位置12240~12219bp)。C5/C6引物对预计能在野毒株和兔化弱毒疫苗株中依次产生367bp和379bp产物,而C3/C6引物对预计依次产生135bp和147bp产物短片段。为了增加敏感性,C3/C6引物对作为内源引物,结合C5/C6引物对进行巢式PCR扩增检测。
1.3 RT-PCR和巢式 PCR扩增
使用Trizol试剂直接从100µL的10%的组织样品悬液、稀释疫苗、血清样品或细胞培养物中提取病毒RNA。采用一步法RT-PCR,50µL的反应体系包括1U超耐热DNA聚合酶、10×buffer(包括 1.5mmol的 MgCl2)、8URNA 酶抑制剂、2UAMV,每条引物10pmole,0.1mmol的 dNTP和5µL 的病毒 RNA 模板。在 GeneAmpPCRSystem9700基因扩增仪中进行。反应程序为:42℃,反转录,40min;94℃,变性3min ;94℃变性40s,55℃退火40s,72℃延伸40s,30 个循环 ;最后72℃延伸7min。当需要更高灵敏度时,巢式PCR扩增以同法进行,1.0µLRT-PCR扩增产物做模板,C3/C6做巢式引物。
1.4 用RT-PCR和巢式PCR检测实验感染猪的血清样本
用含有105TCID50滴度的猪瘟野毒株(92-TC1株)的全血肌内接种4头8周龄的SPF猪。分别于接种0d、1d、2d、3d、5d、7d、10d 和 12d 后收集血清样品。用 RTPCR和巢式PCR扩增方法来决定这些样品中是否存在猪瘟病毒。
1.5 用琼脂糖凝胶和高效毛细管电泳分析扩增产物
引物对C3/C6扩增产物使用4%的琼脂糖凝胶,引物对C3/C5扩增产物使用2%的琼脂糖凝胶分别进行电泳分析。扩增产物使用eGeneHDA-GT12系统电泳仪,在高效毛细管胶盒GCK-5000F上进行分析。10.0µL扩增产物与15.0µLTris-EDTA缓冲液在样品盘中混合并自动被上样都到高效毛细管道中,参照eGene操作手册进行电泳。采用 AM420 方法,10s上样时间和420s分离时间进行分离。扩增产物的分子质量标准和浓度参考pGEMDNA大小标记。
1.6 敏感性和特异性试验
为了检查RT-PCR和巢式PCR反应的敏感性,将猪瘟野毒株O1030/CH/05荧光抗体实验滴度为103.8TCID50/mL的细胞培养上清液用PBS进行10倍倍比稀释。总的RNA从每个稀释度中提取,用于RT-PCR和巢式PCR试验。在特异性试验中,2个BVDV-1株,2个BVDV-2株,BDV,PRRSV,PCV-2以及SIV亦采用该法做特异性检验处理。
1.7 疫苗株和野毒株非编码区3′NTR序列分析
引物对C5/C6的RT-PCR扩增产物使用QIAQuick纯化试剂盒直接提纯。采用BigDye终止法测序反应试剂盒,以RT-PCR原始引物直接测定RT-PCR扩增产物的DNA序列。在这个试验中,直接测定一个长的富含T片段是不可能的,因为基因滑动的影响。为了克服该困难,使用pBAD/硫拓扑异构酶I耐热扩增克隆试剂盒,对从疫苗株LPC/PRK和LPC/TS长的富含T的插入序列扩增的RT-PCR产物分别进行克隆。疫苗株LPC/PRK和LPC/TS各自做10个不同的克隆质粒,通过使用标准载体引物对其进行DNA测序。
2 结果与分析
2.1 RT-PCR和巢式PCR的特异性
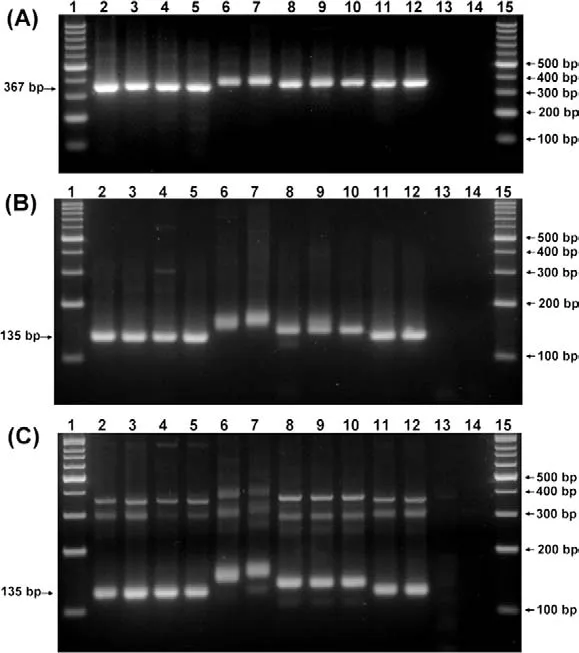
图1 不同基因型的猪瘟病毒和4个兔化疫苗株扩增产物琼脂糖凝胶电泳分析
通过利用引物对C5/C6,采用RT-PCR,158株猪瘟野毒株,ALD,CAP株和5株兔化疫苗株(LPC/AHRI,LPC/TS,LPC/PRK,HCLV和C株)基因序列都成功被扩增出。正如预期所料,野毒株病毒有367bp的PCR产物和3个疫苗株病毒(LPC/AHRI,HCLV和C-株)有379bp的PCR产物。LPC/PRK和LPC/TS株病毒略大的产物在2%琼脂糖凝胶中与野毒株病毒区分开来,但是其他3个疫苗株病毒(LPC/AHRI,HCLV和C株)不能与野毒株区分开(图1A)。通过利用引物对C3/C6,之前提到的野毒株和疫苗株的基因序列也成功被扩增出。如预期所料,在4%琼脂糖凝胶中,产生135bp的片段为野毒株,而5株疫苗病毒扩增出范围在147bp~177bp间的基因片段,因此疫苗病毒的产物能容易与那些野毒株区分开(图1B)。为了增加灵敏度,建立巢式PCR,引物对C3/C6作为内源引物。在巢式PCR试验中,158株野毒株猪瘟病毒,ALD,CAP株和5株兔化疫苗株的扩增产物与前面的RT-PCR扩增产物大小一致(图1C)。其他瘟病毒,包括BVDV(国家动物疾病实验室),BVDV(Nose),BVDV-1(疫苗株),BVDV-2(疫苗株)和BDV,以及其他常见猪病毒,例如PRRSV,PCV-2和SIV,用这2套引物没有扩增出片段(资料未显示)。

图2 用引物对C3/C6进行RT-PCR扩增产物琼脂糖凝胶电泳分析
2.2 用RT-PCR检测和鉴别临床样本中的野毒株和兔化弱毒疫苗株
在本研究中总共有248个临床样品进行了试验。通过RT-PCR,样品中有35个显阳性,其中9个被鉴定为野毒株(图2),以及26个被鉴定为免疫存留的兔化弱毒疫苗株。在病毒中和试验(VI)中,通过荧光抗体试验,248个临床样本中只有19个对猪瘟病毒显阳性,10个是疫苗病毒。这些结果显示RT-PCR试验比VI试验灵更敏。
2.3 高效毛细管电泳分析
通过利用高效毛细管电泳系统,引物对C5/C6扩增出的RT-PCR产物很容易被分离成野毒株和疫苗株病毒,甚至差异小至12nt也被分离出。5个不同的病毒基因组代表的4株兔化疫苗株(LPC/AHRI,LPC/TS,LPC/PRK和HCLV)和野毒株猪瘟病毒的平板凝胶观察分离效果见图3。
2.4 RT-PCR和巢式PCR的灵敏度实验
在RT-PCR实验中,通过利用引物对C5/C6和C3/C6,猪瘟病毒野毒株的检测限制依次是6.3TCID50/mL和63TCID50/mL,显示引物对C5/C6的RT-PCR,比用引物对C3/C6灵敏度高10倍。在巢式PCR实验中,通过使用引物对C3/C6,检测野毒株猪瘟病毒限制是0.63TCID50/mL,基于这些结果显示,巢式PCR比RT-PCR灵敏度高10~100倍。
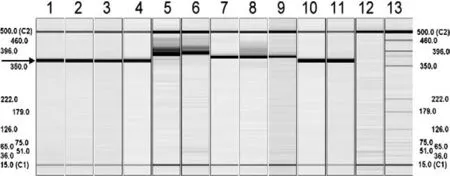
图3 高效毛细管电泳分析猪瘟病毒(CSFV)野毒株和兔化疫苗株的富含T的插入序列片段

图4 猪瘟病毒3′NTR富含T的插入序列片段的核苷酸比对排列(从Alfort/187基因组位置12106bp~12185bp)
2.5 野毒株与兔化弱毒疫苗株基因组3′NTR核苷酸序列
从248个临床样本中获得的9个野毒株和8个疫苗型猪瘟病毒的RT-PCR产物用C5和C6做测序引物进行序列测定。DNA测序结果显示9株野毒株猪瘟病毒属于猪瘟病毒2.1a亚群,而8株疫苗病毒是属于1.1亚群(资料没有显示)的LPC株。除此之外,亚群1.1(LPC/AHRI,LPC/PRK和LPC/TS)的3个疫苗株和4个不同基因型(2.1亚群的92-TC1,2.1b亚群的90-YL1,2.2亚群的84-KS1,3.4亚群的85-12A)的野毒株亦都测定序列。这7株的序列提交到GenBank,依次为85-12A(EU107748),84-KS1(EU107749),92-TC1(EU107750),90-YL1(EU107751),LPC/AHRI(EU107752),LPC/TS(EU107753),和 LPC/PRK(EU107754)。RT-PCR 产物直接测序结果显示野毒株基因组缺乏富含T的插入序列,而疫苗株LPC/AHRI含有一个长12bp富含T的插入序列。10个不同质粒克隆测序的结果显示LPC/PRK和LPC/TS依次含有一个大小在32~42个和27~36个核苷酸间富含T的插入序列。含有最长为42bp和36bp的富含T的插入序列的2个克隆分别来源于LPC/PRK和LPC/TS。通过使用上游和下游引物对它们进行测序,并用这两个引物获得了鉴定结果。疫苗株LPC/AHRI,LPC/PRK和LPC/TS的富含T的插入序列的一个序列对比显示,这3株疫苗株富含T 的插入序列长度分别是 12bp、36bp、42bp(图 4)。
包括在这个排列里的22个序列加入如下:Alfort/187(X8739),ALD(D49532),Shimen(AF092448),Alfort/Tubingen(J04358),Bresci(M31769),GXWZ02(AY367767),85-12A(EU107748),84-KS1(EU107449),92-TC1(EU107752),LPC/PRK 疫 苗 株(EU107754),LPC/TS 疫苗(EU107753),LPC/AHRI疫苗株(EU107752),HCLV疫苗株(AF531433),C株疫苗株(Z46258),俄国LK疫苗株(AF026718),俄国CS疫苗株(AF099102),Porcivac疫苗株(AF026714),Povac疫苗株(AF026717),Riems疫苗株(U45477),Riem疫苗株(AY259122),和Riems疫苗株(U45456)。
3 讨论
猪瘟是具有高度接触传染性并保持常态的致死性的猪病。猪瘟兔化弱毒株,例如C株,LPC和HCLV,几乎完全能诱导对猪瘟的保护。因为弱毒疫苗株能在已经种的猪体内持续一长段时间,它们会干扰用实验室诊断检测猪瘟野毒株。在台湾,为了防制猪瘟,已经强制执行弱毒疫苗的接种工作,因此鉴别野毒株和疫苗株是实验室诊断猪瘟必备的、重要的能力。RT-PCR之后测序或用限制性酶切是目前在台湾用于检测猪瘟并排除疫苗病毒干扰的主要方法。在本实验中,为了简化猪瘟鉴别诊断方法,我们基于疫苗株富含T的插入序列建立了一种一步法单管RT-PCR检测技术,可同时检测和鉴别猪瘟病毒野毒株和疫苗株。该技术中RT-PCR扩增产物能通过普通琼脂糖凝胶电泳(图1B,1C,2)或自动高效毛细管电泳进行分析,后者为快速鉴别猪瘟病毒野毒株和疫苗株提供高分辨率和快速分析(图3)。临床试验结果显示248个临床样本中的26个样本(10.5%)通过RT-PCR被鉴别为疫苗病毒。类似的结果在以前的研究实验中获得,133个野外临床分离样品中的18个(13%)来源于疫苗免疫接种猪群,用多重巢式RT-PCR检测显示C株疫苗弱毒的存在。因此,在使用猪瘟活疫苗的国家,在常规猪瘟诊断程序中应该考虑检测到疫苗病毒的可能性。
为了仅能扩增猪瘟病毒不同基因型而不扩增出与之密切相关的2个其他瘟病毒(BVDV和BDV),基于猪瘟病毒基因组保守区设计了2套简并引物。5个不同基因型的猪瘟病毒,包括158个野毒株猪瘟(2.1a,2.1b,2.2和3.4亚群),ALD和CAP株(1.1亚群)以及5个兔化疫苗株(1.1亚群)能被扩增,而且用这2套引物可以鉴别野毒株和疫苗株,而且没有从其他瘟病毒(如BVDV-1,BVDV-2和BDV)为模板中观察到扩增产物,或者以其他常见猪病病毒(如PRRSV,PCV-2和SIV)为模板中观察到扩增产物。这表明所设计的RT-PCR引物是高特异性的。在敏感性试验中,RT-PCR的引物对C5/C6和C3/C6能够各自在一个病毒滴度为6.3和63TCID50/mL时分别检测猪瘟病毒野毒株。而且,C3/C6能够被用作巢式PCR的内源引物而获得更高的灵敏度。该巢式PCR检测限制提高到0.63TCID50/mL。野毒株实验感染的猪,在用RT-PCR检测免疫接种后3d和用巢式PCR检测免疫接种后2d的样品时,被检测出猪瘟病毒显阳性。该试验表明本方法是高灵敏的而且能检测病毒早期感染。
基于单个核苷酸间差异设计特异的TaqManMGB探针,韩国建立一步法实时荧光RT-PCR用于检测疫苗型和野毒株猪瘟病毒。韩国LOM弱毒疫苗株在233nt位置有一个T,但是韩国野毒株病毒和大多数猪瘟病毒在相同的位置有一个G。因此,通过特异的TaqManMGB探针可能鉴别它们。但是,兔化猪瘟疫苗株,例如LPC,HCLV,C株和RiemC,所有的都在233nt位置含有一个G,因此上述实时荧光RT-PCR似乎不适合用于鉴别野毒株和兔化弱毒疫苗株。另一研究报道基于在一个特异性引物的3′末端的2个核苷酸间差异(GT对AC)而建立的多重巢式PCR用于检测和鉴别野毒株和C株。但是,LPC株和野毒株猪瘟病毒有相同的AC等位基因。因此,之前描述的这些引物似乎不适合用于鉴别LPC疫苗株和野毒株猪瘟病毒。最近亦有报道建立实时荧光定量多重RT-PCR用于检测和鉴别野毒株与C株疫苗弱毒。然而,若干台湾的野毒株(P97和0406/TWN)显示探针序列内存在多态性。因此,这些台湾的野毒株很可能不能使用实时荧光定量多重RT-PCR检测。现有研究报道显示,有7个疫苗株病毒基因组3′NTR具有12~14nt富含T的插入序列,同时没有相关报道显示野毒株基因组中存在这类插入序列。结果显示,本试验所建立的RT-PCR技术至少能用于3个兔化弱毒疫苗株检测,即LPC,HCLV和C株。RiemC疫苗株是一个适应细胞培养的HCLV株衍生毒株。GenBank已有的三个RiemC疫苗株序列显示富含T的插入序列区域存在差异。其中一个Riem疫苗株(U45477)缺乏富含T的插入序列;另外一个Riem疫苗株(AY259122)含有一个富含T的插入序列和一个缺失位点点;第三个Riem疫苗株(U45456)含有一个28bp富含T的插入序列(图4)。因此,该检测技术能否用于RiemC疫苗株检测尚需进一步研究。
本研究中发现LPC/PRK和LPC/TS株富含T的插入序列比之前报道的更长。为了确定LPC/PRK和LPC/TS疫苗株富含T的插入序列的精确长度,将这些疫苗株的RT-PCR扩增产物克隆制备质粒并进行测序工作。结果显示LPC/PRK和LPC/TS株富含T的插入序列分别长32~42nt和27~36nt。结合高效毛细管电泳分析的结果确定了最长序列是它们基因组里富含T的插入序列,LPC/PRK 株是 42nt,LPC/TS 株是 36nt。我们在 LPC/ 中国疫苗病毒的衍生毒株基因组中发现42nt与36nt两个不同长度的富含T的插入序列片段(图4)。台湾猪瘟兔化弱毒疫苗株最开始是在20世纪50年代研究生产的。在LEDERLE实验室里,在兔体中已经历大约250次连续传代的一个兔化猪瘟病毒变异Rovac株由Coronel交给了Lee,1952年由Lee从菲律宾引入台湾。由于这个变异株接种猪表现了严重的接种后反应,而且甚至死于明显的猪瘟,为了获得一个安全的疫苗株,病毒需要通过兔体更长的连续传代。在超过800次传代后,适应兔体的病毒已经完全失去了其毒力,而且变成一个保护猪瘟安全有效的疫苗。这个病毒被指定为LPC株或LPC/中国株,而且种毒保存在动物健康研究所(AHRI)中用于活疫苗的制造。LPC/TS疫苗株来源于LPC/中国疫苗株,经过在PK-15(猪肾细胞)的10代细胞系适应后在一个有限稀释度克隆2次,随后在该细胞系里增长21代。为什么原始LPC/中国株含有一个长12nt富含T的插入序列,但是它的衍生毒株LPC/TS含有一个长36nt富含T的插入序列?追溯疫苗发展的过程,发现富含T的插入序列加入在有限稀释克隆期间发生而不是在组织培养中连续传代时发生的。LPC/PRK疫苗株一个长42nt富含T的插入序列也是在有限稀释克隆间获得的。因为LPC/中国疫苗病毒在兔体中经历了1050次连续传代,没有考虑疫苗病毒统一传代次数问题。事实上,疫苗含有几个携带不同长度富含T的插入序列的不同病毒颗粒。携带了长为36nt、42nt富含T的插入序列、适应组织培养的两个兔化疫苗病毒,是在疫苗准备期间意外被选择的。LPC/TS株在PK-15细胞系中增值到107.3TCID50/mL,而且病毒滴度比生长在PK-15细胞中LPC/中国株更高。富含T的插入序列的功能可能增加病毒滴度,以及使得有限稀释的克隆筛选过程中更容易。
综上所述,本研究所建立的简捷一步法RT-PCR,能够提供一个快速、灵敏诊断技术用于特异性检测猪瘟病毒,同时能够鉴别野毒株感染和接种兔化弱毒疫苗株。
