多维离子交换色谱分离和串联质谱鉴定在小鼠肝脏膜蛋白质组分析中的应用
2010-10-21王灼维彭福利徐宁志刘斯奇
王灼维, 彭福利, 王 媛, 童 维, 任 艳, 徐宁志, 刘斯奇*
(1.中国科学院北京基因组研究所,北京101318;2.北京华大蛋白质研发中心有限公司,北京101318)
多维离子交换色谱分离和串联质谱鉴定在小鼠肝脏膜蛋白质组分析中的应用
王灼维1,2#, 彭福利1#, 王 媛1,2, 童 维1,2, 任 艳1,2, 徐宁志2, 刘斯奇1,2*
(1.中国科学院北京基因组研究所,北京101318;2.北京华大蛋白质研发中心有限公司,北京101318)
膜蛋白质在变性剂作用下能够较充分地溶解。根据这一特点,我们试图在变性剂溶液中采用串联离子交换色谱法分离小鼠肝脏膜蛋白质。将小鼠肝脏膜蛋白质溶解于含有4mol/L尿素,20mmol/L三羟甲基氨基甲烷(Tris)-盐酸缓冲液(pH9.0)中,用Q-Sepharose FF和Sephacryl S-200HR树脂组成的色谱柱结合大部分溶解的膜蛋白质,然后采用氯化钠线性梯度洗脱蛋白质,分步收集后采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)进一步分离洗脱组分的蛋白质。利用胶内胰蛋白酶消化技术将SDS-PAGE胶内分离的蛋白质降解为相应的肽段,然后以反相高效液相色谱分离和离子阱质谱仪鉴定肽段。根据文献报道和蛋白质的功能分类,在所鉴定的392个蛋白质中有306个可能为膜蛋白质或膜结合蛋白质。蛋白质的疏水性计算表明,GRAVY(grand average of hydropathicity)得分大于或等于0.00的蛋白质有83个。综上所述,我们有理由认为本实验方法基本符合小鼠肝脏膜蛋白质组学研究的要求。
多维离子交换色谱;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳;反相高效液相色谱;串联质谱;膜蛋白质;小鼠肝脏
Abstract:The analysis of membrane proteins is still a technical obstacle in p roteom ic investigation.A fundamental question is how to allow the hydrophobic proteins fully solubilizing in a p roper solvent environment.We propose that the denatured membrane proteins in high denaturant solution are fully ionized and separated through ion exchange Chromatography.The membrane proteins prepared from a mouse liver were dissolved in4mol/L urea,20mmol/L Tris-HCl buffer(pH9.0),and loaded onto a tandem Chromatography coup led with Q-Sepharose FF and Sephacryl S-200HR.with a linear NaCl gradient elution,the bound proteins were eluted and collected follow ed by sodium-dodecyl sulphate-polyacrylamide gel electrophoresis(SDSPAGE)to further separate the eluted proteins.The protein bound on SDS-PAGE were excised and in-gel digested by trypsin,while the digested pep tides were delivered to reversed-phase high performance liquid Chromatography(HPLC)and ion-trap mass spectrometry for the peptide identifications.O f a total of392proteins identified,306were membrane proteins or membrane associated proteins reported by literature.B ased on the calculation of hydrophobicity,the GRAVY(grand average of hydropathicity)scores of83p roteins are over or equal to0.00.Taking all the evidence,we have established an effective approach which is feasible in the investigation towards mouse liver membrane proteomics.
Key words:multidimensional ion-exchange Chromatography;sodium-dodecyl sulphate-polyacrylamide gel electrophoresis(SDS-PAGE);reversed-phase high perform ance liquid Chromatography(RP-HPLC);tandem mass spectrometry(MS/MS);membrane protein;mouse liver
质膜是细胞与其生长环境相隔离的物理屏障[1]。质膜上存在的多种蛋白质在细胞间的相互作用、信号传导和物质转运等生命活动中发挥着关键作用[2,3]。例如,质膜蛋白质广泛参与药物靶标的识别,大约70%已知的药物靶点都存在于质膜上[4]。值得注意的是,几乎所有的药物都在肝脏中进行修饰和降解。因此,鉴定肝脏膜蛋白质将为设计治疗用单克隆抗体和小分子药物提供有价值的靶标信息[5]。
膜蛋白质的研究是一件富有挑战性的工作,尤其以膜蛋白质的分离技术最为困难。所有的膜蛋白质都具有很强的疏水性,几乎不溶于水溶液[6]。去污剂能够助溶膜蛋白质,但也只是使膜蛋白质与去污剂分子形成均匀悬浮于溶液的微胶粒(micelle),而在这种情况下,蛋白质可能丧失生物活性或者无法进一步分离纯化[7]。另一个困扰研究者的问题是如何使膜蛋白质在长期实验操作中保持溶解状态。在很多情况下,膜蛋白质能够很好地溶解于某种溶液,而在另一种溶液中则发生沉淀,这也是在多步实验操作中丢失膜蛋白质的主要原因。为了避免这类问题的发生,鸟枪法(Shotgun)的蛋白质酶消化技术被广泛地采用[8]。它使我们所面对的待分离对象不再是蛋白质,而是酶消化之后的多肽,这样就能有效地避免膜蛋白质在多步实验中的丢失。然而,这种方法又带来了另外一些技术问题,这些问题在蛋白质组学分析中显得尤为突出。鸟枪法处理之后会产生数量庞大的多肽,这意味着液相色谱的分离容量必须成千百倍地提高。事实上,尽管反相色谱有很好的多肽分离能力,但直到今天它仍无法完成复杂多肽的有效分离[9]。多维色谱是一种提高色谱分离效率的较佳途径。问题是,随着分离步骤的复杂化,多肽的损失也相应地增加,特别是在不同缓冲体系的变换过程中,肽段的损失更加严重。另一个问题也值得我们注意:膜蛋白质在细胞中的丰度较低,如果它们不能得到相对的富集,其肽段信号可能在分离和鉴定的过程中被稀释或抑制[10]。鉴于上述考虑,在采用鸟枪法进行蛋白质组分析时,应针对膜蛋白质的特征设计相对应的合理实验流程。一般而言,膜蛋白质分离应遵守以下3点原则:(1)选用溶解能力强的缓冲溶液,最大限度地溶解膜蛋白质;(2)选择前后一致的溶剂体系,以保持膜蛋白质的溶解状态;(3)尽可能在分离过程中最大程度地富集蛋白质。
蛋白质组学技术的快速发展促进了膜蛋白质分析的研究。已有多篇有关膜蛋白质组分析的报道。B londer等[11]采用两种去垢剂Triton X-100或B rij-96提取大鼠嗜碱性粒细胞的膜蛋白质,并结合16O/18O交换和同位素亲和标签(ICAT)标记的方法定量测定了所鉴定的蛋白质。他们认为,Triton X-100比B rij-96有更好的溶解能力。在Fandino等[12]建立的新方法中,膜蛋白质首先被非变性胶所分离以避免在电泳过程中蛋白质在疏水区凝集,然后将染色的蛋白质区带在胶内与胰蛋白质酶共孵育,消化后的肽段采用液相色谱-质谱联用(LC-MS)的方法加以鉴定。在本文中,我们提出了一种新的分析膜蛋白质的实验方案。与前人做法不同的是,我们首先采用含有变性剂的缓冲液提取小鼠肝组织膜组分中的膜蛋白质,并在同一溶剂条件下利用串联离子交换色谱分离变性的膜蛋白质,并运用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进一步分离各个离子交换柱的洗脱组分,最后结合胶内胰酶消化和LC-MS鉴定各区带中的蛋白质。分析数据表明,在所鉴定的392个蛋白质中有306个可能为膜蛋白质或膜结合蛋白质;疏水性评估指出,83个蛋白质的GRAVY(grand average of hydropathicity)得分大于0.00,是典型的疏水蛋白质。
1 实验部分
1.1 试剂和仪器
盐酸胍、尿素、硫脲、蛋白质酶抑制剂cocktail、三氯乙酸(TCA)、四甲基乙二胺(TEM ED)、甘氨酸、苯甲基磺酰氟(PMSF)、乙腈和考马斯亮蓝R-250等购于Sigm a-A ldrich公司(Steinhe im,Germ any)。SDS、过硫酸铵和所有色谱填料(均为6%琼脂糖交联球体,粒径为45~165μm)购于Am ersham B iosciences公司(Uppsala,Sw eden)。胰蛋白质酶和二硫苏糖醇(D TT)购于Prom ega(M adison,USA)。其他所用试剂的纯度均为分析纯或高于分析纯。
Agilent1100型液相色谱仪(安捷伦公司),LCQ Deca XP离子阱质谱(热电公司),AKTA液相系统(通用电气公司)。
1.2 实验方法
1.2.1 小鼠肝组织膜组分的制备
实验用小鼠(C57BL/6J,7~9周,北京大学实验动物中心)均在无菌条件下饲养,动物实验操作符合中国科学院动物实验委员会的标准。小鼠用戊巴比妥钠麻醉,摘取肝脏,将其切成约3mm3的小块并转入离心管中;用预冷的磷酸缓冲液反复洗涤3次,除去多余的血液成分而后将离心管迅速放入液氮中冷冻保存,备用。1g肝脏组织用5mL的匀浆液(50mmol/L甘露糖,200mmol/L蔗糖,2 mmol/L二乙胺四乙酸(ED TA),1mmol/L PMSF,0.2mmol/L N a2VO3,1mmol/L N aF,蛋白质酶抑制剂cocktail,10mmol/L Tris-HCl(pH 7.4))重新悬浮。用玻璃匀浆器匀浆3次,差速离心提取膜组分。离心方法分别为400g,10m in,取上清液;800g,10m in,取上清液;10 000g,15 m in,取上清液;150 000g,60m in,去上清液,沉淀即为肝脏组织细胞的膜组分。用匀浆液重新悬浮沉淀,反复洗涤两次,除去残留的其他细胞组分。
1.2.2 不同缓冲体系提取膜蛋白质
我们采用了6种不同的膜蛋白质提取缓冲液并检测其提取效率。6种膜蛋白质提取缓冲液分别为:(1)7mol/L尿素和2mol/L硫脲,pH9.0;(2)6mol/L盐酸胍,pH9.0;(3)7mol/L尿素、2 mol/L硫脲和4.5mol/L盐酸胍,pH9.0;(4)3.5 mol/L尿素,1mol/L盐酸胍和5%SDS,pH9.0;(5)7mol/L尿素、2mol/L硫脲、4.5mol/L盐酸胍和2mol/L N aOH,pH13.5;(6)8mol/L尿素,pH11.0。分离的小鼠肝组织膜组分分别用这6种缓冲液重新悬浮,超声3m in,室温静置1h充分溶解膜蛋白质。于40 000g下离心20m in,将上清液转入新的离心管中,用2-D QUAN T KIT(Am ensham B iosciences)测定蛋白质浓度。每种缓冲液提取蛋白质的实验都重复不少于3次,每个样品都重复测定蛋白质浓度2次。将(5)号缓冲液作为检验其他几种缓冲液提取膜蛋白质能力的参考标准。
1.2.3 几种离子交换树脂对蛋白质结合能力的比较
对8种不同的离子交换树脂对蛋白质的结合能力进行了比较。8种树脂分别为:⑴D EAE-Sepharose FF;⑵Q-Sepharose FF;⑶CM-Sepharose FF;⑷SP-Sepharose FF;⑸D EAE-Sepharose FF和CM-Sepharose FF;⑹D EAE-Sepharose FF和CM-SepharoseFF;⑺Q-SepharoseFF和SPSepharose FF;⑻Q-Sepharose FF和SP-Sepharose FF。其中⑴、⑵、⑸、⑺树脂采用缓冲液Ⅰ(20 mmol/L Tris-HC l,4mol/L尿素,pH9.0),⑶、⑷、⑹、⑻树脂采用缓冲液Ⅱ(20mmol/L醋酸钠,4 mol/L尿素,pH6.0)浸泡。将膜蛋白质与泡胀的树脂混合,置于室温下30m in使蛋白质与树脂充分结合。于2 000g下离心10m in,取上清液测定蛋白质浓度,计算结合前后样品中蛋白质总量的比率,得出树脂的蛋白质结合效率。
1.2.4 串联离子交换液相色谱分离膜蛋白质
串联液相色谱采用装有Sephacryl S-200HR和Q-Sepharose FF树脂的色谱柱(1cm×40cm)。树脂在流动相A(20mmol/L Tris-HCl和4mol/L尿素,pH9.0)中泡胀平衡充分后,先将Sephacryl S-200HR填入柱床约16cm,压实后再填入QSepharose FF树脂10cm。填好的柱用流动相A以12mL/h的流速充分平衡。上样10m g膜蛋白质,用流动相B(20mmol/L Tris-HCl、1mol/L N aCl和4mol/L尿素,pH9.0)平衡,梯度洗脱柱上结合的蛋白质。洗脱液中氯化钠溶液的线性梯度为0.2mol/L至1mol/L。
1.2.5 SDS-PAGE分离膜蛋白质
将收集到的膜蛋白质分别与电泳上样缓冲液混合,于95℃下加热3m in使蛋白质充分还原和变性。用12%的聚丙烯酰胺凝胶分离蛋白质,考马斯亮蓝R-250染色,每个泳道切成7份用于胰蛋白质酶消化。
1.2.6 胰蛋白质酶胶内消化膜蛋白质
将凝胶条带用含有50%乙腈的碳酸氢铵溶液(25mmol/L)脱色,而后用D TT(10mmol/L,36℃,1h)和碘乙酰胺(IAM)(55mmol/L,室温,避光,45m in)还原烷基化。用含有50%乙腈的碳酸氢铵溶液(25mmol/L)洗涤条带,乙腈脱水,用SpeedVac离心浓缩系统充分干燥。加入25μL胰蛋白质酶(10ng/μL,25mmol/L碳酸氢铵缓冲液),于37℃下过夜消化;加入含有50%乙腈和2.5%TFA的水溶液(终止液),充分混匀,从胶中抽提消化得到的多肽。
1.2.7 高效液相色谱分离消化后的多肽
多肽混合物用毛细管反相色谱柱(150mm×150mm,C18,5μm,孔径30nm,M icroTech公司)梯度洗脱分离。流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈溶液,流速为2 μL/m in,洗脱梯度为2%B-80%B线性梯度,洗脱时间为80m in。
1.2.8 质谱鉴定蛋白质
色谱分离后的多肽经电喷雾离子化,用离子阱质谱鉴定。质谱仪的参数设定为:喷雾电压3.2 kV,离子传输管150℃,扫描的范围为m/z400~2 000,碰撞能量为35%。得到的数据用SEQU EST软件搜索,数据库为IPI(International Protein Index)的小鼠数据库(http://www.ebi.ac.uk/IPI/IPIhelp.htm l)[13]。
1.2.9 统计分析
实验的平行性用平均值±SD表示。组间差异做Student’s t-检验,p<0.05为差异显著。
2 实验结果
2.1 不同缓冲液对膜蛋白质提取效率的比较
采用6种不同的缓冲液从小鼠肝脏组织膜组分中提取蛋白质,膜组分与缓冲液充分混匀后,经40 000g离心,收集上清液,只发现很少的未溶解物质。膜蛋白质提取效率见表1。从表1可见,除了单独使用8mol/L尿素提取的膜蛋白质明显偏低外,其余5种缓冲液的提取效率无明显差别。pH值是影响膜蛋白质提取效率的关键因素。当pH降到7.0时,在提取液中出现明显的沉淀;pH为6.0时,几乎损失40%的膜蛋白质;pH低至3.0时,损失55%的膜蛋白质。从表1还可见,当缓冲液中尿素浓度达到7mol/L时,已经能够取得较好的提取效果。经还原烷基化后,尿素浓度稀释至4mol/L时也不会发生沉淀。考虑到缓冲液中高浓度变性剂对树脂的损伤,在后续试验中均采用较低浓度的尿素(4mol/L)缓冲液。

表1 不同缓冲液提取膜蛋白质的提取效率Table1 Extraction yields of the membrane proteins with different buffers
2.2 不同离子交换树脂结合膜蛋白质能力的比较
在评价离子交换树脂对膜蛋白质的结合能力时,两个因素需要优先考虑:一是溶液中较低pH可能导致蛋白质的沉淀,所以阳离子交换树脂不是一个理想的选择;二是胍基对蛋白质结合阴离子交换树脂的干扰,即使胍基低至100mmol/L的浓度都会影响蛋白质与树脂的结合,因而应尽量降低缓冲液中胍基的浓度。
我们比较了8种不同的离子交换树脂对膜蛋白质的结合容量,结果列于表2。表2数据显示,在测试的几种离子交换树脂中,Q-Sepharose FF具有较强的蛋白质结合能力。我们进行了混合树脂对膜蛋白质结合能力的测试,结果表明:(1)在使用等体积树脂的条件下,混合树脂并未表现出比单一树脂更好的结合能力;(2)虽然在厂家的推介中Q-Sepharose有着极高的蛋白质结合能力(120HSA m g/mL),但本实验中该树脂对膜蛋白质的结合能力仅为45m g/mL;(3)上样时间和上样膜蛋白质的浓度对膜蛋白质与树脂的结合有很大的影响,延长孵育时间和降低膜蛋白质浓度都能够明显改善膜蛋白质与树脂的结合。我们测试了膜蛋白质浓度与树脂结合膜蛋白质效率的关系,结果见图1。如图1所示,10m g膜蛋白质与0.1mL树脂相混合,只有45%的膜蛋白质能够结合于柱上;0.5m g膜蛋白质与0.1mL树脂相混合,几乎所有(97.87%)膜蛋白质都能结合于柱上。根据这一结果,我们在后续实验中均以0.1mL Q-Sepharose树脂结合0.5m g膜蛋白质的比例上样进行离子交换色谱。

表2 离子交换树脂对膜蛋白质的结合能力Table2 B ind ing capacities of different resins for the membrane proteins

图1 Q-Sepharose FF树脂与膜蛋白质结合能力的分析Fig.1 Capacity of Q-Sepharose FF binding to the membrane proteins
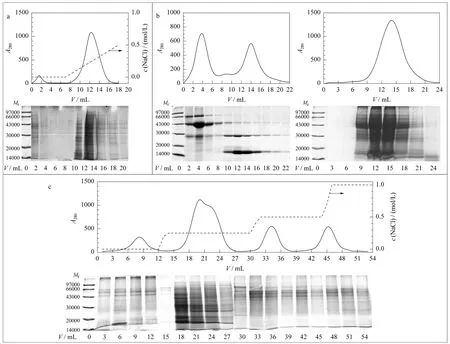
图2 离子交换树脂/SDS-PAGE分离膜蛋白质Fig.2 Separations of the membrane p rote ins using ion exchange chromatography/SDS-PAGE
2.3 液相色谱对膜蛋白质的分离
将Q-Sepharose FF装填至1根柱体积10mL的色谱柱管中用于分离膜蛋白质,以波长280nm的光吸收检测柱后流出蛋白质,并采用自动收集器收集洗脱的膜蛋白质组分(见图2a)。由图2a可见,该色谱柱的分离效率较差,膜蛋白质在一个较小的盐浓度范围内被洗脱出来(氯化钠浓度约为0.25 mol/L)。将Sephacryl S-200HR树脂装填至1根柱体积为30mL的色谱柱管中用于分离膜蛋白质,该色谱柱对相对分子质量(Mr)在10 000~100 000范围内的标准蛋白质有较好的分离,然而对膜蛋白质的分离效率很差(见图2b)。这个结果是可以理解的,因为排阻色谱无法同时达到富集和分离蛋白质的双重目的。此外,我们还用乙腈梯度洗脱的方法对用疏水介质Pheny-Sepharose FF装填的色谱柱进行了测试,结果仍无法令人满意(结果略)。
为了充分利用不同色谱材料的特性,在分离蛋白质时发挥各自优点而避免自身的不足,我们填装了一个串联色谱柱。如前所述,这个串联色谱柱由Sephacryl S-200HR和Q-Sepharose FF两种树脂组成。蛋白质首先通过离子交换色谱分离,而后再通过凝胶色谱分离,分离结果见图2c;与单一树脂相比,串联色谱柱对蛋白质的分离效果有了明显的提高;随着氯化钠浓度的升高,出现了3个很宽的洗脱峰。
2.4 SDS-PAGE对膜蛋白质的分离
经串联离子交换色谱分离且分管收集后的膜蛋白质在4mol/L尿素缓冲液中相当稳定。为了防止溶液更换引起膜蛋白质的沉淀,我们采用SDSPAGE进一步分离这些收集组分的蛋白质。由图2所示,SDS-PAGE能够较好地分离膜蛋白质,而且SDS-PAGE图谱还表明每个收集组分中的蛋白质组成明显不同,意味着串联离子交换色谱有较好的分离效果。在本实验中,我们收集所有洗脱及未结合的组分,并用SDS-PAGE加以鉴定以确定相邻收集组分中蛋白质的重叠程度,这样可以简化下一步蛋白质鉴定的复杂度。
2.5 多肽混合物的反相高效液相色谱分离及离子阱质谱鉴定
将每个SDS-PAGE的电泳泳道均匀地切割成7个区带,采用胶内胰蛋白酶完全消化的方法降解区带内的蛋白质,所产生的肽段用反相高效液相色谱分离,分离后的肽段直接进入离子阱质谱仪进行鉴定分析。图3a为一张离子阱质谱的总离子流图;图3b是图3a中保留时间为45.15m in组分的一级质谱谱图;图3c是母离子为m/z651.78的二级质谱谱图。一般而言,每个区带平均采集到2 497个二级质谱谱图。通过SEQU EST搜索共鉴定出392个非冗余蛋白质。相邻条带间鉴定蛋白质的重叠率为21.34%(数据未展示)。鉴定得到的蛋白质的相关信息详见附表1(http://www.chrom-China.com/qikan/m anage/w enzhang/2009060755.pdf)。
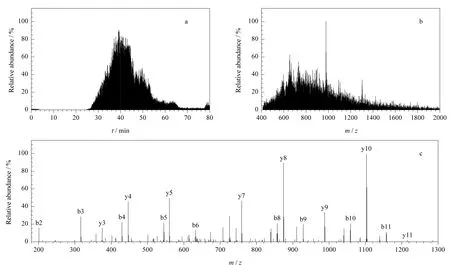
图3 高效液相色谱-离子阱质谱联用鉴定膜蛋白质Fig.3 Iden tifications of the m em b rane p rote ins fraction by HPLC-ion trap M S/M S
2.6 鉴定蛋白质的性质分析
通过GO-slim(http://www.geneontology.org/)分类、文献检索以及grand average of hydropathicity软件(GRAVY score,http://ca.expasy.org/tools/p rotparam.html),我们对所鉴定的蛋白质是否为膜蛋白质进行了理论预测分析。在分析中,如果任一被鉴定的蛋白质满足如下一个条件即可认为它是膜蛋白质或膜结合蛋白质:(1)GO-slim功能分类;(2)文献报道;(3)GRAVY计算得分大于0。根据这个策略,在所鉴定的392个蛋白质中有306个属于膜蛋白质或者膜结合蛋白质(见附表1),其中19.3%(59/306)基于功能分类,55.9%(171/306)基于文献报道,24.8%(76/306)GRAVY得分大于0。详细信息见附表2(网址同附表1)。分类的结果表明,大约78%的鉴定蛋白质可归于膜组成蛋白质。由此可见,利用超速离心制备的肝组织质膜基本符合蛋白质组分析的要求。基于小鼠基因组数据和GO-slim分析,将306个膜或膜结合蛋白质分成9类(见图4a)。图4a表明,与代谢相关的蛋白质占最大比例(37.58%,115/306),其次是与生物合成相关的蛋白质(32.03%,98/306),再次是转运蛋白质(10.78%,33/306),其他的为未分类蛋白质(7.52%,23/306)、膜受体/信号和细胞粘连蛋白质(6.21%,19/306)、分泌蛋白质(3.27%,10/306)、抗凋亡蛋白质(0.98%,3/306)、运输蛋白质(0.98%,3/306)、水解酶/辅助因子(0.65%,2/306)。蛋白质的疏水性质是决定蛋白质能否嵌入双层质膜的关键因素。目前国际上较为广泛地采用GRAVY score来评价膜蛋白质组[14]。在对蛋白质的GRAVY得分的统计分析(见图4b)中,大于或等于0,-0.1,-0.2和-0.5的蛋白质数分别为83,130,199和265。以蛋白质的等电点作为横轴,Mr作为纵轴,虚拟蛋白质在双向电泳凝胶上的分布(见图4c),可发现这些蛋白质主要分布于p I4~12、Mr低于120 000的范围内。

图4 所鉴定的蛋白质的性质Fig.4 Characterizations of the identified proteins
3 讨论
膜蛋白质组分析的困难在于方法学上的限制。早期的蛋白质组研究的重要手段是双向电泳,但这项技术只适合于亲水性蛋白质的分离,对于疏水的膜蛋白质的分离基本上是失败的。近年来一些研究者采用不同的去垢剂溶解膜蛋白质,然后在去垢剂存在的条件下开展等电聚焦分离疏水蛋白质。这些努力固然取得了一些进步,但是距离完全分离膜蛋白质的目标还相差很远。鸟枪法较好地避免了疏水蛋白质的水溶性难题,提高了膜蛋白质鉴定的效率。但是问题也接踵而来。首先,鸟枪法着重于肽段的鉴定,却无法获得完整蛋白质的信息。对于膜蛋白质而言,大部分以多聚物形式嵌于膜内,局部的肽段信息无法体现膜蛋白质的真实状态。其二,膜蛋白质常处在修饰状态,例如磷酸化或糖基化等,部分的肽段鉴定也无法提供修饰蛋白质的准确信息。本文研究的基本出发点就是要在传统的电泳法和鸟枪法之间寻找一种可能的折中的实验方案。一方面,我们希望有可能较为有效地分离完整的膜蛋白质;另一方面,我们又要利用鸟枪法的优势尽可能多地鉴定膜蛋白质。基于这种考虑,我们在本文研究中进行了两项技术革命。其一,我们通过不同变性剂浓度的测试,寻找最佳的膜蛋白质溶解浓度。其中3个因素至关重要:(1)在一定变性剂浓度下膜蛋白质应有较大的溶解度;(2)胰蛋白酶在此变性剂浓度中能够保持足够的水解活性;(3)树脂在此变性剂浓度下仍然具备理想的离子交换能力。最终我们确定4mol/L尿素缓冲液和阴离子交换树脂是小鼠肝脏膜蛋白质分离较为合适的液相色谱体系。其二,我们比较了各种离子交换树脂对膜蛋白质的结合能力,鉴于各种树脂单独使用都有各自的优缺点,我们提出树脂的串联装填方法,以充分利用各个树脂各自的分离优点。事实证明,我们采用Sephacryl S-200HR和Q-Sepharose FF串联色谱可获得相当有效的分离效果。这两项技术革命将有利于膜蛋白质组方法学发展。在未来的研究中,我们将从色谱柱的微量化着手,力图使含量低的膜蛋白质也能在同样的工作系统中得到分离。
利用较高的分辨率和峰容量的串联离子交换色谱技术,我们成功地从小鼠肝脏中分离和鉴定了306个膜蛋白质。在所鉴定的蛋白质中,有多个能量代谢和呼吸链相关的膜蛋白质,如ATP synthase、ATP-citrate synthase、N a+/K+-ATPase、Cytochrom e C、NADH dehydrogenase(ubiquinone)Fe-S p rotein和Cytochrom e P450[15]。我们也鉴定到了一些内质网膜蛋白质,如lam inin recep tor、RER1p rotein和reticulum calcium ATPase2[16]等。值得注意的是,在所鉴定的蛋白质中的确有一部分蛋白质并非经典的膜蛋白质,如脂代谢和核糖体蛋白质,fatty acid transport p rotein和long chain fatty acid CoA ligase等[17,18],去毒性物质酶类,cadherin和glutathione S-transferase等[19,20]。这种现象表明,有一些胞浆蛋白质与细胞膜的联系是相当密切的,利用超速离心方法完全分离膜蛋白质和膜结合蛋白质实际上很困难。为了获取较多的膜嵌合蛋白质,采用低浓度的去垢剂处理膜的制备物将可能清除一些膜结合蛋白质。从这些结果中我们也得到启示,这些胞浆蛋白质可能需要与细胞膜的蛋白质相互作用才能发挥其生物功用。
4 结论
在4mol/L尿素溶液中,采用串联离子交换色谱法能够有效分离小鼠肝脏膜蛋白质。将洗脱成分进一步用SDS-PAGE分离并采用胰蛋白酶完全消化所分离的蛋白质,以反相高效液相色谱分离肽段,以离子阱质谱仪鉴定肽段和蛋白质。在所鉴定的392个蛋白质中,306个可预测为膜蛋白质或膜结合蛋白质。本研究提供了一种新型的、操作简易的膜蛋白质组分析方法。
[1] Josic D,Clifton J G.Proteom ics,2007,7(16):3010
[2] Dorm eyerW,van Hoof D,B raam S R,et al.J Proteom e Res,2008,7(7):2936
[3] Tan S,Tan H T,Chung M C,et al.Proteom ics,2008,8(19):3924
[4] Hopkins A L,Groom C R.Ernst Schering Res Found W orkshop,2003(42):11
[5] Overbye A,Fengsrud M,Seglen P O.Autophagy,2007,3(4):300
[6] ChevalletM,Santoni V,Poinas A,et al.Electrophoresis,1998,19(11):1901
[7] Henningsen R,Gale B L,Straub K M,et al.Proteom ics,2002,2(11):1479
[8] Rietschel B,Arrey T N,Meyer B,et al.Mol Cell Proteom ics,2008,8(5):1029
[9] W olters D A,washburn M P,Yates J R3rd.Anal Chem,2001,73(23):5683
[10] Prinz T,Muller J,Kuhn K,et al.J Proteom e Res,2004,3(5):1073
[11] B londer J,Yu L R,Radeva G,et al.J Proteom e Res,2006,5(2):349
[12] Fandino A S,Rais I,Vollm er M,et al.J mass Spectrom,2005,40(9):1223
[13] Kersey P J,Duarte J,W illiam s A,et al.Proteom ics,2004,4(7):1985
[14] Fischer F,W olters D,RögnerM,et al.MCP,2006,5(3):444
[15] Lee H J,Kw on M S,Lee E Y,et al.Proteom ics,2008,8(11):2168
[16] Hw ang Y Y,LiM D.Proteom ics,2006,6(10):3138
[17] Zhang H,Fan X,Bagshaw R,et al.methods mol B iol,2008,432:229
[18] Riezm an H.Cell,2007,130(4):587
[19] Schum aker L,N ikitakis N,Goloubeva O,et al.Clin Cancer Res,2008,14(18):5877
[20] Clifton J G,Li X,ReutterW,et al.J Chromatogr B,2007,849(1/2):293
Analysis of mouse liver membrane proteins using multidimensionalion exchange chromatography
and tandem mass spectrometry
WANG Zhuow ei1,2#,PENG Fuli1#,WANG Yuan1,2,TONG W ei1,2,REN Yan1,2,XUN ingzhi2,LIU Siqi1,2*
(1.Beijing Institute of Genomics,Chinese Academy of Sciences,Beijing 101318,China;2.Beijing Protein Innovation,Beijing 101318,China)
O658
A
1000-8713(2010)02-0115-08
*通讯联系人:刘斯奇,研究员,博士生导师.Tel:(010)80485324,E-m ail:siqiliu@genom ics.org.cn.
国家高技术研究与发展计划(“863”计划)项目(No.2006AA02A308)和国家自然科学基金项目(No.30700378).
2009-12-18
#并列第一作者.
DO I:10.3724/SP.J.1123.2010.00115
