可见分光光度法测定刺山柑花蕾中总黄酮含量
2010-10-19姜秀娟唐金成白红进
姜秀娟,唐金成,白红进,*
(1.新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300;2.塔里木大学生命科学学院,新疆 阿拉尔 843300)
可见分光光度法测定刺山柑花蕾中总黄酮含量
姜秀娟1,2,唐金成2,白红进1,2,*
(1.新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300;2.塔里木大学生命科学学院,新疆 阿拉尔 843300)
通过不同方法提取刺山柑花蕾中总黄酮,以芦丁为标准品,NaNO3-Al(NO3)3-NaOH体系显色,可见分光光度法测定其含量,检测波长为500nm。结果表明,甲醇回流法提取效果最好,在0~32mg/L(r=0.9997)范围内线性关系良好,平均加标回收率为100.3%,RSD=0.98%(n=6),测得样品中总黄酮平均含量为1.13%。该法操作简便、结果准确,可用于总黄酮的含量测定。
刺山柑花蕾;总黄酮;分光光度法;含量测定
Abstract:Different extraction methods were coupled with visible spectrophotometry to develop a simple and accurate method for quantifying total flavonoids inCapparis spinosaL. buds. The detection wavelength was set at 500 nm. Rutin was used as the standard sample and NaNO3, Al(NO3)3 and NaOH was used to compose the coloration system. Results indicated that the methanol reflux method exhibited the highest extraction rate for total flavonoids. A good linear relationship was observed in the range of 0 to 32 mg/L (r=0.9997) and average recovery rate was 100.3% with a relative standard deviation of 0.98% (n=6). The average content of total flavonoids in the samples from Kuche county, Xinjiang autonomous region was 1.13%.
Key words:Capparis spinosaL. buds;total flavonoids;spectrophotometry;determination
刺山柑(Capparis spinosaL.)为白花菜科山柑属植物,又名老鼠瓜、野西瓜、槌果藤等。主要分布于亚洲西部、欧洲、北美和大洋洲。在我国主产于西北干旱地区,尤其是新疆各沙漠地区。刺山柑最早报道于《新疆中草药》,是一种常用的民族药物[1-2],其次还是优良的固沙植物[3]。据国外文献报道,在地中海地区,刺山柑花蕾被腌制食用,腌制的花蕾以它独特的香味作为调味品在凉拌菜、面食、肉类及酱汁等中长期使用[4-6];用甲醇法提取低温冻干的刺山柑花蕾,在体外的炎症过程中对软骨细胞有保护作用,认为与提取物中含有的黄酮类化合物有关,它具有明显的抗炎、抗氧化作用,其保护作用明显优于常用的消炎药[7-8]。在新疆,刺山柑果实作为一种抗风湿药物在民间广泛应用[3,9],而其花蕾作为食品的应用开发还处于起步阶段[10],为进一步开发利用该植物资源,本实验研究新疆南疆产刺山柑花蕾中总黄酮的提取方法并对其含量进行测定,为深入研究其化学成分和药理活性提供一定的科学依据。
1 材料与方法
1.1 材料、试剂与仪器
刺山柑花蕾于2008年5月采于新疆库车县,样品经阴干,粉碎,密封冷藏保存备用。
甲醇、三氯化铝、亚硝酸钠、硝酸铝、氢氧化钠(均为国产分析纯);芦丁对照品 德国Dr.Ehrenstorfer有限公司。
Cary100紫外-可见分光光度计 澳大利亚瓦里安公司;SK3200H超声波清洗器 上海科导超声仪器公司;ZP-200振荡器 江苏太仓市实验设备厂;RE-50B水浴锅 上海申生科技有限公司。
1.2 方法
1.2.1 黄酮类化合物的定性鉴别
通过颜色反应和纸层析的方法来鉴别黄酮类化合物[11]。
1.2.2 总黄酮含量的测定
利用NaNO3-Al(NO3)3-NaOH比色法测定试液中总黄酮的含量。
1.2.2.1 标准溶液的制备
精密称取120℃干燥至质量恒定的芦丁标准品10mg,置于100mL容量瓶中,加甲醇50mL,超声溶解,加甲醇定容至刻度,摇匀,即得芦丁标准品,其质量浓度为0.1mg/mL。
1.2.2.2 供试品溶液的制备
方法一(超声波提取法):精密称取刺山柑花蕾粉末1.000g于100mL具塞三角瓶中,加甲醇30mL,超声提取30min,滤过,残渣再加入30mL甲醇超声提取30min,滤过,合并滤液,定容于100mL的容量瓶中。平行提取3次。
方法二(热回流提取法):精密称取刺山柑花蕾粉末1.000g于圆底烧瓶中,加甲醇30mL,回流提取1h,滤过,残渣再加入30mL甲醇回流提取1h,滤过,合并滤液,定容于100mL的容量瓶中。平行提取3次。
方法三(振荡浸提法):精密称取刺山柑花蕾粉末1.000g于100mL具塞三角瓶中,加甲醇30mL,振摇提取30min,滤过,残渣再加入30mL甲醇振摇提取30min,滤过,合并滤液,定容于100mL的容量瓶中。平行提取3次。
根据含量比较结果,选择总黄酮含量高的进行提取测定精密度、稳定性、重现性、回收率及含量。
1.2.2.3 吸收波长的确定
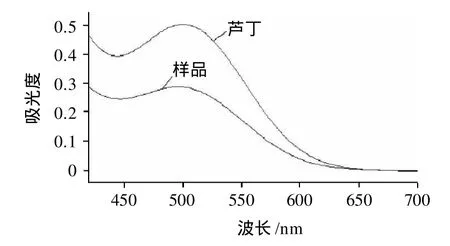
图1 芦丁和样品的扫描光谱Fig.1 Scanning spectra of rutin and samples
精密量取方法一中的供试品溶液6mL置于25mL量瓶中。加质量分数为5%亚硝酸钠溶液lmL,混匀,放置6min;加质量分数为10%硝酸铝溶液1mL,摇匀,放置6min;加质量分数为4%氢氧化钠溶液10mL,再加水至刻度,摇匀,放置15min。以相应试剂为空白,在420~700nm波长范围内扫描光谱,同上操作得同条件下芦丁对照品光谱图。经比较,该法显示供试品与芦丁标准品在波长500nm处有相同的最大吸收,故选用本法来显色。其最大吸收波长为500nm(图1)。
1.2.2.4 标准曲线的绘制[12]
精密吸取1.2.2.1节中芦丁标准品溶液0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0mL分别置于25mL容量瓶中,加甲醇补到10mL,按1.2.2.3节方法操作,以第1份溶液为空白,在500nm波长处测定吸光度,以吸光度(A)为纵坐标、浓度(C)为横坐标,绘制标准曲线,得回归方程:A=0.01825C+0.00493,r=0.9997,RSD=0.49%。表明样品检测浓度在0~32mg/L的范围内与吸光度线性关系良好。
1.2.2.5 精密度实验
精密吸取1.2.2.1节中芦丁标准品溶液0.5mL,置于25mL容量瓶中,共6份,按1.2.2.3节操作,分别测定吸光度。
1.2.2.6 稳定性实验
精密吸取1.2.2.2节方法二中样品溶液2mL,按1.2.2.3节操作,每隔10min测定1次吸光度,共测6次。
1.2.2.7 重现性实验
精密称取一定质量的样品粉末,按1.2.2.2节方法二中方法制备成供试品溶液6份,分别从中精密吸取2mL,按1.2.2.3节操作,测定吸光度。
1.2.2.8 回收率实验
精确称取已知含量的样品0.500g,平行6份,再分别精确加入芦丁标准品溶液(1.04mg/mL)0.5、1.0、1.5、2.0、2.5、3.0mL,按1.2.2.2节方法二中方法制备成供试品溶液,分别从中精密吸取2mL,按1.2.2.3节操作,测定吸光度,计算回收率。
1.2.2.9 样品含量测定
精确吸取1.2.2.2节方法二中样品溶液2.0mL,共3份,分别置于25mL容量瓶中,按1.2.2.3节操作,测定吸光度。
2 结果与分析
2.1 总黄酮的定性鉴别
2.1.1 显色反应结果

表1 显色反应结果Table 1 Results of color reaction
由表1可知,样品液中含有黄酮类化合物。
2.1.2 纸层析
取样品溶液10μL点在滤纸上,用V(正丁醇):V(冰醋酸):V(水)=4:1:5为展开剂,上行展开5h,取出晾干。喷1%氯化铝乙醇溶液,吹干。紫外灯下观察,有黄色荧光斑点。结果表明,样品液中含有黄酮类化合物。
定性检测表明刺山柑花蕾中含有黄酮类化合物,这与文献报道的刺山柑花蕾中含有山奈黄素和槲皮素等黄酮类化合物相一致[7,13-14]。
2.2 不同提取方法的考察

表2 不同提取方法的总黄酮含量Table 2 Contents of total flavonoids in methanol extracts fromCapparis spinosaL. buds prepared by different extraction methods mg/L
由表2可知,热回流提取法总黄酮含量明显高于超声和振摇,故采用热回流提取法。与传统的热回流相比,虽然超声提取法和振摇提取法具有提取时间短、无需加热等优点,但对刺山柑花蕾中总黄酮的提取率不高,这可能与花蕾中含有的黄酮类化合物的种类与结构有关。
2.3 精密度实验

表3 精密度实验Table 3 Precision test
由表3可知,6个平行测定结果的相对标准偏差为1.09%,说明用该方法测定标准溶液中芦丁的含量精密度较好。
2.4 稳定性实验

表4 稳定性实验Table 4 Stability test
由表4可知,样品显色后在60min内的吸光度相对标准偏差为1.14%,说明热回流法提取的样品液稳定性较好。
2.5 重现性实验

表5 重现性实验Table 5 Reproducibility test
由表5可知,6次重复实验结果的相对标准偏差为3.17%,说明热回流法提取的试液重现性良好。
2.6 回收率实验
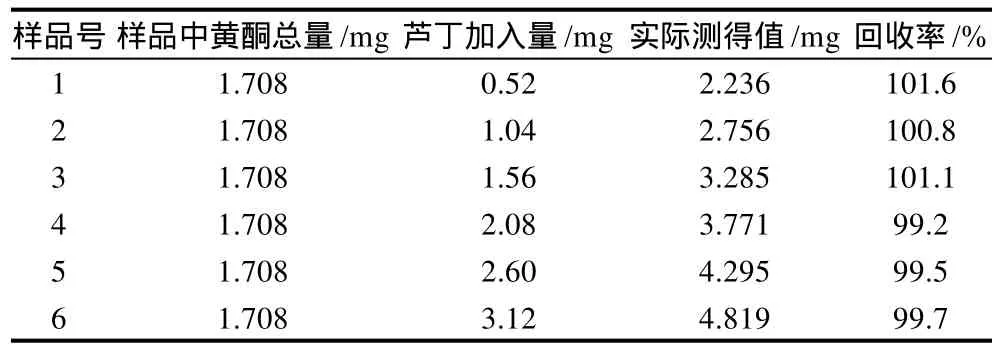
表6 回收率实验Table 6 Spike recovery test
由表6可知,6个回收率实验结果的平均值为100.3%,相对标准偏差为0.98%,说明热回流法提取的总黄酮回收率高。
2.7 样品中总黄酮含量的测定

表7 样品含量测定结果Table 7 Determination results of real samples
由表7可知,采用热回流法提取的总黄酮平均含量为1.13%,说明其花蕾中总黄酮含量较高。
3 结 论
本实验以芦丁为标准品,建立了刺山柑花蕾中总黄酮的含量测定方法。该方法具有线性范围宽、灵敏度高、操作简单、结果准确等优点。
[1] 高莹莹, 敖明章, 万军梅, 等. 维药刺山柑醇提物抗炎镇痛作用的实验研究[J]. 中药材, 2007, 30(6):702-704.
[2] 吾斯曼·吐尔逊. 刺山柑(老鼠瓜)的药用探索[J]. 中国民族医药杂志, 2006, 12(4):33.
[3] 张立运, 杨春. 保护风蚀地的刺山柑[J]. 植物杂志, 2004(1):3-4.
[4] ZARGARI A. Medicinal plants[M]. Tehran:Tehran University Publications, 1986.
[5] ROMEO V, ZIINO M, GIUFFRIDA D, et al. Flavour profile of capers(Capparis spinosaL.) from the Eolian Archipelago by HS-SPME/GCMS[J]. Food Chemistry, 2007, 101(3):1272-1278.
[6] 敖明章, 高莹莹, 余龙江. 刺山柑化学成分及其药理活性研究进展[J]. 中草药, 2007, 38(3):463-467.
[7] GADGOL C, MISHRA S H. Antihepatotoxic activity ofp-methoxy benzoic acid fromCapparis spinosa[J]. Journal of Ethnopharmacol,1999, 66(2):187-192.
[8] PANICO A M, CARDILE V, GARUFI F, et al. Protective effect ofCapparis spinosaon chondrocytes[J]. Life Sciences, 2005, 77(20):2479-2488.
[9] 罗俊, 谢阳. 维药刺山柑果治疗痛风风湿病15例[J]. 中国民族医药杂志, 1999, 5(2):3.
[10] 贾进京, 白红进, 蒋卉. 刺山柑花蕾化学成分的初步研究[J]. 塔里木大学学报, 2007, 19(4):35-37.
[11] 高锦明. 植物化学[M]. 北京:科学出版社, 2003.
[12] 郁建生, 郁建平. 草珊瑚总黄酮提取工艺及其含量动态变化[J]. 中国中药杂志, 2007, 32(4):307-309.
[13] RODRIGO M, LAZARO M J, ALVARRUIZl A, et a1. Composition of capers (Capparis spinosa):influence of cultivar, size and harvest date[J].Journal of Food Science, 1992, 57:l152-l154.
Visible Spectrophotometric Determination of Total Flavonoids inCapparis spinosaL. Buds
JIANG Xiu-juan1,2,TANG Jin-cheng2,BAI Hong-jin1,2,*
(1. Key Laboratory of Protection and Utilization of Biological Resource in Tarim Basin of Xinjiang Production and Construction Corps,Alar 843300, China;2. College of Life Science, Tarim University, Alar 843300, China)
O657.32
A
1002-6630(2010)18-0252-03
2009-11-03
新疆生产建设兵团科学技术局政策引导项目(2006YD29);塔里木盆地生物资源保护利用兵团重点实验室开放项目(BR0609)
姜秀娟(1983—),女,硕士研究生,研究方向为天然产物化学。E-mial:jxjuan2010@126.com
*通信作者:白红进(1967—),男,教授,硕士,研究方向为天然产物化学。E-mail:bhj67@163.com
