碎米制备高果糖浆的工艺
2010-10-19张秋子王泽南吴红引
张秋子,王泽南*,陈 聪,吴红引,李 莹,刘 鹏
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
碎米制备高果糖浆的工艺
张秋子,王泽南*,陈 聪,吴红引,李 莹,刘 鹏
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
研究碎米制备高果糖浆的工艺,主要对碎米葡萄糖异构化制取果葡糖液、钙型树脂分离果糖和葡萄糖获得高果糖浆的工艺进行优化。通过单因素和正交试验,得到制取果葡糖液的最优条件:异构酶加酶量9mg/g碎米葡萄糖、pH7.5、反应温度70℃、反应时间35h;通过正交试验,得到树脂分离制取高果糖浆的最优条件:分离温度70℃、糖液体积分数20%、洗脱液流速4mL/min、进料量40mL。在优化条件下获取的高果糖浆果糖含量为89.64%。
碎米;高果糖浆;异构化;果糖
Abstract:The preparation of high fructose syrup from broken rice based on glucose isomerization to fructose and calcium type ion exchange resin separation between fructose and glucose was optimized using single factor and orthogonal array design methods. The optimal isomerization conditions were found to be:glucose isomerase amount 9 mg/g broken rice; reaction temperature 70 ℃; pH 6.5; and reaction duration 35 h, and the optimal conditions for the separation between fructose and glucose were as follows:separation temperature 70 ℃; sample concentration 20%; elution solvent flow rate 4 mL/min; and sample loading amount 40 mL. The content of fructose of the syrup obtained under the above conditions was 89.64%.
Key words:broken rice;high fructose syrup;isomerization;fructose
碎米是大米加工过程中的副产品,由于碎米中淀粉含量较高,可用于加工淀粉糖类产品以提高其附加值。高果糖浆是以果糖和葡萄糖为主要成分的混合糖,其中果糖含量越高高果糖浆的价值越高[1]。果糖的代谢并不需要胰岛素,其代谢速度比葡萄糖等传统糖都要慢,故不易导致高血糖、发胖和龋齿。高果糖浆作为一种天然甜味剂可以补充蔗糖供应量的不足,在美国、日本等发达国家,高果糖浆已成为人们寻求健康生活的重要糖源,高果糖浆还可广泛应用于医药和烟草等行业中。我国20世纪70年代开始试验性生产高果糖浆,20世纪90年代末期得到较快的发展,目前已形成以玉米淀粉为原料的华南、华中、华东、华北四大生产加工基地[2-5],而以碎米为原料制备高果糖浆尚未见相关报道。本实验探索以碎米为原料制备高果糖浆的优化工艺,利用钙型树脂分离果糖和葡萄糖,旨在提高高果糖浆中果糖的含量和纯度,为提高碎米的经济价值、扩大我国的淀粉糖产业提供试验依据。
1 材料与方法
1.1 材料与试剂
碎米:杂交稻加工副产物,芜湖东源新农村开发股份有限公司。
葡萄糖异构酶(380000U/g) 郑州成果商贸有限公司;强酸性阳离子交换树脂001*7(732) 天津南开大学化工厂;葡萄糖、果糖、氢氧化钠、盐酸、氯化钙、碳酸钠、氢氧化钠、硫酸(均为分析纯)。
1.2 仪器与设备
自动旋光仪 上海科登精密仪器有限公司;手持糖量计 四川成都光学厂;PHS-25B型数字酸度计 上海大普仪器有限公司;高效液相色谱仪 美国Waters公司;1.5cm×50cm层析柱 上海琪特分析仪器厂。
1.3 方法
1.3.1 高果糖浆制备工艺流程
碎米→碎米葡萄糖[5]→葡萄糖异构酶异构化→果葡糖液→灭酶→钙型树脂离子交换→洗脱液→脱色→过滤→浓缩→高果糖浆
1.3.2 操作要点及工艺优化
1.3.2.1 操作要点
碎米葡萄糖的制备[6]:碎米粉碎过80目筛,在90℃、自然pH值、耐高温α-淀粉酶加酶量20U/g、液料比(g/mL)5:1条件下液化25min,然后在60℃、糖化酶加酶量120U/g、pH3.5条件下糖化24h,过滤,过阴阳离子交换柱,得碎米葡萄糖液,配制成质量分数20%的溶液待用。
树脂处理:将树脂分别于0.1mol/L的氢氧化钠和盐酸溶液中浸泡30min,蒸馏水漂洗至中性,湿法装柱,用1mol/L氯化钙溶液过柱,后用70℃去离子水洗涤树脂上多余的Ca2+,将树脂转变成钙型。
洗脱液脱色:洗脱液中加入1%的活性炭,置于60℃水浴锅中加热60min脱色[6]。
1.3.2.2 异构化工艺的优化
由于葡萄糖异构为果糖是可逆反应,当异构反应达到平衡时,果糖和葡萄糖含量最高可达1:1。
以果糖含量作为异构化效果优劣的评价指标,分别对加酶量、pH值、反应温度,反应时间进行单因素试验,在此基础上再进行正交试验,确定最佳工艺条件。每个试验重复两次,取其平均值。初始试验条件:加酶量9mg/g碎米葡萄糖、pH7.0、反应温度60℃、反应时间30h。后续试验依次将前因素的优化值带入。
1.3.2.3 分离条件的优化
采用钙型离子交换树脂分离葡萄糖和果糖。以洗脱液的果糖含量作为分离效果的评价指标,参考文献[7-8],对分离温度(60、70、80℃)、糖液体积分数(20%、30%、40%)、洗脱液流速(2、4、6mL/min)进料量(20、40、60mL)4因素进行L9(34)的正交试验,确定最佳工艺条件。
1.4 相关指标的检测与计算
还原糖含量:菲林试剂法[9];总糖含量测定:手持糖量计;旋光度测定:旋光仪[9];pH值测定:酸度计[9]。
果糖含量测定:
旋光度法[7]:试验过程中普遍采用的方法,用于快速评定优化结果。取试样管长2dm,用以下公式计算:

液相色谱分析法[10]:为了更精确的测定高果糖浆中的果糖含量,对最终获得的最优条件下制取的高果糖浆进行的测定方法。检测器:蒸发光检测器(ELSD);色谱柱:Waters Cosmosil Sugar-D糖柱(4.6mm×250mm,5μm);流动相:乙腈-水(80:20);流速:1mL/min;柱温:30℃;进样量10μL。
2 结果与分析
2.1 异构化工艺的优化
2.1.1 加酶量对异构化效果的影响

图1 加酶量对异构化效果的影响Fig.1 Effect of glucose isomerase amount on glucose isomerization to fructose
由图1可知,随着加酶量增加,异构化作用增强,果糖含量先增大后稳定,在9mg/g碎米葡萄糖时,果糖含量最高。由于酶用量趋于饱和,酶用量的增加对异构化效果的影响减弱。从经济性考虑,选择0.9g/100g碎米葡萄糖为最佳加酶量,此因素不进行正交试验。
2.1.2 pH值对异构化效果的影响
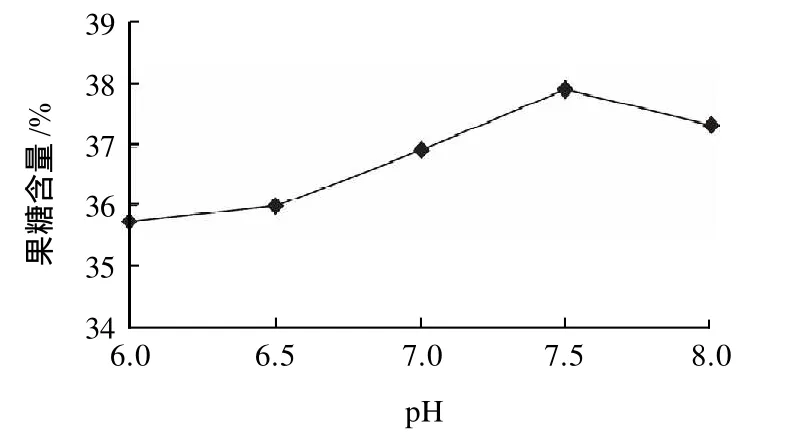
图2 pH值对异构化效果的影响Fig.2 Effect of pH on glucose isomerization to fructose
由图2可知,弱碱性条件下,异构化效果最好,当pH7.5时,异构酶的活性最高,果糖含量最高,但当pH8.0时,果糖含量开始下降。原因是异构酶的最适pH7.5,酸性或碱性条件下,酶的活性减弱。因此选择pH7.5最佳。
2.1.3 反应温度对异构化效果的影响
由图3可知,当温度70℃时,果糖含量最高,反应温度过低时,酶的活性和异构化效果均未达到最优值,而当温度过高时,酶会逐渐失去活性。由于糖类物质在较高温度下易变色[9],故选择50、60、70℃进行正交试验。
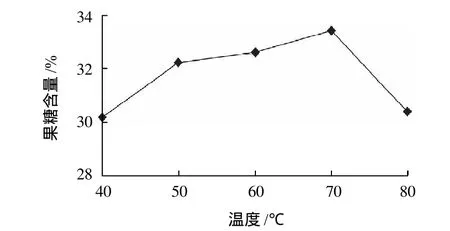
图3 反应温度对异构化效果的影响Fig.3 Effect of reaction temperature on glucose isomerization to fructose
2.1.4 反应时间对异构化效果的影响

图4 反应时间对异构化效果的影响Fig.4 Effect of reaction duration on glucose isomerization to fructose
由图4可知,随着反应时间的增加,异构化效果越来越好。这是由于反应时间越长,异构反应越趋近于葡萄糖与果糖1:1的平衡态,当反应40h时,果糖含量最高。由于40h相对于35h的效果相差较小,综合考虑,选择反应时间为35h最佳。
2.1.5 异构化正交试验结果

表1 异构化正交试验设计及结果Table 1 Arrangement and experimental results of the orthogonal array design for optimizing glucose isomerization to fructose
在单因素试验的基础上,采用L9(34)正交试验考察pH值、反应温度和反应时间3个因素对异构化效果的影响。正交试验设计及结果见表1。
由表1极差分析可知,3个因素的主次关系为C>A>D;最优方案为C3A2D2。C3A2D2在表1中并未出现,但在单因素试验中已出现,且恰为单因素试验中的最优组合,其果糖含量为39.9%,这比表2显示果糖含量最高的5号组合38.3%还要高,因此确定C3A2D2为最优组合。
综上,碎米葡萄糖制备碎米果葡糖液的最佳工艺:加酶量9mg/g碎米葡萄糖、pH7.5、反应温度70℃、反应时间35h。此时旋光度法测得果糖含量为39.9%。
2.2 分离条件的优化
对分离温度、糖液体积分数、洗脱液流速、进料量4个因素进行L9(34)的正交试验,结果见表2。

表2 分离正交试验结果Table 2 Arrangement and experimental results of the orthogonal array design for optimizing separation between fructose and glucose
由表3极差分析可知,4个因素的主次关系为A>B>D>C,最优方案为A3B1D2C1。由于最佳方案未出现在表2中,所以进行验证实验,验证结果A3B1D2C1组合的果糖含量92.5%,比表2中果糖含量最高的7号组合91.2%还要高。综上A3B1D2C1为最优组合,即最佳分离条件:分离温度70℃、糖液体积分数20%、洗脱液流速4mL/min、进料量40mL。此时旋光度法测得果糖含量为92.5%。
2.3 高效液相色谱分析
对最优条件下制取的高果糖浆进行高效液相色谱分析[11-15],结果如图5所示,果糖含量为89.64%,果糖含量较高。
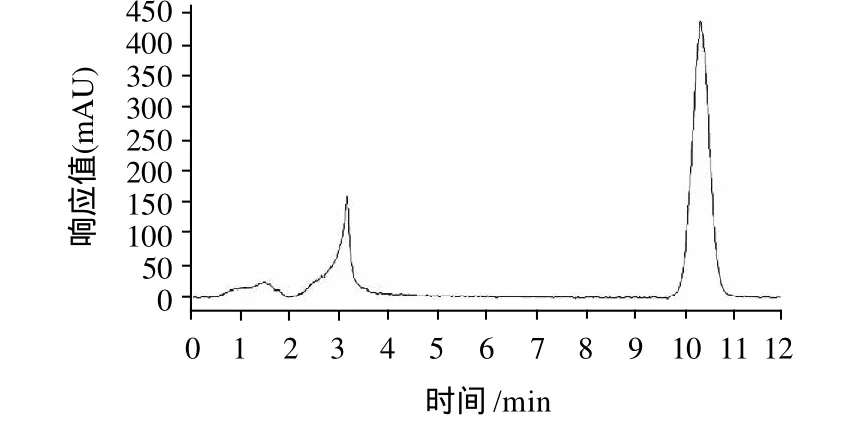
图5 果糖含量的高效液相色谱图Fig.5 HPLC chromatogram for fructose
3 结 论
碎米葡萄糖异构化制备果葡糖液的最佳工艺条件:异构酶加酶量9mg/g碎米葡萄糖、pH7.5、反应温度70℃、反应时间35h。此时旋光度法测得果糖含量为39.9%。
树脂法分离果葡糖液制备高果糖浆的最佳条件:分离温度70℃、糖液体积分数20%、洗脱液流速4mL/min、进料量40mL。通过高效液相色谱测得最优条件下果糖含量为89.64%。
[1] 郭瑞东. 高果糖浆新旧国家标准及国际标准对比[J]. 食品工业, 2005(6):46-47.
[2] 张乐兴, 林象联. 我国高果糖浆的发展现状[J]. 广州食品工业科技,2008(7):48-49.
[3] JOHNSON R, PADMAJA G, MOORTHY S N. Comparative production of glucose and high fructose syrup from cassava and sweet potato roots by direct conversion techniques[J]. Innovative Food Science and Emerging Technologies, 2009(10):616-620.
[4] 扶雄, 徐丽霞, 罗建勇, 等. 果葡糖浆中果糖分离方法研究进展[J].食品科技, 2007(6):17-19.
[5] 张乐兴. 高果糖浆的性质与应用[J]. 广州食品工业科技, 2003, 19(1):44-45.
[6] 李洪波, 王泽南, 张小弓, 等. 碎米制备葡萄糖的工艺研究[J]. 食品科学, 2009, 30(24):134-136.
[7] 晏敏, 李春辰, 范建翔. 钙型色谱树脂分离果葡糖浆的研究[J]. 分离与提取, 2009(1):177-178.
[8] 胡仲禹, 龚劭刚, 邓瑞红, 等. Ca2+型离子交换树脂制取果糖的研究[J]. 江西化工, 2003(1):41-43.
[9] 张水华. 食品分析[M]. 北京:中国轻工业出版社, 2004:48-141.
[10] 顾颂青. 高果糖浆中果糖和葡萄糖的HPLC测定[J]. 中国医药工业杂志, 2002, 33(6):291-292.
[11] JURGENS H, HAESS W, Castarieda T R. Consuming fructose-sweetened beverages increases body adiposity in mice[J]. Obesity Research,2005, 13(7):1146-1156.
[12] 高嘉安. 淀粉与淀粉制品工艺学[M]. 北京:中国农业出版社, 2001.
[13] SINGH R S, DHALIWAL R, PURI M. Production of high fructose syrup fromAsparagus inulinusing immobilized exoinulinase from Kluyveromyces marxianus YS-1[J]. J Ind Microbiol Biotechnol, 2007,34(10):649-655.
[14] 马莺, 王静. 功能性食品活性成分测定[M]. 北京:化学工业出版社,2005:75-78.
[15] KLATT K U, HANISCH F, DUMNEBIER G. Model-based control of a simulated moving bed chromatographic process for the separation of fructose and glucose[J]. Journal of Process Control, 2002(12):203-219.
Preparation Optimization of High Fructose Syrup from Broken Rice
ZHANG Qiu-zi,WANG Ze-nan*,CHEN Cong,WU Hong-yin,LI Ying,LIU Peng
(School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
TS210.9
A
1002-6630(2010)18-0188-04
2010-07-01
安徽省教育厅重点项目(Kj2010A276)
张秋子(1987—),女,硕士研究生,研究方向为生物资源综合利用。E-mail:zhangqiuzi999@qq.com
*通信作者:王泽南(1947—),男,教授,研究方向为农产品加工与贮藏。E-mail:wznan@ah163.com
