海带中叶绿素的提取及间接测定方法研究
2010-10-19贺菊萍唐仕荣祝银银
刘 辉,贺菊萍,秦 杰,唐仕荣,祝银银
(徐州工程学院食品(生物)工程学院,江苏 徐州 221008)
海带中叶绿素的提取及间接测定方法研究
刘 辉,贺菊萍,秦 杰,唐仕荣,祝银银
(徐州工程学院食品(生物)工程学院,江苏 徐州 221008)
采用超声波提取法对海带中叶绿素进行提取,原子吸收光谱法对提取出的叶绿素中的镁离子进行测定,从而间接得出海带中叶绿素的含量。结果表明,超声波提取叶绿素的最佳工艺条件:以无水乙醇与丙酮体积比1:1的混合液为提取剂,按料液比2:15(g/mL),在室温下超声波选择200W的功率提取2次,每次20min。反萃取的最佳测定工艺条件:用浓度为0.9mol/L的盐酸15mL进行反萃取15min。原子吸收法测定检出限为0.008μg/mL,海带中叶绿素的含量5.486mg/g,相对标准偏差0.675%,回收率97.7%。此方法表明:原子吸收光谱法受干扰程度小,且精密度、灵敏度和准确度较高。
海带;叶绿素;超声波提取;原子吸收光谱法
Abstract:Five technological conditions for the ultrasonic-assisted extraction of chlorophyll from kelp were investigated, and the back extraction of the extract with chlorohydric acid for the displacement of magnesium ions by hydrogen ions was optimized using single factor and orthogonal array design methods. Displaced magnesium ions were assayed by atomic absorption spectrometric (AAS) method. Therefore, the content of chlorophyll in kelp could be calculated from obtained magnesium concentration data. Based on these studies, an indirect method for quantifying chlorophyll in kelp has been set up. The optimal conditions for extracting chlorophyll based on the use of an absolute ethanol/acetone mixture as the extraction solvent were found to be:solid/liquid ratio (g/mL) 2:15 and ultrasonic power 200 W for twice extraction for 20 min each time. Chlorohydric acid concentration of 0.9 mol/L, chlorohydric acid amount of 15 mL and back extraction duration of 15 min were found optimal for the displacement of magnesium ions. The limit of detection of AAS method was 0.008 μg/mL. The average content of chlorophyll in kelp (n=5) was 5.486 mg/g, with a relative standard deviation of 0.675% and the average spike recovery for chlorophyll was 97.7%. The developed method for chlorophyll determination has the advantages of little disturbance and high precision, sensitivity and accuracy.
Key words:kelp;chlorophyll;ultrasonic-assisted extraction;atomic absorption spectrometric method
海带是一种营养价值很高的蔬菜,由于海水可被利用的光能要比陆地上少得多,要完成能量的转换,必须增高参与光合作用的叶绿素的含量。所以,一般来说,海带中叶绿素和其他辅助色素的含量高于陆生植物。叶绿素依其结构不同可分为叶绿素a和叶绿素b,其基本结构都是镁结合的卟啉环[1-2]。当前测定叶绿素的常规方法多为溶剂浸提-可见分光光度法[3-7],不足之处在于有机溶剂污染且其他有色物质严重干扰光度法的测定。由于与卟啉配位的镁可被氢置换形成脱镁叶绿素,本实验用超声波萃取分离出叶绿素[8-11],然后用氢离子置换出镁离子,再用原子吸收分光光度法测镁的量即可计算出海带中叶绿素的含量[12-15],旨在为海带的综合利用提供参考,同时也可扩大原子吸收法在分析测试中的应用领域。
1 材料与方法
1.1 材料与试剂
海带丝 市购;无水乙醇、丙酮、氯化钠、盐酸、石油醚(均为分析纯);0.1mg/mL镁标准液(国家二级标准液)。
1.2 仪器与设备
KBS-250型数控超声波细胞粉碎机 昆山市超声仪器有限公司;732C可见分光光度计 上海欣茂仪器有限公司;TAS-990原子吸收分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
称取4g粉碎后的海带于烧杯中,加入30mL有机提取剂,用保鲜膜封口,室温200W超声波提取20min,过滤,收集滤液。
移取8mL滤液于分液漏斗中,加入4mL的石油醚和等量饱和氯化钠溶液萃取,加12mL的超纯水洗涤有机相,重复萃取两次,洗去提取溶剂及无机态盐类,合并石油醚相。于石油醚相中加入0.9mol/L盐酸15mL反萃取15min,分取水相,用超纯水定容于50mL容量瓶中,用原子吸收分光光度计测定此溶液中镁的质量浓度。测定条件为空气-乙炔火焰,镁波长285.2nm,狭缝宽度0.2nm,灯电流3mA,燃烧器高度5.0mm。
原子吸收法测定海带中叶绿素含量的计算,见式(1)。
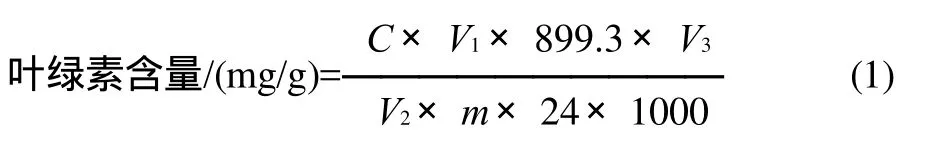
式中:C为由标准曲线得被测试液中镁的质量浓度/(μg/mL);m为称样量/g;V1为混合提取液的总体积/mL;V2为移取石油醚相的体积/mL;V3为返萃水相的定容体积/mL;899.3为叶绿素a、叶绿素b的平均摩尔质量/(g/mol);24为镁的摩尔质量/(g/mol)。
2 结果与分析
2.1 超声波提取法条件的选择
2.1.1 提取剂的选择
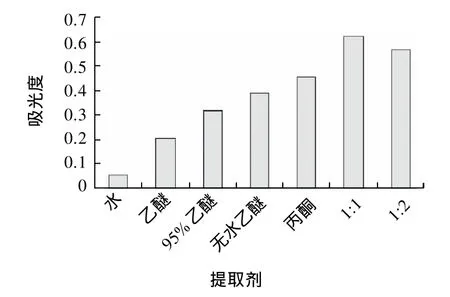
图1 不同提取剂对吸光度的影响Fig.1 Effect of extraction solvent type on chlorophyll yield
由图1可知,不同的提取的其提取效果差异比较大,混合液的提取效果要比单一试剂好。混合液从海带中直接提取叶绿素效率明显提高,可以认为是一种协萃现象。根据实验结果,选择混合液A(无水乙醇:丙酮=1:1)为提取剂。
2.1.2 提取剂用量的选择
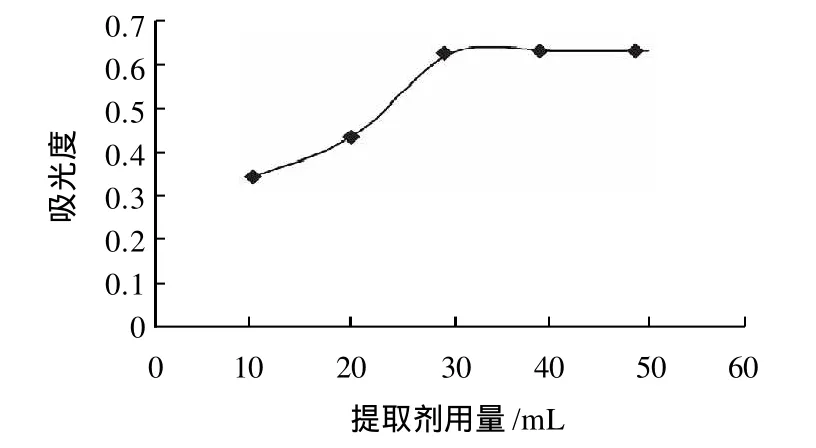
图2 提取剂用量对吸光度的影响Fig.2 Effect of extraction solvent amount on chlorophyll yield
由图2可知,不同的提取剂用量对提取效果影响明显。提取过程中当包容固体的溶液的溶质浓度和浸出液溶质浓度相等时,提取达到平衡。提取剂用量较少时,叶绿素浸出液的吸光度较小,当提取液用量增至30mL时,吸光度继续增大,但是幅度不大,综合考虑溶剂消耗和回收溶剂的成本,选择料液比2:15(g/mL)较为适宜。
2.1.3 提取时间的选择

图3 提取时间对吸光度的影响Fig.3 Effect of extraction duration on chlorophyll yield
由图3可见,提取初期,随着提取时间的延长,吸光度不断增加,当提取时间为20min时,吸光度最大,后来吸光度基本保持不变,考虑到节省时间,所以选择提取时间20min。
2.1.4 提取功率的选择

图4 提取功率对吸光度的影响Fig.4 Effect of ultrasonic power on chlorophyll yield
由图4可见,起初吸光度随着超声波功率的上升而增加,当功率达到200W时,吸光度达到最大值。超声波功率继续上升时,吸光度反而下降,其原因可能功率太高,对叶绿素分子会有一定的破坏作用,致使色素提取效率降低。所以选择提取功率200W。
2.1.5 提取次数的选择

图5 提取次数对吸光度的影响Fig.5 Effect of extraction number on chlorophyll yield
由图5可知,第1次提取已经把绝大部分的叶绿素提取出来,第2次提取量仅仅是第1次的18%,第3次为第1次的6.8%,第4次仅为第1次的1.4%。因此,超声波提取海带中的叶绿素,没有必要进行多次提取,二级提取已经足够。
2.1.6 超声波提取条件的确立
超声波提取海带中叶绿素的最佳工艺条件:使用无水乙醇与丙酮配比为1:1(体积比)的混合液为提取剂,料液比为2:15(g/mL),在室温条件下超声波功率200W提取2次,每次20min。
2.2 反萃取条件选择
2.2.1 反萃取盐酸浓度的选择
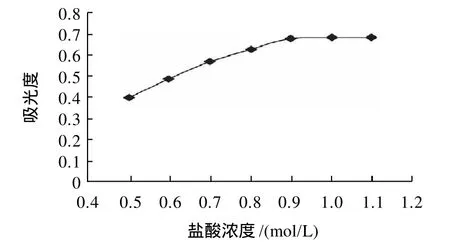
图6 反萃取盐酸浓度对吸光度的影响Fig.6 Effect of chlorohydric acid concentration on the displacement of magnesium ions
由图6可看出,随着盐酸浓度的增加,反萃取出的镁离子量先逐渐增加后基本保持不变。当盐酸浓度为0.9mol/L时,反萃取效果最好,反萃取较完全,且盐酸的浓度不是很大,不会对原子吸收分光光度计有损坏。因此,实验选择0.9mol/L的盐酸作为反萃取试剂。
2.2.2 反萃取盐酸用量的选择
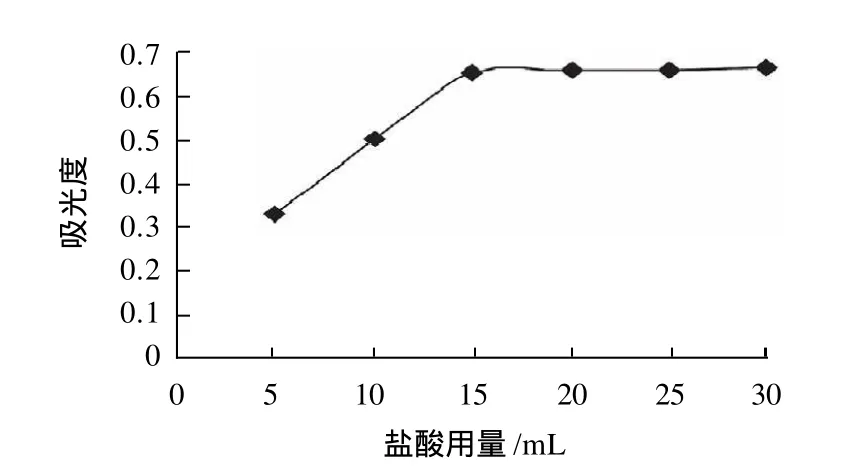
图7 反萃取盐酸用量对吸光度的影响Fig.7 Effect of chlorohydric acid amount on the displacement of magnesium ions
由图7可看出,当盐酸用量为15mL时,反萃取效果最好,随着盐酸用量的继续增加,吸光度基本保持不变,从实际成本的角度考虑,使用反萃取盐酸的用量为15mL。
2.2.3 反萃取时间的选择
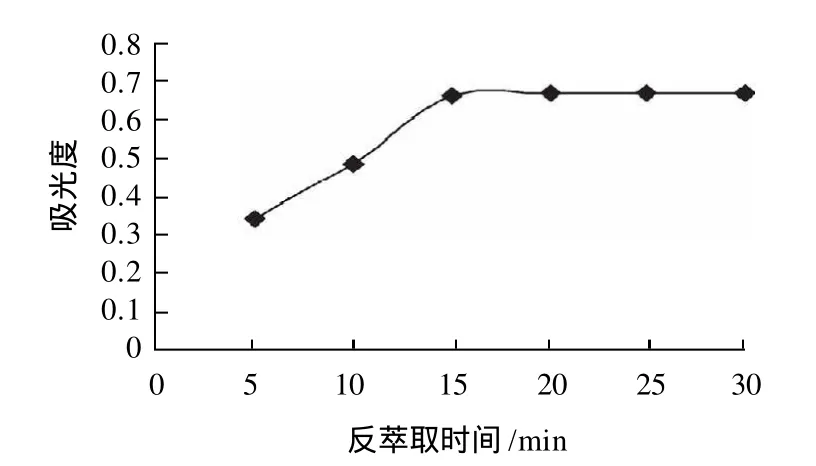
图8 反萃取时间对吸光度的影响Fig.8 Effect of back extraction duration on the displacement of magnesium ions
由图8可看出,当用0.9mol/L盐酸15mL反萃取15min时吸光度达到最大,继续延长反萃取时间,吸光度增加不是很明显。所以考虑到节约时间,反萃取15min效果最好。
2.2.4 正交试验优化
考虑到叶绿素反萃取过程中盐酸浓度、反萃取时间、盐酸用量因素的相互影响,建立三因素三水平正交表,因素水平设定及结果见表1、2。

表1 反萃取正交试验因素水平设定Table 1 Factors and levels in the orthogonal array design for optimizing back extraction conditions
由表2可以看出,试验中A2B2C3方案的吸光度最大,即叶绿素的含量最高。根据极差R值进行分析,各因素的主次关系为A>B>C,而分析最佳为A2B2C2。
由于分析得到的最佳水平组合和实际得到的最优水平组合不一致,因此将A2B2C3与A2B2C2做对比实验,结果A2B2C2的值较大,吸光度为0.756。故海带中叶绿素反萃取的最佳提取条件为用0.9mol/L的盐酸15mL反萃取15min。
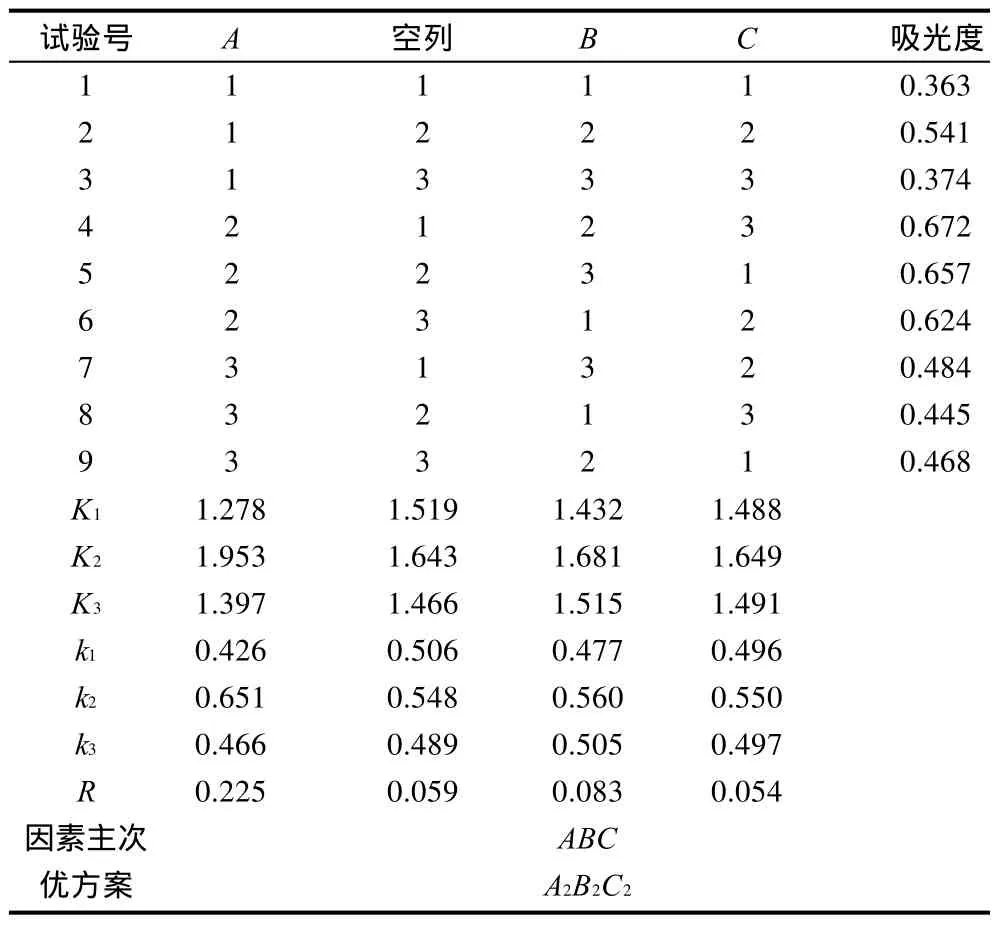
表2 反萃取正交试验设计及结果Table 2 Arrangement and experimental results of the orthogonal array design for optimizing back extraction conditions
2.3 镁标准曲线
在实验条件下,镁的含量在0.1~4.0μg/mL范围内线性关系良好。回归方程为A=0.2404c+0.0029,线性相关系数为0.9992,检出限为0.008μg/mL。
2.4 干扰离子实验
向样品的超声波提取液中分别加入1mL的50μg/mL的Ca2+、SO42-、PO43-离子,按实验方法进行分析测定。实验结果见表3。

表3 离子干扰的检测Table 3 Disturbing effect of other ions on the determination of magnesium ions
由表3可见,大量的Ca2+、SO42-、PO43-离子对测定结果几乎没有影响,可能是在水洗过程中这些无机离子被水洗去,且原子吸收光谱法测量的是离子主要针对镁离子,其他离子的干扰影响几乎很小,可以忽略不计。
2.5 标准加入萃取回收实验
在选定的最佳条件下,对海带中的镁进行加标回收率实验,结果见表4。
由表4可以看出,原子吸收光谱法测得海带中叶绿素的含量为5.486mg/g,相对标准偏差为0.675%,回收率约为97.7%,结果令人满意。

表4 原子吸收法海带中叶绿素含量Table 4 Contents of chlorophyll in kelp determined by AAS method
2.6 国标法测定样品中叶绿素含量
取1mL超声波萃取后的提取液,于1L容量瓶中,加水稀释,定容,摇匀后,按国标方法[15]测得在649nm和665nm波长处的吸光度,再利用公式计算出叶绿素含量,结果见表5。

表5 国标法测定海带中叶绿素含量Table 5 Contents of chlorophyll in kelp determined by the national standard method
由表5可以看出,国标法测得海带中叶绿素的含量为4.949mg/g,相对标准偏差为1.090%,与上述的原子吸收光谱法相比较,很明显不如原子吸收光谱法测量的精密度高。
3 结 论
3.1 采用超声波提取法对海带中叶绿素进行提取。具有提取速度快、产率高、无需加热、节约能源等优点。
3.2 通过测定海带中叶绿素的含量,探索了用原子吸收分光光度法间接测定绿色植物中叶绿素含量的方法。此法具有样品处理简单、测定准确、灵敏度高、干扰少,具有特效性等优点,明显优于国标法。
[1] 王宝增. 叶绿素降解代谢的研究进展[J]. 生物学教学, 2010, 35(2):7-8.
[2] 魏宝峰, 赵世匡, 黄捷. 叶绿素的化学变化机理及其绿色保护途径[J]. 大连轻工业学院学报, 1994, 13(3):49-55.
[3] 张志良, 瞿伟菁. 植物生理学实验指导[M]. 3版. 北京:高等教育出版社, 2004:63-70.
[4] 浅原照三. 溶剂手册[M]. 邵进杰, 朱仁, 张凤桂, 译. 北京:科学出版社, 1993.
[5] 张爱军, 沈继红, 王能飞, 等. 海蓬子叶绿素成分的分析测定[J]. 中国食品添加剂, 2006(2):159-161.
[6] 苏正淑, 张宪政. 几种测定植物叶绿素含量的方法比较[J]. 植物生理学通讯, 1989(5):77-78.
[7] 杨振德. 分光光度法测定叶绿素含量的探讨[J]. 广西农业大学学报,1996, 15(2):145-150.
[8] 洪法水, 魏正贵, 赵贵文. 菠菜叶绿素的浸提和协同萃取反应[J]. 应用化学, 2001(7):532-535.
[9] 任清国, 于才渊, 才洁. 微波预处理萃取蚕沙中叶绿素的研究[J]. 辽宁化工, 2004, 33(11):624-626.
[10] 陈正, 刘常坤. 超声波萃取菠菜中叶绿素的研究[J]. 化学与生物工程, 2004(6):37-38.
[11] 李胜生, 董元华, 刘云, 等. 微囊藻中叶绿素a提取方法的优化[J]. 环境监测管理与技术, 2008, 20(4):43-45.
[12] 徐绍炳, 吴一微, 郑颖. 原子吸收光谱法间接测定樟树叶片中叶绿素总量[J]. 福建分析测试, 2006, 16(2):5-8.
[13] 钟爱国. 超声波提取-原子吸收法间接测定叶片中的叶绿素总量[J].现代科学仪器, 2003(3):70-71.
[14] 左银虎. 原子吸收法间接测定叶绿素总量[J]. 分析化学, 1998, 26(8):1033.
[15] GB/T 22182—2008 油菜籽叶绿素含量测定:分光光度计法[S].
Extraction and Indirect Measurement of Chlorophyll in Kelp
LIU Hui,HE Ju-ping,QIN Jie,TANG Shi-rong,ZHU Yin-yin
(College of Food (Biological) Engineering, Xuzhou Institute of Technology, Xuzhou 221008, China)
TS254.58;TS254.7
A
1002-6630(2010)18-0178-04
2010-06-11
刘辉(1969—),女,副教授,硕士,研究方向为分析与检测。E-mail:1hljfish@126.com
