酶解花生蛋白制备功能性短肽条件优化研究
2010-10-19范远景孟凡莉易苗苗高海成张华传陈苏霞
范远景,孟凡莉,易苗苗,高海成,陈 伟,张华传,陈苏霞
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.安徽凯利粮油食品有限公司,安徽 合肥 231600)
酶解花生蛋白制备功能性短肽条件优化研究
范远景1,孟凡莉1,易苗苗1,高海成1,陈 伟2,张华传2,陈苏霞2
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.安徽凯利粮油食品有限公司,安徽 合肥 231600)
为优化Alcalase蛋白酶酶解花生蛋白制备功能性多肽的工艺条件,采用响应面分析法,以水解度、短肽得率为响应值,研究温度、pH值、底物质量分数、酶底比对制备功能性多肽工艺的影响。综合考虑成本和工艺要求等问题,最终确定酶解花生蛋白制备功能性多肽的工艺条件为温度55℃、pH8.4、底物质量分数4.31%、酶底比3.39%、时间4h。该条件下水解度(DH)及三氯乙酸可溶性氮溶解指数(TCA-NSI)分别为23.40%和74.88%,与理论值的相对误差在0.5%以内,优化工艺稳定,DH及TSA-NSI较高,实验结果与模型预测值相符。
花生蛋白;功能性多肽;酶解;响应面分析法
Abstract:In the present study, alkaline protease hydrolysis was used for the preparation of functional polypeptides from peanut protein. In order to optimize the enzymatic hydrolysis of peanut protein, the effects of temperature, pH, substrate concentration, enzyme amount on degree of hydrolysis (DH) and trichloroacetic acid nitrogen solubility index (TCA-NSI) were explored using response surface methodology. The optimal conditions for achieving both high DH and TCA-NSI were found to be hydrolysis temperature of 55 ℃, pH 8.4, substrate concentration of 4.31%, protease amount of 3.39% and hydrolysis time of 4 h. Under these optimal conditions, a DH of 23.40 and a TCA-NSI of 74.88% were obtained. The experimental values were consistent with the predicted ones with a relative error within 0.5%, indicating that these optimized hydrolysis conditions are reliable.
Key words:peanut protein;functional polypeptide;enzymatic hydrolysis;response surface methodology
花生蛋白中氨基酸分布广泛,含有人体必需的8种氮基酸,属于完全蛋白。在人体必需的8种氨基酸中,除蛋氨酸含量较低外,赖氨酸、色氨酸、苏氨酸含量均接近联合国粮农组织所规定的标准,而其他4种氨基酸含量也接近或超过了此标准,其构成比例适中,而且赖氨酸含量比大米、小麦、玉米粉高3~8倍,其有效利用率达98.94%,而大豆中的赖氨酸有效利用率仅为78%。花生中富含精氨酸、谷氨酸和天门冬氨酸,精氨酸具有调节血糖、有效保护肝脏、增强人体免疫力和抗疲劳等功效,后两种氨基酸则对脑细胞发育和增强记忆力有良好的促进作用[1-3]。
生物活性短肽具有免疫调节、激素调节、降血压、降血脂、抗疲劳、抗氧化等生理调节功能,是当前国际医药界、食品界最热门的研究课题和极具发展前景的功能因子[4-7]。虽然国内外对植物蛋白活性肽的研究达到了一定水平,相关产品已应用于医疗保健,但主要为大豆活性肽产品,而对花生短肽的研究才刚刚起步,相关产品开发甚少,无法满足食品需求[8-10]。在我国花生长期以来大都用作榨油和饲料,存在很大的资源浪费[11-12]。因此开发花生活性肽可以改善这类局面。
本实验针对短肽类产品低水解度、低得率的问题,进行深入研究,以冷榨花生蛋白粉为原料,利用酶法水解工艺制备花生短肽,通过考察温度、pH值、底物质量分数、酶底比对碱性蛋白酶酶解花生蛋白的影响,利用二次回归正交旋转组合设计方法确定最佳酶解工艺条件,从而制备出高得率和高水解度的功能短肽。为花生功能性短肽产业提供依据。
1 材料与方法
1.1 材料与试剂
花生蛋白粉(自制);碱性蛋白酶(食品级) 南宁庞博生物工程有限公司;三氯乙酸(分析纯) 广东汕头市西陇化工厂;牛血清蛋白(分析纯) Solarbio公司。
1.2 仪器与设备
KA-1000离心机 上海安亭科学仪器厂;R-210旋转蒸发仪 上海申胜生物技术有限公司;752紫外-可见分光光度计 上海光谱仪器有限公司;LGL-12冷冻干燥机 北京松源华兴科技发展有限公司;精密pH计 上海虹益仪表有限公司。
1.3 方法
1.3.1 制备花生短肽的工艺路线
花生分离蛋白(过100目筛)→用蒸馏水配制成8g/100mL→碱溶酸沉→酶解→离心→水解液→灭酶→水解蛋白液→分离→水解蛋白短肽
碱溶酸沉条件:pH8.50、温度60℃、提取时间2h;酶解条件:在55℃、pH8.0、加入3%(酶与花生蛋白的质量比)碱性蛋白酶,酶解5h;离心条件:4000r/min、离心10min;灭酶条件:90℃加热15min。
1.3.2 测定方法
1.3.2.1 水解度的测定
水解度(DH)采用pH-stat法[13-14]测定。
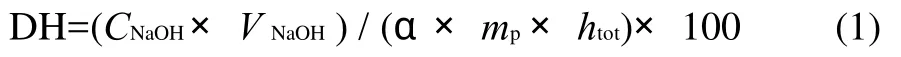
式中:DH为水解度/%;VNaOH为碱液体积/mL;CNaOH为碱液的浓度/(mol/L);α为氨基的解离度,α=[10(pH-pK)]/[1+10(pH-pK)],其中pK值为a-氨基酸的平均pK值,取7.0;pH为反应起始的pH值;mp为底物中蛋白质总质量/g;htot为底物中蛋白质中肽键总数/(mmol/g),对花生蛋白而言,htot=7.13(根据花生蛋白的氨基酸组成计算得到)。
1.3.2.2 短肽得率测定
短肽得率采用三氯乙酸-可溶性氮法(TCA-NSI)[15]测定。可溶性氮溶解指数(TCA-NSI)按式(2)计算。
TCA-NSI=TCA上清液总氮量/蛋白溶液总氮量×100% (2)
1.3.3 响应曲面(response surface methodology,RSM)分析
中心组合设计(central composite-orthogonal design,CCD)是研究多因素问题强有力的工具,在食品工业中应用最为广泛[16]。本实验在完整的单因素试验结果基础上,采用SAS8.1设计了四因素五水平的CCD。
2 结果与分析
2.1 酶解条件的单因素试验
因各种蛋白酶的底物特异性及作用位点的差异,不同蛋白酶作用于花生蛋白而得到的酶解产物的功能也有所不同。因此在本课题的前期研究工作中[17],在采用碱性蛋白酶、风味酶、木瓜蛋白酶、胰蛋白酶、胃蛋白酶各自的最适温度、pH值及底物质量分数([S])、酶底比([E]/[S])、反应时间的条件下酶解花生分离蛋白4h,并根据5种不同蛋白酶的水解度(DH)和三氯乙酸可溶性氮溶解指数(TCA-NSI)筛选出最合适的酶种为碱性蛋白酶(Alcalase)。
在酶种确定的前提下,影响蛋白质水解物的DH和TCA-NSI的主要因素有底物质量分数、酶底比、反应温度、pH值及时间等[7],因而单因素试验分别讨论了上述因素对酶解效果的影响。
2.1.1 不同温度对DH和TCA-NSI的影响
碱性蛋白酶在50~65℃范围内水解花生蛋白时的DH和TCA-NSI的变化如图1所示。
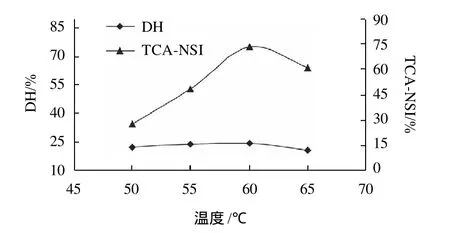
图1 温度对DH和TCA-NSI的影响Fig.1 Effect of hydrolysis temperature on DH and TCA-NSI
图1结果显示:在50~60℃过程中体系的DH和TCA-NSI逐渐上升,在60℃左右时DH和TCA-NSI最大,60℃以后体系的DH和TCA-NSI逐渐下降。因此碱性蛋白酶水解花生蛋白的最适温度在55~60℃。
2.1.2 不同pH值对水解DH和TCA-NSI的影响
碱性蛋白酶在pH6.0、7.0、8.0、9.0、10.0条件下水解花生蛋白时的DH和TCA-NSI的变化如图2所示。
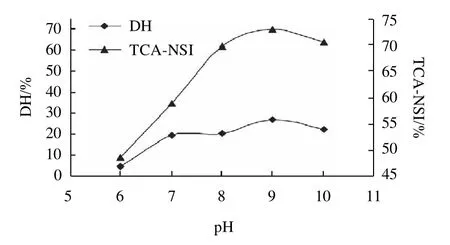
图2 pH值对DH和TCA-NSI的影响Fig.2 Effect of pH on DH and TCA-NSI
由图2可知,pH值小于7.0时体系的DH及TCANSI都很小,说明碱性蛋白酶更适合于碱性环境。随着pH值增大,体系的DH及TCA-NSI都逐渐上升,到pH9.0时,二者都达到最大值,pH9.0以后体系的DH及TCANSI都有下降的趋势。可见碱性蛋白酶的最适pH值在8.0~9.0之间。考虑到pH值从8.0上升到9.0短肽得率并没有多大提高,而且在实际生产中pH值的升高会增加脱盐的成本,因此确定pH值为8.0。
2.1.3 底物质量分数对DH和TCA-NSI的影响
碱性蛋白酶在底物质量分数4%~12%范围内水解花生蛋白时的DH和TCA-NSI的变化如图3所示。
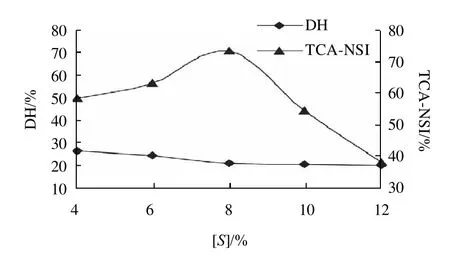
图3 底物质量分数对DH和TCA-NSI的影响Fig.3 Effect of substrate concentration on DH and TCA-NSI
由图3可知,底物质量分数对DH和TCA-NSI的影响不完全一致。底物质量分数在4%~12%范围内,体系的DH是呈下降趋势,存在明显的底物抑制现象。当底物质量分数从4%增加到8%时,DH下降幅度较大,而后幅度逐渐变小。另一方面,底物质量分数对TCANSI的影响曲线呈钟形,底物质量分数4%~8%之间,TCA-NSI随着底物质量分数增大而增大,8%时达到最大,之后随着底物质量分数增大而逐渐变小。综合DH和TCA-NSI两个指标考虑,碱性蛋白酶水解花生蛋白的最适底物质量分数在6%左右。
2.1.4 酶底比对DH和TCA-NSI的影响
碱性蛋白酶在酶底比0.5%~8%范围内水解花生蛋白时的DH和TCA-NSI的变化如图4所示。

图4 酶底比对DH和TCA-NSI的影响Fig.4 Effect of enzyme-to-substrate ratio on DH and TCA-NSI
如图4可以看出,酶底比在0.5%~8%范围内,DH和TCA-NSI的变化呈现相似的趋势,在酶底比0.5%~3%之间,DH和TCA-NSI随着酶底比的增加而快速增加,酶底比4%以后DH和TCA-NSI的增幅并不明显。因此当酶底比达到4%时,再进一步增加酶底比对提高肽的得率已没有明显效果,此时蛋白酶对底物的作用位点已大大减少,因而水解度随着酶底比的加大基本不再变化。由此确定碱性蛋白酶最适酶底比在3%~4%之间。
2.1.5 反应时间对DH和TCA-NSI的影响
碱性蛋白酶水解花生蛋白0~5h内DH和TCA-NSI的变化如图5所示。
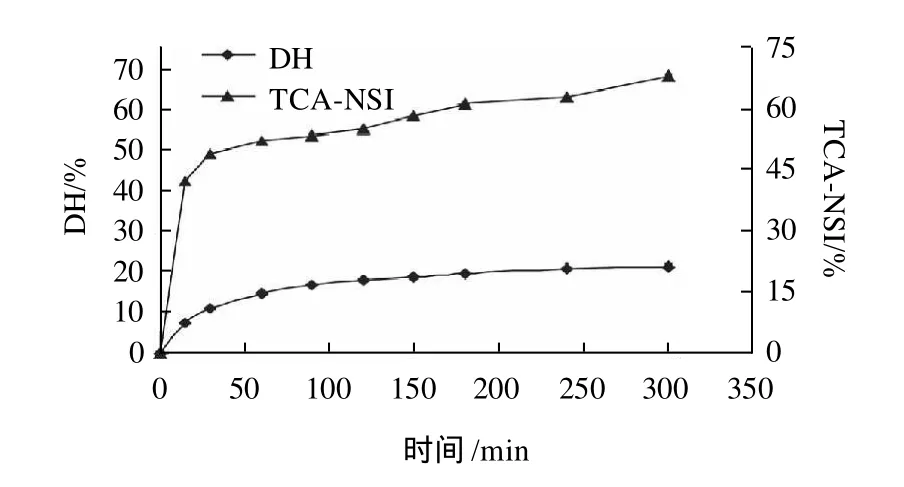
图5 反应时间对DH和TCA-NSI的影响Fig.5 Effect of hydrolysis time on DH and TCA-NSI
由图5可知,碱性蛋白酶水解花生蛋白分为两个阶段,前120min水解反应比较迅速,DH和TCA-NSI呈快速上升趋势,水解120min时DH和TCA-NSI分别达到17.80%和54.94%。240min之后水解反应速度减缓,DH和TCA-NSI的上升幅度减小。因此,确定碱性蛋白酶最适水解时间在240min左右。
2.2 二次回归正交旋转组合试验
采用二次回归正交旋转组合试验,在碱性蛋白酶单因素试验确定酶解4h的基础上进行组合设计。以水解温度、pH值、底物质量分数和酶底比4个因素共同作用,以DH和TCA-NSI为响应值,按照表1的试验设计进行四因素五水平共31次试验点的响应面分析,运用SAS8.1统计软件对数据进行分析处理,建立DH和TCANSI与各因素关系的数学模型,并通过对模型的分析以获得最佳的水解工艺条件。

表1 中心组合试验因素水平编码表Table 1 Factors and levels in the central composite design
2.2.1 DH回归方程的建立与检验
根据表2结果计算各项回归系数,建立DH(Y1)与4因素的数学回归模型为:

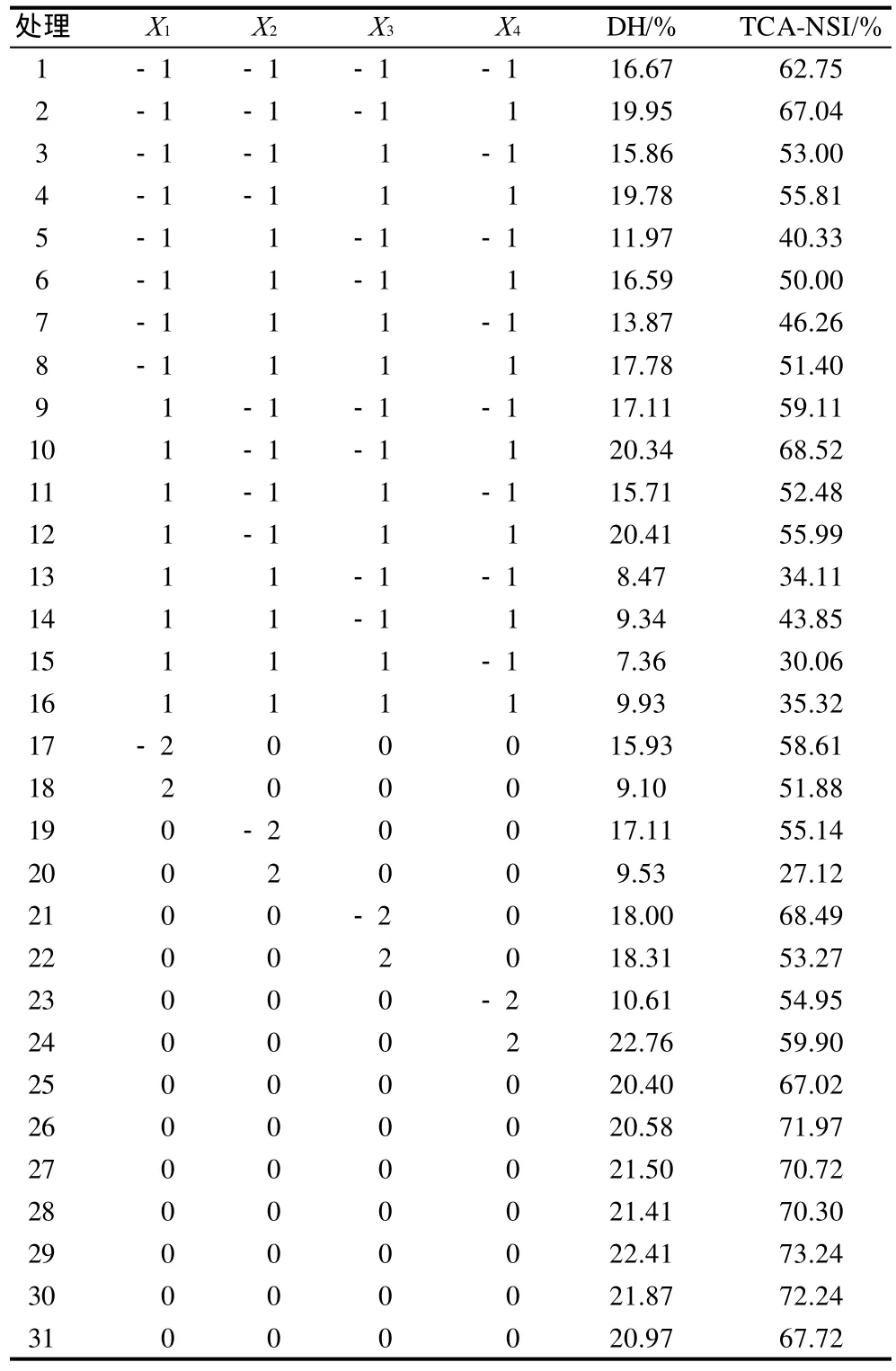
表2 回归设计试验结果处理表Table 2 Central composite design arrangement and experimental results
由表3方差分析可知,回归方程的失拟性检验F1=3.959241<F0.05(10,6)=4.06不显著,可以认为所选用的二次回归模型是合适的。回归方程的显著性检验F2=29.44>F0.01(14,16)=3.45极显著,说明回归模型的预测值与实际值非常吻合,模型成立。对回归系数显著性检验,在α=0.10显著水平剔除不显著项,得到优化后的方程为:


表3 回归方程各项的方差分析表Table 3 Variance analysis for each term of the established regression equation with DH as a function
由均方分析可见,影响DH的4因素的主次顺序是p H值、酶底比、温度、底物质量分数。
温度和pH值的交互作用对DH影响的响应面分析见图6。

图6 温度和pH值交互作用对DH影响的响应面和等高线分析Fig.6 Response surface and contour plots showing the interactive effects of temperature and pH on DH
由图6可知,开始时随着温度(X1)和pH值(X2)的升高,DH(Y1)逐渐增加;但当温度和pH值升高到一定程度时,DH开始下降。即温度和pH值过高或过低时,DH均不能达到最大值。
2.2.2 TCA-NSI回归方程的建立与检验

表4 回归方程各项的方差分析表Table 4 Variance analysis for each term of the established regression equation with TCA-NSI as a function
由表4方差分析可知,回归方程的失拟性检F1=2.661336<F0.05(10,6)=4.06不显著,可以认为所选用的二次回归模型是合适的。回归方程的显著性检验F2=31.176>F0.01(14,16)=3.45极显著,说明回归模型的预测值与实际值非常吻合,模型成立。对回归系数显著性检验,在α=0.10显著水平剔除不显著项,得到优化后的方程为:

由均方分析可见,影响TCA-NSI的4因素的主次顺序是p H值、酶底比、温度、底物质量分数。
温度和pH值的交互作用对TCA-NSI的响应面分析见图7。
由图7可知,随着温度(X1)的升高,TCA-NSI(Y2)逐渐增加;在碱性条件下,酶解温度的升高,也会加剧花生蛋白的变性,使TCA-NSI向着增大的趋势发展。随着pH值(X2)的增大,TCA-NSI先增大后减小。
pH值和底物质量分数的交互作用对TCA-NSI的响应面分析见图8。
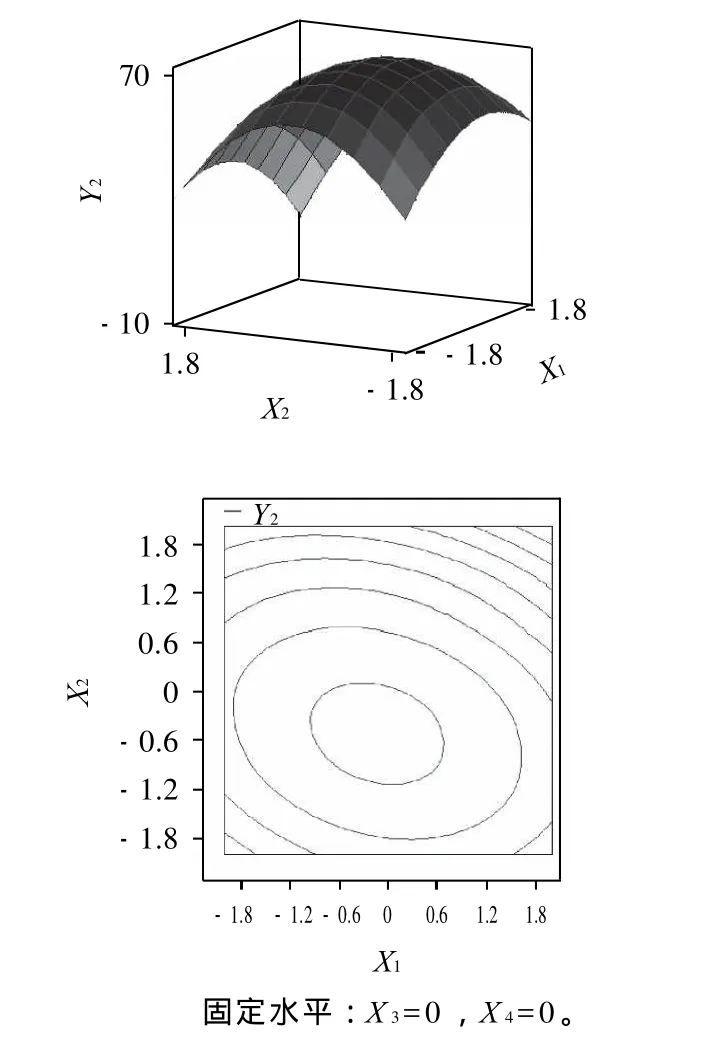
图7 温度和pH值交互作用对TCA-NSI影响的响应面和等高线分析Fig.7 Response surface and contour plots showing the interactive effects of temperature and pH on TCA-NSI
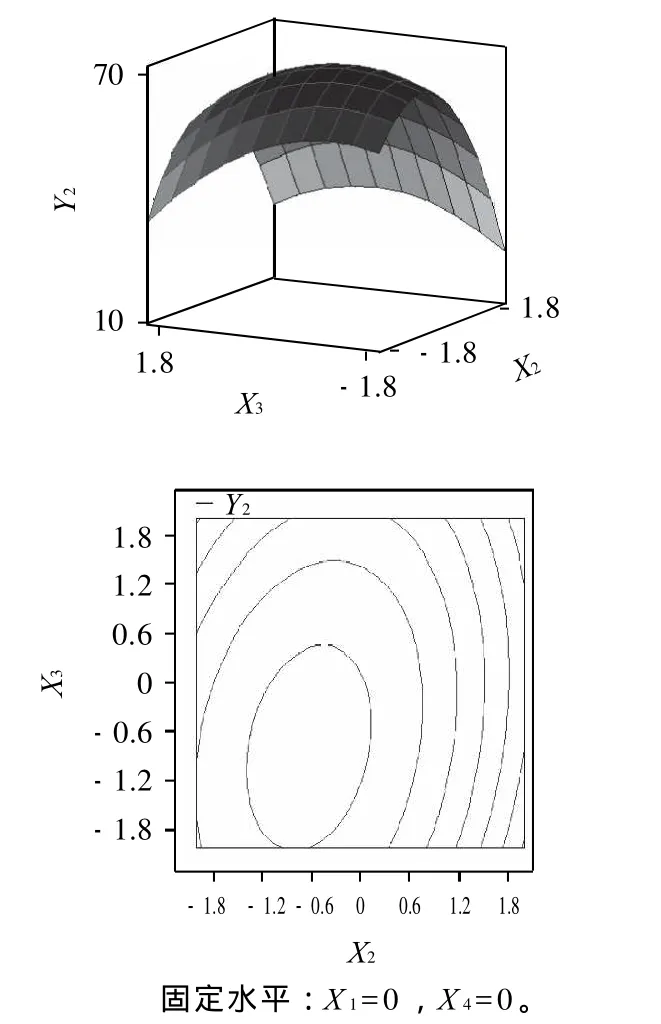
图8 pH值和底物质量分数对CA-NSI影响的响应面和等高线分析Fig.8 Response surface and contour plots showing the interactive effects of pH and substrate concentration on TCA-NSI
由图8可知,随着pH值(X2)的增加,TCA-NSI(Y2)先增加后减小;随着底物质量分数(X3)的增加,TCANSI(Y2)先增加后减小,pH值和底物质量分数之间存在交互作用。
2.3 酶解工艺参数的优化组合及结果验证
通过SAS 8.1响应面分析模拟得出DH最高得率23.40%的优化组合X1=-0.17199、X2=-0.65463、X3=0.04476、X4=0.99302,即温度为54.14℃、pH8.3、底物质量分数为6.09%、酶底比为3.99%;通过SAS 8.1响应面分析模拟得出TCA-NSI最高为74.88%的优化组合为X1=0.02822、X2=-0.63356、X3=-0.84484、X4=0.39098,即温度为55.14℃、pH8.4、底物质量分数为4.31%、酶底比为3.39%;考虑底物质量分数对DH影响不显著,对TCA-NSI影响极显著,综合各因素的影响大小,确定酶解最佳工艺参数为温度55℃、pH8.4、底物质量分数为4.31%、酶底3.39%、时间4h。根据最优化组合的预测值进行验证,结果DH=(23.40±0.5)%、TCA-NSI=(74.88±0.5)%(n=3)。预测值与实际值基本一致,说明预测条件与实际情况较符合。而通过正交试验设计所得优化参数:pH8.0,反应温度为60℃、底物质量分数4%、酶底比4%、水解时间240min。在此条件下DH和TCA-NSI分别为22.39%和58.15%。这与中心组合设计所得结果相差甚远,由此可得中心组合对因素和水平的组合具有广泛应用。
3 结 论
本实验利用碱性蛋白酶酶解花生蛋白制备多肽,通过完整的单因素试验和响应曲面分析得到以下结论:
3.1 以水解度(DH)为响应值,其回归模型为:
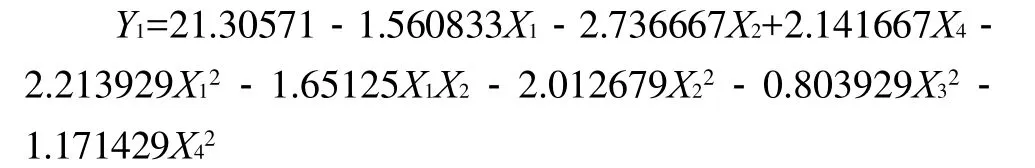
3.2 以TCA-NSI为响应值,其回归模型为:
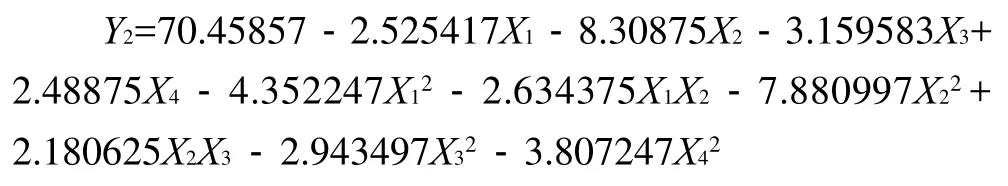
3.3 通过二次回归正交旋转组合设计确定制备花生功能性多肽的最佳酶解条件为温度55℃、pH8.4、底物质量分数4.31%、酶底比3.39%、时间4h。该条件下水解度(DH)及三氯乙酸可溶性氮溶解指数(TCA-NSI)分别为23.40%和74.88%。
[1] 段淑芬. 花生蛋白资源的开发与利用[J]. 花生科技, 1985(3):43-45.
[2] 万书波, 封海胜, 王秀贞. 花生营养成分综合评价与产业化发展战略研究[J]. 花生学报, 2004, 33(2):1-6.
[3] 周雪松, 赵谋明. 我国花生食品产业现状与发展趋势[J]. 食品与发酵工业, 2004, 30(6):84-89.
[4] 王树华, 王树祥, 王均. 抓紧发展生物活性肽[J]. 化工管理, 2004(5):25-27.
[5] 吴建平. 日本生理活性肽的市场动态[J]. 食品工业, 1998(3):8-9.
[6] 吴建平. 生物活性肽的研究进展[J]. 食品与机械, 1998(1):6-8.
[7] BYUN H G, KIM S K. Purification and characterization of angiotensinⅠconverting enzyme (ACE) inhibitory peptides from Alaska pollack(Theragra chalcogramma) skin[J]. Process Biochemistry, 2001, 36:1155-1162.
[8] 周雪松. 花生蛋白改性研究[J]. 食品加工, 2005(3):42-45.
[9] 周瑞宝. 花生加工技术[M]. 北京:化学工业出版社, 2003.
[10] 曹凯光. 花生资源的综合开发利用[J]. 江西食品工业, 2002(1):15-17.
[11] 傅铁信. 中国花生行业分析[J]. 粮油加工与食品机械, 2004(12):10-11; 15.
[12] 林坤耀. 我国花生蛋白的研究概况[J]. 广东农业科学, 2004(增刊1):15-16.
[13] ADLER-NISSEN J. Enzymic hydrolysis of food proteins[M]. London:Elsevier Applied Science Publishers, 1986.
[14] 袁斌, 吕桂善, 刘小玲. 蛋白质水解度的简易测定方法[J]. 广西农业生物科学, 2002(3):113-115.
[15] CHAVAN V D, MCKENZIE D B, SHAHIDI F. Functional properties of protein isolates from beach pea (Lathyrus maritimusL.)[J]. Food Chem,2001, 74:177-187.
[16] 慕运动. 响应面方法及其在食品工业中的应用[J]. 郑州工程学院学报, 200l, 22(3):91-94.
[17] 孟凡莉. 花生肽的酶法制备、分离纯化及其抗氧化活性研究[D]. 合肥:合肥工业大学, 2010.
Optimization of Enzymatic Hydrolysis Conditions for Preparing Functional Polypeptide from Peanut Protein
FAN Yuan-jing1,MENG Fan-li1,YI Miao-miao1,GAO Hai-cheng1,CHEN Wei2,ZHANG Hua-chuan2,CHEN Su-xia2
(1. School of Biotechnology and Food Engineeing, Hefei University of Technology, Hefei 230009, China;2. Anhui Kaili Cereals, Oils and Foodstuffs Co. Ltd., Hefei 231600, China)
TQ464.7
A
1002-6630(2010)18-0031-06
2009-11-25
安徽省2008科技攻关计划重大科技专项(08010302091);合肥市科技项目(2008-1025)
范远景(1958—),男,教授,博士,研究方向为食品科学。E-mail:swf89105@mail.hf.ah.cn
