不同沉淀方法分离甘薯β-淀粉酶的研究
2010-10-19贾彦杰梁新红朱文学孙俊良郭祖锋
贾彦杰,梁新红,朱文学,孙俊良,*,郭祖锋
(1.河南科技大学食品与生物工程学院,河南 洛阳 471003;2.河南科技学院食品学院,河南 新乡 453003)
不同沉淀方法分离甘薯β-淀粉酶的研究
贾彦杰1,梁新红2,朱文学1,孙俊良2,*,郭祖锋2
(1.河南科技大学食品与生物工程学院,河南 洛阳 471003;2.河南科技学院食品学院,河南 新乡 453003)
研究盐析法、有机溶剂沉淀法分离甘薯β-淀粉酶的工艺条件,分析盐析饱和度、有机溶剂体积比和溶液pH值对回收率及提纯倍数的影响。结果表明:硫酸铵饱和度在70%时,酶活性回收率达到78.1%,提纯1.56倍;乙醇体积比4:1时,酶活性回收率达到76.8%,提纯2.61倍;当溶液pH4.5~5.0、丙酮体积比3:1时,酶活性回收率可达到90.66%,提纯了3.29倍,此条件下β-淀粉酶分离效果最佳。
甘薯;β-淀粉酶;沉淀;分离;盐析
Abstract:Salting out and organic solvent precipitation methods were solely used to precipitateβ-amylase from the supernatant of sweet potato homogenate. The effects of saturation degree for salting out, volume ratio for organic solvents and pH on the recovery rate and purity ofβ-amylase were investigated. Results indicated that the specific activity ofβ-amylase reached up to 78.1% and its purity exhibited a 1.56-fold enhancement when the saturation degree of ammonium sulfate was 70%; the specific activity ofβ-amylase reached up to 76.8% and its purity exhibited a 2.61-fold enhancement when 4-fold volume of ethanol was added to the supernatant of sweet potato homogenate; and the highest separation efficiency was achieved and the specific activity ofβ-amylase reached up to 90.66% with a 3.29-fold enhancement in purity when pH varied from 4.5 to 5.0 and 3-fold volume of acetone was used instead of 4-fold volume of ethanol.
Key words:sweet potato;β-amylase;precipitation;separation;salting out
β-淀粉酶是一种水解酶,作用于淀粉时,分解淀粉分子中的α-1,4葡萄糖苷键,从还原性末端开始,按照麦芽糖单位依次水解,同时发生沃尔登转化,使产物由α型变为β型麦芽糖,因此称为β-淀粉酶[1-2]。β-淀粉酶在食品加工、酿造、粮食加工以及医药等行业具有重要应用价值[3]。β-淀粉酶存在于植物与微生物中,而我国目前利用微生物发酵生产的β-淀粉酶主要有耐热性差,成本较高等缺点。而从植物中提取的β-淀粉酶具有酶活力高、耐热性较好、作用pH值范围广等特点。植物β-淀粉酶主要存在于甘薯、麦麸、大豆、大麦芽以及萝卜中。我国甘薯、麦麸产量很高,价格低廉,可以从中提取β-淀粉酶[4]。甘薯β-淀粉酶酶活力高、淀粉易回收,因此甘薯是制备β-淀粉酶最为理想的原料[5]。
盐析沉淀法是许多酶初纯阶段经常采用的方法,而有机溶剂沉淀无需专门方法去除沉淀剂,此法简便、安全[6]。目前,关于乙醇沉淀分离β-淀粉酶的研究已有报道[7],而有关盐析及其他有机溶剂沉淀分离β-淀粉酶相比较的工艺研究尚未见报道。本实验通过硫酸铵盐析、乙醇及丙酮沉淀方法分离甘薯β-淀粉酶,以期找到较为合适的分离方法,为工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
甘薯 市售;考马斯亮蓝G-250、牛血清白蛋白、3,5-二硝基水杨酸等(均为分析纯)。
1.2 仪器与设备
RC5C型冷冻离心机 美国Sovall公司;pHSJ-3F型实验室pH计、FA1204B型分析天平 上海精密科学仪器有限公司;7200型分光光度计 尤尼克(上海)仪器有限公司;SQ2002多功能食品加工机 上海帅佳电子科技有限公司;MD34透析袋(8000~14000kD) 美国联合碳化物公司。
1.3 方法
1.3.1 粗酶液提取
取新鲜甘薯50g,洗净后切成1cm3左右小块,加入100mL的去离子水,于匀浆机中匀浆(26000r/min,1min),4层纱布过滤,滤液冷冻离心(4℃,4000r/min,15min),取上清液4℃冰箱中保藏备用。
1.3.2 硫酸铵盐析甘薯β-淀粉酶方法
取7支试管,每支加入粗酶液5mL,分别加入硫酸铵至饱和度为20%、40%、60%、70%、80%、90%、100%,边加边搅拌,混匀后,用磷酸-柠檬酸缓冲液调节溶液pH值至5.0,4℃冰箱中放置4h,8000r/min冷冻离心15min后,收集沉淀。将沉淀用磷酸缓冲液溶解,选用截留分子量为1万D的透析袋透析除盐24h。测透析后甘薯β-淀粉酶酶活力及蛋白含量,计算出回收率及提纯倍数。
1.3.3 乙醇、丙酮分级沉淀甘薯β-淀粉酶方法
取一定量粗酶提取液,缓慢加入预冷乙醇或丙酮分别至不同体积比(乙醇:粗酶液,V/V,下同),用磷酸-柠檬酸缓冲液调节溶液pH值至5.0,4℃冰箱中放置4h,8000r/min冷冻离心15min后,收集沉淀,将沉淀用磷酸缓冲液溶解。测沉淀分离后甘薯β-淀粉酶酶活力及蛋白含量,计算出回收率及提纯倍数。
1.3.4 甘薯β-淀粉酶酶活回收率计算
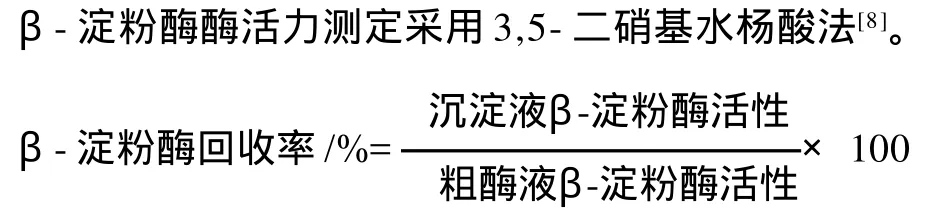
1.3.5 甘薯β-淀粉酶提纯倍数计算
蛋白质测定采用考马斯亮蓝G-250法[9]。

2 结果与分析
2.1 不同饱和度硫酸铵对甘薯β-淀粉酶分离效果影响
植物β-淀粉酶提取过程中有许多成分的物质溶出,除杂与提纯是确定酶活性稳定的要素[10]。选用不同饱和度硫酸铵盐析甘薯粗提取液,根据1.3.2节所述方法,考察不同饱和度硫酸铵对甘薯β-淀粉酶回收率及提纯倍数影响,结果见图1、2。
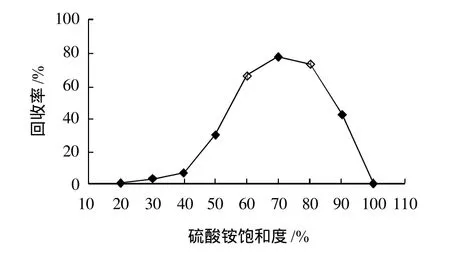
图1 不同饱和度硫酸铵对β-淀粉酶回收率的影响Fig. 1 Effect of (NH4)2SO4with various saturation degrees on the recovery rate ofβ-amylase from the supernatant of sweet potato homogenate
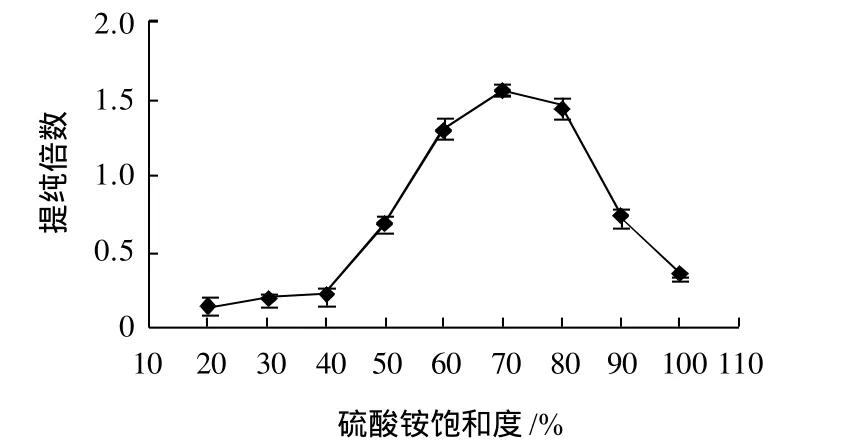
图2 不同饱和度硫酸铵对β-淀粉酶提纯倍数影响Fig.2 Effect of (NH4)2SO4with various saturation degrees on the purification fold ofβ-amylase from the supernatant of sweet potato homogenate
图1表明,不同饱和度硫酸铵对β-淀粉酶回收率影响较大。硫酸铵饱和度在20%~40%范围内,回收率变化不大。随着硫酸铵饱和度增加,酶活回收率呈增大趋势,在70%时β-淀粉酶活性回收率最高达到(78.05±0.8)%,饱和度在大于80%时,酶活回收率迅速降低。分析图2可知,硫酸铵饱和度在70%时,提纯倍数达到最大,提纯(1.56±0.031)倍。经显著性方差分析,硫酸铵饱和度在60%~80%范围内,P<0.05水平上回收率及提纯倍数都有显著性差异,因此,硫酸铵盐析β-淀粉酶最佳饱和度为70%。
2.2 有机溶剂沉淀β-淀粉酶实验
2.2.1 乙醇不同添加量对甘薯β-淀粉酶回收率及提纯倍数的影响

图3 不同体积比乙醇对甘薯β-淀粉酶回收率的影响Fig.3 Effect of ethanol amount on the recovery rate ofβ-amylase from the supernatant of sweet potato homogenate
由图3可知,在乙醇体积比为0.2:1~4:1条件下,酶活性回收率随着乙醇体积比的增加而增大,在4:1处达到最大为(76.80±0.03)%。这与文献报道的乙醇体积比不同,可能是因为甘薯不同品种所致[11]。经显著性方差分析,乙醇体积比在3:1~4:1范围内,在P<0.05水平上没有显著性差异。图4结果表明,在体积比0.2:1~5:1范围内,提纯了(0.21±0.014)~(2.62±0.16)倍,在体积比4:1时,提纯倍数达到最大,达到2.62倍。经显著性方差分析,在体积比3:1~5:1范围内,在P<0.05水平上有显著性差异。因此,乙醇沉淀β-淀粉酶最佳体积比为4:1。
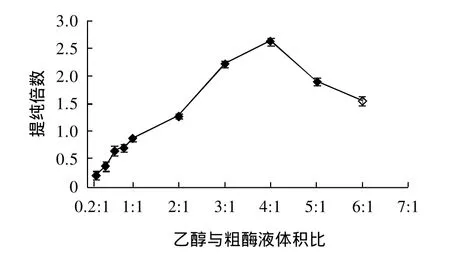
图4 不同体积比乙醇对甘薯β-淀粉酶提纯倍数的影响Fig.4 Effect of ethanol amount on the purification fold ofβ-amylase from the supernatant of sweet potato homogenate
2.2.2 不同丙酮添加量对甘薯β-淀粉酶回收率及提纯倍数的影响

图5 不同体积比丙酮对甘薯β-淀粉酶回收率的影响Fig.5 Effect of acetone amount on the recovery rate ofβ-amylase from the supernatant of sweet potato homogenate

图6 不同体积比丙酮对甘薯β-淀粉酶提纯倍数的影响Fig.6 Effect of acetone amount on the purification fold ofβ-amylase from the supernatant of sweet potato homogenate
由图5可知,不同的丙酮与粗酶液体积比对β-淀粉酶回收率影响较大。体积比为0.2:1~3:1范围时,酶活回收率逐渐升高,在3:1处达到最大,回收率为(88.05±0.05)%,然后随着丙酮用量的增加,回收率逐渐降低。图6分析可知,丙酮与粗酶液体积比为3:1时,提纯倍数最高,提纯(2.64±0.09)倍。经显著性方差分析,在丙酮体积比2:1~4:1范围内,P<0.05水平上回收率及提纯倍数都有显著性差异。因此,丙酮沉淀β-淀粉酶最佳体积比为3:1。
由以上硫酸铵、乙醇、丙酮沉淀甘薯β-淀粉酶对比实验可知,丙酮沉淀效果最佳,在丙酮与粗酶液体积比3:1时,回收率及提纯倍数达到最高,分别为(88.05±0.05)%、2.64±0.09。
2.2.3 丙酮沉淀β-淀粉酶最佳pH值的确定
由于酶蛋白在其等电点处静电荷为零,溶解度最低,容易沉淀析出,故在确定丙酮沉淀甘薯β-淀粉酶体积比3:1为最佳分离条件后,按上述工艺加入丙酮,用磷酸缓冲液分别调节溶液pH值至4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,测定甘薯β-淀粉酶酶活及蛋白含量。计算酶活回收率及提纯倍数,结果如图7、8所示。
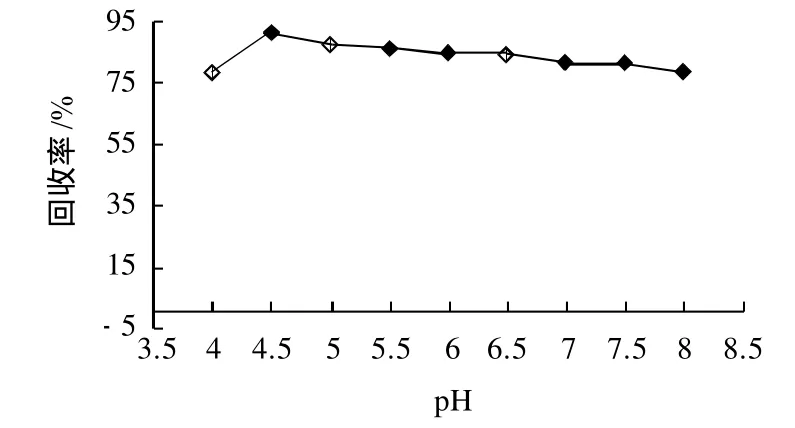
图7 不同pH值对甘薯β-淀粉酶回收率的影响Fig.7 Effect of pH of acetone solution on the recovery rate ofβamylase from the supernatant of sweet potato homogenate
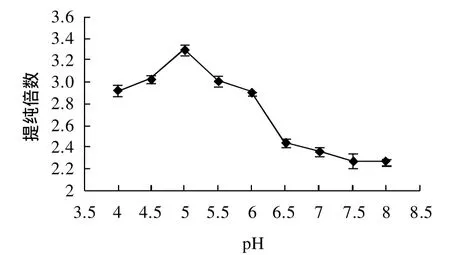
图8 不同pH值对甘薯β-淀粉酶提纯倍数的影响Fig.8 Effect of pH of acetone solution on the purification fold ofβamylase from the supernatant of sweet potato homogenate
由图7分析可知,沉淀β-淀粉酶时pH值对酶回收率影响较明显。在pH4.0~4.5范围内,酶活性回收率迅速增大,在pH4.5时达到最大值(90.66±0.02)%,随着pH值继续增大,回收率又逐渐降低。图8表明,pH值对β-淀粉酶提纯倍数影响较大,变化范围为(2.27±0.12)~(3.29±0.17),在pH5.0处达到最大,提纯(3.29±0.17)倍。经显著性方差分析,在pH4.5~5.5范围内,P<0.05水平上酶活回收率没有显著性差异,在pH4.0~6.0范围内提纯倍数有显著性差异。综合分析,pH5.0为丙酮沉淀β-淀粉酶最佳pH值。
3 结论与讨论
3.1 通过对硫酸铵盐析和有机溶剂沉淀甘薯β-淀粉酶进行比较实验,得出利用丙酮沉淀分离β-淀粉酶为最佳的分离条件,当丙酮体积比3:1、pH4.5~5.0时回收率最高可达90.66%,提纯3.29倍,这与李莹等[7]的乙醇沉淀甘薯β-淀粉酶结果相比较,提纯倍数有较大的提高,由此可知,用丙酮沉淀甘薯β-淀粉酶更为合理。
3.2 随着pH值的变化,酶活性回收率及提纯倍数变化幅度较大,说明在强酸强碱条件下,酶液易失活[12-13]。在pH4.5处,酶液表现出较高活性。
3.3 通过最佳pH的实验结果可知,在pH5.0处提纯倍数达到最高,由于在等电点处蛋白质易沉淀,可知甘薯β-淀粉酶的等电点应为5.0左右。这与朱婉华等[14]测得的大豆β-淀粉酶等电点基本一致。
3.4 本实验通过对β-淀粉酶分离方法的比较实验,得出了较为合适的分离方法,为β-淀粉酶的进一步纯化提供了重要依据。
[1] ANN Y G, LIZUKA M, YAMAMOTO T, et al. Preparation and some properties of active monomer of sweet potatoβ-amylase[J]. Agric Biol Chem, 1990, 54(3):769-774.
[2] Van DAMME E J M, HU Jialiang, BARRE A, et al. Purification,characterization, immunolocalization and structural analysis of the abundant cytoplasmicβ-amylase fromCalystegia sepium(hedge bindweed)rhizomes[J]. Eur J Biochem, 2001, 268(23):6263-6273.
[3] 靳纪培, 黄军, 刘春风, 等. 响应曲面法优化麦芽中β-淀粉酶提取工艺的研究[J]. 食品工业科技, 2008, 29(11):159-162.
[4] 孙俊良. 酶制剂生产技术[M]. 北京:科学出版社, 2004:159-160.
[5] 李新华, 鄂巍, 林琳. 紫甘薯β-淀粉酶水溶性提取技术的研究[J]. 食品工业科技, 2008, 29(2):266-268.
[6] 周艳利. 酶的分离纯化过程中的沉淀分离技术[J]. 饮料工业, 2007,10(4):1-3.
[7] 李莹, 周剑忠, 黄开红. 甘薯β-淀粉酶的纯化和特性研究[J]. 江苏农业学报, 2009, 25(1):182-184.
[8] 姜锡瑞, 段钢. 酶制剂实用技术手册[M]. 北京:中国轻工业出版社,2002:434-436.
[9] 赵英永, 戴云, 崔秀明, 等. 考马斯亮蓝G-250染色法测定草乌中可溶性蛋白质含量[J]. 云南民族大学学报, 2006, 15(3):235-237.
[10] 邱宏端, 李志达, 沈卫星, 等. 植物β-淀粉酶的提取与酶制剂的制备[J]. 福州大学学报, 1996, 24(6):104-108.
[11] 田亚平, 郭鸿飞, 肖光焰, 等. 一种麦芽β-淀粉酶的纯化和特性研究[J]. 食品工业科技, 2003, 24(9):22-24.
[12] SWANSTON J S, MOLINA-CANO J L. Beta-amylase activity and thermostability in two mutants derived from the malting barley cv.Triumph[J]. Journal of Cereal Science, 2001, 33(2):155-161.
[13] SARIKAYA E, HIGASA T, ADACHI M, et al. Comparison of degradation abilities ofα-andβ-amylases on raw starch granules[J]. Process Biochemistry, 2000, 35(7):711-715.
[14] 朱婉华, 郑伟娟, 武力, 等. 大豆β-淀粉酶的纯化和性质研究[J]. 南京大学学报, 1994, 30(1):174-178.
Separation ofβ-amylase from Sweet Potato by Different Precipitation Methods
JIA Yan-jie1,LIANG Xin-hong2,ZHU Wen-xue1,SUN Jun-liang2,*,GUO Zu-feng2
(1. College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471003, China;2. College of Food, Henan Institute of Science and Technology, Xinxiang 453003, China)
Q814.1
A
1002-6630(2010)18-0022-04
2010-05-20
河南省科技计划项目(102102210192);河南科技学院博士基金项目(09001)
贾彦杰(1985—),男,硕士研究生,主要从事食品生物技术研究。E-mail:henankeyuan@126.com
*通信作者:孙俊良(1964—),男,教授,博士,主要从事食品发酵微生物与酶制剂研究。E-mail:sjl@hist.edu.cn
