纳米银杀菌机理的研究进展
2010-10-19许恒毅熊勇华赖卫华
曲 锋,许恒毅,熊勇华,赖卫华,魏 华*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
纳米银杀菌机理的研究进展
曲 锋,许恒毅,熊勇华,赖卫华,魏 华*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
纳米银因其高效、广谱及不易产生耐药性等优点,已成为目前抗菌材料的研究热点,但其杀菌机理尚有待于进一步研究。本文综述了纳米银杀菌机理的最新进展,以期为纳米银抗菌材料的应用提供参考依据。
纳米银;杀菌机理;抗菌材料
Abstract:Nano-silver has become a hot topic in the field of antibacterial materials due to its high efficiency, wide spectrum and low drug-resistance to bacteria. However, the bactericidal mechanisms of nano-silver are still unclear. In this paper, current research progress in bactericidal mechanisms of nano-silver has been discussed, which will provide technical supports for further development and applications of nano-silver as an antimicrobial material.
Key words:nano-silver;bactericidal mechanism;antibacterial materials
银的抗菌性能早在16世纪就被广泛地应用于医药界,如用银片覆盖伤口预防溃烂,用银丝织成纱布包裹皮肤创伤,婴儿出生时滴上硝酸银溶液可防止黏膜感染[1]。20世纪30年代,抗生素的发现一度使人们忽视了对银抗菌性能的利用。然而,随着抗生素等化学药物的滥用,越来越多的微生物通过变异产生了耐药性,使得一些由耐药性细菌引起的疾病无法医治。同时也使具备高效、广谱及不易产生耐药性等优点的银系杀菌剂再次引起人们的重视。随着纳米技术的迅猛发展,将金属银加工成纳米银后,原子排列表现为介于固体和分子之间的“介态”,其比表面积极大,显示明显的表面效应、小尺寸效应和宏观隧道效应,这种活性极强的纳米银微粒具备超强的抗菌能力[2]。如纳米银抗菌的有效浓度在纳摩尔水平,低于银离子的微摩尔水平近1000倍[3]。然而纳米银抗菌材料得以应用的同时,相关基础研究则明显滞后,纳米银的抗菌机理尚未认识清楚,这必将影响纳米银抗菌材料的进一步发展和更为广泛的应用,本文将纳米银抗菌机理的研究进展做如下综述。
1 米银的制备及其应用
按照原理不同,纳米银颗粒的制备方法可以分为物理方法、化学方法和生物还原法3大类,如表1所示。
随着科技的进步,未来的纳米银生产技术将向低成本、低消耗、低污染的方向发展。在物理、化学制备方法相对已较为成熟的情况下,具有独特的技术和成本优势的生物还原法将可能成为未来纳米银生产技术的突破口,寻找新的具有较强银还原能力的菌种并优化其还原条件将是这种新技术的主要发展方向。
目前,纳米银已应用于水净化领域。Jain等[14]将纳米银加入聚氨酯泡沫体中,含105cells/mL大肠杆菌的水以0.5L/min的流速通过该泡沫体后,全部细菌被杀死。Gong等[15]制备了Ag和Fe3O4的复合纳米颗粒,它兼备了Fe3O4的超顺磁性和Ag的强杀菌性,不仅有效杀死了细菌,而且完成处理后可利用磁场将其从水中清除,如此既避免了对环境造成污染,又可循环使用。
纳米银可通过尼纶、网布、水状胶质、甲基纤维素、聚乙烯和聚丙烯等为载体,制成医用敷料,适用于大部分的外伤治疗。纳米银通过减少创伤的发炎和调节成纤维细胞因子,加快创伤的恢复速度并减小产生的疤痕[16]。将纳米银添加到PVA纤维和棉织物,制成的抗菌织物均表现出强杀菌效果。
最近一些研究表明,纳米银与多种抗生素和传统中药均有协同杀菌的作用,明显增强了原药物的杀菌效能,在药物载体领域展现出良好的应用前景[17]。

表1 纳米银的制备方法、原理及优缺点Table 1 Preparation methods of nano-silver
2 纳米银对细菌的杀伤效果及影响因素
近年来,纳米银对细菌形态的损伤有了许多共性研究:经纳米银作用后,菌体细胞畸形且不完整;细胞外膜受到损伤,胞壁上出现小坑,胞膜上出现小孔;纳米银不仅作用于细胞外膜,而且进入了菌体细胞内部[18-24]。Shrivastava等[20]用透射电镜仔细观察了纳米银与细菌作用的过程:起初纳米银成簇地锚定在细胞壁上,这些位点可能是细胞壁上带负电的功能团;随后纳米银进入菌体,并锚定于细胞内的几个位点,在细胞膜上形成齿孔;后期观察到黑色碎片状的沉淀物,Shrivastava等[20]认为该沉淀物是细菌内容物和纳米银结合的产物,这可能是一种降低局部纳米银浓度的防御机制,使得细菌延长了延滞生长期而没有被全部杀死。谢小保等[24]也观察到相似的过程:纳米银粒子先在细胞壁上产生小的孔洞,通过这些孔洞进入周质空间,导致细胞膜成分泄漏和破坏细胞膜,进而进入细胞内部,纳米银粒子使DNA浓缩呈紧张态,并与破损细菌的细胞质结合积聚,最后引起胞内物质流失。
纳米银破坏了菌体细胞膜的性质,使膜的通透性发生改变。经纳米银作用后,大量还原糖和蛋白质从菌体内泄漏到胞外[18];Kim等[19]也有类似的发现,菌体内葡萄糖和海藻糖的含量明显增加,释放到胞外的量也明显增加;正常情况下0.1%的SDS不能进入完整的菌体细胞,Lok等[25]发现细菌经纳米银作用后,SDS则可以进入菌体并发挥溶菌作用;细胞内的钾几乎全部流失,ATP消耗殆尽而且膜电位遭到破坏。1,6 -二苯基- 1,3,5-己三烯(DPH)通过与细胞膜磷脂双分子层的酰基结合而嵌入膜内,Kim等[19]用流式细胞术发现菌体内DPH的量随纳米银浓度的增加而减少,即纳米银破坏了细胞膜的磷脂双分子层结构,并进一步影响了膜的通透性。Lok等[25]发现,大肠杆菌经纳米银处理后,菌体中5种包膜蛋白表达异常,并证明它们是以各自成熟蛋白前体的形式存在。作者认为,菌体膜电位的破坏和细胞内ATP的大量消耗造成这些包膜蛋白前体无法穿过胞膜,被加工成成熟蛋白。纳米银可以降低大肠杆菌呼吸链中脱氢酶的活性,并且纳米银浓度越高酶活性越低[18]。细菌内多种蛋白质已被证实会被磷酸化,蛋白质的磷酸化与细胞内的信号转导有关。Shrivastava等[20]发现经纳米银处理后,菌体内有两种蛋白质的磷酸酪氨酸被去磷酸化,据此认为纳米银通过影响菌体细胞的信号转导,从而抑制细菌生长。有趣的是,该现象在大肠杆菌(G-)中被发现,在金黄色葡萄球菌(G+)中却没有出现。谢小保等[24]发现,纳米银使大肠杆菌DNA不再随机分布在核区,而是在核区浓缩呈紧张态,且能够增加大肠杆菌总DNA样品的降解程度。
纳米银的杀菌效果受多方面的因素影响。纳米银颗粒自身的粒径、形状、浓度和表面修饰物等均能影响纳米银和菌体的接触及侵入,造成的杀伤作用强弱也不同。不同类型的细菌在细胞壁结构上存在很大的差异:革兰氏阴性菌的细胞壁最外层是一层脂多糖,往内是一层薄的肽聚糖(7~8nm),脂多糖是由脂类和多糖共价连接的,整体缺乏强度和硬度;革兰氏阳性菌的细胞壁主要由肽聚糖构成,线性的肽聚糖由小肽连接成相互交联的网状立体结构,比阴性菌的厚(20~80nm)且更致密,纳米银不但难以锚定在其上面,而且难以穿过细胞壁。诸多研究表明,纳米银对革兰氏阴性菌的抑制或杀伤作用明显强于革兰氏阳性菌[20,26-27]。培养条件同样可以影响纳米银的杀菌效果,培养基状态、供氧和培养温度都是重要的影响因素[22-23]。在液体培养基中的细菌被纳米银杀死后,细胞内容物与纳米银结合形成沉淀,降低了液体中局部的纳米银浓度,使得细菌在液体培养基中对纳米银的耐受能力明显强于在固体培养基。氧气供给和培养温度能够影响活性氧的产生和Ag+的释放(表 2)。

表2 纳米银杀菌的影响因素Table 2 Affecting Factors of the bactericidal effect of nano-silver
3 纳米银的杀菌机理
3.1 损伤细菌DNA
DNA分子在松弛状态下才能有效地进行复制,呈紧张状态的DNA分子会失去复制的能力。DNA的任何损伤都会影响遗传物质正常的复制及生物体的繁殖,纳米银通过损伤细菌DNA达到杀菌效果。如纳米银使大肠杆菌DNA不再随机分布在细胞的核区,而是在核区浓缩呈紧张态,并增加菌体内总DNA的降解程度[24],如图1a所示。
3.2 中断细胞信号转导
细菌内多种蛋白质会被磷酸化,蛋白质的磷酸化与细胞内的信号转导有关。Shrivastava等[20]发现,纳米银处理过的细菌中有两种蛋白质的磷酸酪氨酸被去磷酸化,即纳米银影响了细胞正常的信号转导,如图1b所示。细胞裂解可能不是纳米银杀死细菌的唯一原因,纳米银有可能通过影响细胞的信号转导而使细菌不能正常地存活。
3.3 活性氧自由基的氧化损伤
菌体表面微量的银能起到催化活性中心的作用。Ag+激活空气或水中的氧,产生羟自由基及活性氧离子,抑制或杀灭细菌[32],如图1c所示。Danilczuk等[33]在电子自旋共振光谱中发现了纳米银产生的自由基,Kim等[26]观察到相同的结果并发现在培养基中加入抗氧化剂N-乙酰半胱氨酸可以抵消纳米银的杀菌作用,即纳米银产生的自由基与它的抗菌性有关。Pal等[22]发现纳米银与细菌共培养初期的杀菌作用与其产生的活性氧有关,并证明杀菌的有效成分是羟自由基。由此推断,纳米银可能通过产生自由基,进一步氧化菌体外膜使细菌死亡。
3.4 菌体内容物泄漏
电镜观察显示,被纳米银作用后的菌体细胞膜遭到严重破坏,细胞壁上形成小坑,细胞膜上出现小孔,如图1d所示。细胞膜的通透性也被破坏,大量的还原糖、蛋白质以及K+从菌体内泄漏,膜电位和ATP被消耗殆尽。一些学者认为经纳米银处理后,菌体细胞膜的通透性被改变,大量新陈代谢所必需的物质泄漏,导致了细菌的死亡[18-19,23]。
3.5 脱氢酶失活
纳米银粒径极微小,可以进入细菌并与菌体中酶蛋白的巯基结合,使一些含巯基基团的酶失去活性,如图1e所示。经纳米银处理后,大肠杆菌呼吸链中脱氢酶的活性明显降低,并且纳米银的浓度越高酶活性越低[18]。另据Matsumura等[34]报道,抑制呼吸酶活性可能与活性氧的产生有关。脱氢酶失活后,细菌既不能获取正常生命活动所需的能量,又受到活性氧的氧化杀灭作用。
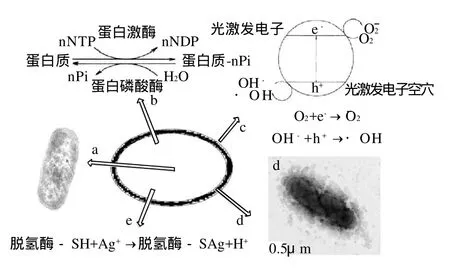
图1 纳米银杀菌机制示意图Fig.1 Bactericidal mechanisms of nano-silver
4 待解决的问题
诸多研究已经证实:纳米银先黏附在细菌外膜上,再穿过外膜对细菌造成损伤[18-24]。但是,纳米银与细菌外膜结合的机理仍不清楚。一般认为带正电荷的纳米银通过静电吸附作用黏附到带负电荷的细菌外膜[24-35],而Sondi等[23]观察到带负电荷的纳米银也具有强杀菌性能。由此可知静电吸附不是纳米银黏附在细菌外膜上的主要原因,探究纳米银与细菌外膜的何种成分发生了作用,对进一步探讨纳米银的杀菌机理有重要的意义。此外,目前尚未见报道纳米银在细菌内部是以何种形式存在并对细菌造成杀伤的。细菌的大部分生化反应在纳米级尺度发生,因此纳米银颗粒不仅可以游离出Ag+杀伤细菌,而且有机会直接介入细菌的新陈代谢。探讨纳米银在细菌内部的存在形式也是阐明其杀菌机理的前提条件。
5 结 论
综上所述,纳米银通过如下机制杀菌:损伤细菌DNA、活性氧自由基的氧化损伤、脱氢酶失活、菌体内容物泄漏和中断细胞信号转导。纳米银的杀菌效果受自身性质、细菌性质和培养条件等多方面因素的影响。目前,对纳米银杀菌机理的研究主要集中在用电镜观察菌体损伤以及测定纳米银杀菌效能等方面,今后的发展方向必定为从分子水平和代谢水平对其做出分析,从而为深入阐明这一机理奠定基础。虽然纳米银的杀菌机理至今仍未彻底阐明,但随着分析方法的不断进步,该杀菌机理将逐渐清晰。纳米银杀菌机理的阐明,有利于人们更好地将纳米银应用到食品、医药、环境保护等多个领域,造福于人类。
[1] 袁鹏, 何宏平. 银系无机抗菌剂的研究进展[J]. 化工矿物与加工,2002, 31(10):5-9.
[2] 刘伟, 张子德, 王琦, 等. 纳米银对常见食品污染菌的抑制作用研究[J]. 食品研究与开发, 2006, 27(5):135-137.
[3] DIBROV P, DZIOBA J, GOSINK K K, et al. Chemiosmotic mechanism of antimicrobial activity of Ag+inVibrio cholerae[J]. Antimicrobial Agents and Chemotherapy, 2002, 46(8):2668-2670.
[4] XU J, YIN J S, MA E. Nanocrystalline Ag formed by low-temperature high-energy mechanical attrition[J]. Nanostructured Materials, 1997, 8(1):91-100.
[5] AHMED M, LEONG W K. Colloidal silver nanoparticles stabilized by a water-soluble triosmium cluster[J]. Journal of Organometallic Chemistry,2006, 691(5):1055-1060.
[6] FITZ-GERALD J, PENNYCOOK S, GAO H, et al. Synthesis and properties of nanofunctionalized particulate materials[J]. Nanostructured Materials, 1999, 12(5/8):1167-1171.
[7] HUSSAIN I, BRUST M, PAPWORTH A J, et al. Preparation of acrylate-stabilized gold and silver hydrosols and gold-polymer composite films[J]. Langmuir, 2003, 19(11):4831-4835.
[8] 姚素薇, 刘恒权, 张卫国, 等. 在线性壳聚糖膜内原位还原制备银纳米粒子及银单晶体[J]. 物理化学学报, 2003, 19(5):464-468.
[9] 廖学红, 红李鑫. 电化学制备纳米银[J]. 黄冈师范学院学报, 2001,21(5):58-59.
[10] 廖学红, 朱俊杰, 赵小宁, 等. 纳米银的电化学合成[J]. 高等学校化学学报, 2000, 21(12):1837-1839.
[11] KLAUS T, JOERGER R, OLSSON E, et al. Silver-based crystalline nanoparticles, microbially fabricated[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(24):13611-13614.
[12] 林种玉, 刘月英. 贵金属离子非酶法生物还原机理初探[J]. 物理化学学报, 2001, 17(5):477-480.
[13] 傅锦坤, 刘月英. 细菌吸附还原贵金属离子特性及表征[J]. 高等学校化学学报, 1999, 20(9):1452-1454.
[14] JAIN P, PRADEEP T. Potential of silver nanoparticle-coated polyurethane foam as an antibacterial water filter[J]. Biotechnology and Bioengineering, 2005, 90(1):59-63.
[15] GONG Ping, LI Huimin, HE Xiaoxiao, et al. Preparation and antibacterial activity of Fe3O4@Ag nanoparticles[J]. Nanotechnology, 2007, 18:285604.
[16] TIAN J, WONG K, HO C M, et al. Topical delivery of silver nanoparticles promotes wound healing[J]. Chem Med Chem, 2007, 2(1):129-137.
[17] FAYAZ A M, BALAJI K, GIRILAL M, et al. Biogenic synthesis of silver nanoparticles and their synergistic effect with antibiotics:a study against gram-positive and gram-negative bacteria[J]. Nanomedicine, 2010,6(1):103-9.
[18] LI Wenru, XIE Xiaobao, SHI Qingshan, et al. Antibacterial activity and mechanism of silver nanoparticles onEscherichia coli[J]. Applied Microbiology and Biotechnology, 2010, 85(4):1115-1122.
[19] KIM K J, SUNG W S, SUH B K, et al. Antifungal activity and mode of action of silver nano-particles onCandida albicans[J]. Biometals, 2009,22(2):235-242.
[20] SHRIVASTAVA S, BERA T, ROY A, et al. Characterization of enhanced antibacterial effects of novel silver nanoparticles[J].Nanotechnology, 2007, 18(22):225103-225112.
[21] PAL S, TAK Y K, SONG J M. Does the antibacterial activity of silver nanoparticles depend on the shape of the nanoparticle? A study of the gram-negative bacteriumEscherichia coli[J]. Applied and Environmental Microbiology, 2007, 73(6):1712-1720.
[22] PAL S, TAK Y K, JOARDAR J, et al. Nanocrystalline silver supported on activated carbon matrix from hydrosol:antibacterial mechanism under prolonged incubation conditions[J]. Journal of Nanoscience and Nanotechnology, 2009, 9(3):2092-2103.
[23] SONDI I, SALOPEK-SONDI B. Silver nanoparticles as antimicrobial agent:a case study onE. colias a model for Gram-negative bacteria[J].Journal of Colloid and Interface Science, 2004, 275(1):177-182.
[24] 谢小保, 李文茹, 曾海燕, 等. 纳米银对大肠杆菌的抗菌作用及其机制[J]. 材料工程, 2008(10):106-109.
[25] LOK C N, HO C M, CHEN Rong, et al. Proteomic analysis of the mode of antibacterial action of silver nanoparticles[J]. Journal of Proteome Research, 2006, 5(4):916-924.
[26] KIM J S, KUK E, YU K N, et al. Antimicrobial effects of silver nanoparticles[J]. Nanomedicine:Nanotechnology, Biology, and Medicine,2007, 3(1):95-101.
[27] AMIN R M, MOHAMED M B, RAMADAN M A, et al. Rapid and sensitive microplate assay for screening the effect of silver and gold nanoparticles on bacteria[J]. Nanomedicine, 2009, 4(6):637-643.
[28] PANACEK A, KVITEK L, PRUCEK R, et al. Silver colloid nanoparticles:synthesis, characterization, and their antibacterial activity[J]. Journal of Physical Chemistry B, 2006, 110(33):16248-16253.
[29] MORONES J R, ELECHIGUERRA J L, CAMACHO A, et al. The bactericidal effect of silver nanoparticles[J]. Nanotechnology, 2005, 16:2346-2353.
[30] KVITEK L, PANACEK A, SOUKUPOVA J, et al. Effect of surfactants and polymers on stability and antibacterial activity of silver nanoparticles(NPs)[J]. Journal of Physical Chemistry C, 2008, 112 (15):5825-5834.
[31] DROR-EHRE A, MAMANE H, BELENKOVA T, et al. Silver nanoparticle-E. colicolloidal interaction in water and effect onE. colisurvival[J]. Journal of Colloid and Interface Science, 2009, 339(2):521-526.
[32] INOUE Y, HOSHINO M, TAKAHASHI H, et al. Bactericidal activity of Ag-zeolite mediated by reactive oxygen species under aerated conditions[J]. Journal of Inorganic Biochemistry, 2002, 92(1):37-42.
[33] DANILCZUK M, LUND A, SADLO J, et al. Conduction electron spin resonance of small silver particles[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2006, 63(1):189-191.
[34] MATSUMURA Y, YOSHIKATA K, KUNISAKI S, et al. Mode of bactericidal action of silver zeolite and its comparison with that of silver nitrate[J]. Applied and Environmental Microbiology, 2003, 69(7):4278-4281.
[35] STOIMENOV P, KLINGER R, MARCHIN G, et al. Metal oxide nanoparticles as bactericidal agents[J]. Langmuir, 2002, 18(17):6679-6686.
Research Progress in Bactericidal Mechanisms of Nano-silver
QU Feng,XU Heng-yi,XIONG Yong-hua,LAI Wei-hua,WEI Hua*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
TS207.4
A
1002-6630(2010)17-0420-05
2010-05-10
江西省优秀博士学位论文培育计划基金项目(YBP08A03)
曲锋(1986—),男,硕士研究生,研究方向为纳米材料毒性。E-mail:qufeng7@yahoo.com.cn
*通信作者:魏华(1966—),男,研究员,博士,研究方向为食品生物技术。E-mail:hua_wei114@yahoo.com.cn
