几种有机化合物对三价铁生物有效性及毒性的影响
2010-10-19何万领李晓丽
何万领,李晓丽
(河南科技大学动物科技学院,河南 洛阳 471003)
几种有机化合物对三价铁生物有效性及毒性的影响
何万领,李晓丽
(河南科技大学动物科技学院,河南 洛阳 471003)
研究几种有机化合物对铁生物有效性和毒性的影响。用葡萄糖、乳糖、抗坏血酸或草酸与1.5mmol/L三价铁的混合溶液分别孵育Caco-2细胞24h后,用细胞吸收铁量作为铁有效性指标,通过3-(4,5)-二甲基-2-(2,5)-二苯基溴化四氮唑蓝(MTT)比色、乳酸脱氢酶(LDH)渗漏及细胞碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性分析评价铁对细胞的毒性。结果表明,Fe3+-葡萄糖、Fe3+-乳糖和Fe3+-抗坏血酸混合物铁生物有效性较FeCl3显著(P<0.05)提高了2.57、4.08、4.52倍,Fe3+-草酸使铁生物有效性降低了18.73%。Fe3+-抗坏血酸显著增加了细胞MTT吸收(P<0.05),并显著降低了LDH渗漏(P<0.05),而Fe3+-乳糖显著促进了LDH渗漏(P<0.05)。与去离子水相比,FeCl3显著降低了细胞SOD(P<0.01)和AKP(P<0.01)活性,而添加有机化合物对两种酶活性有促进作用;比较而言,抗坏血酸对细胞SOD、GSH-Px和AKP活性均有显著的促进作用(P<0.05)。
有机化合物;三价铁;生物有效性;毒性
Abstract:In order to explore the effects of organic compounds on the bioavailability and toxicity of ferric salts, the media containing 1.5 mmol/L ferric chloride alone (as a control) or its respective mixtures with glucose, lactose, ascorbic acid and oxalic acid were used to incubate Caco-2 cells for 24 h, and after completion of the incubation, intracellular iron concentration characterizing bioavailability was measured and the cellular toxicity of ferric was assessed by MTT, lactate dehydrogenase(LDH) leakage, alkaline phosphatase (ALK) activity, superoxide dismutase (SOD) activity, glutathione peroxidase (GSH-Px)activity assays. Compared with the control medium, the cells incubated in the media containing ferric chloride/glucose, ferric chloride/lactose or ferric chloride/scorbic acid mixtures showed 2.57, 4.08 and 4.52-fold increases in iron bioavailability, respectively.However, the presence of oxalic acid in the control medium resulted in a decrease of iron bioavailability of the cells by 18.73%.Compared with the control medium, the cells incubated in the medium containing ferric chloride/ascorbic acid complex exhibited a significantly higher MTT absorbance (P<0.05) but a lower LDH leakage (P<0.05); in contrast, the medium containing ferric chloride/lactose mixture significantly improved LDH leakage (P<0.05). In addition, ferric chloride exhibited a reduction effect on the activities of SOD and ALK (P<0.01) when compared with deionized water. However, respective additions of these organic compounds could improve the activities of SOD and ALK. On the other hand, the medium containing ferric chloride/ascorbic acid mixture had a promoting effect on the activities of SOD, ALK and GSH-Px (P<0.05).
Key words:organic compound;ferric;bioavailability;toxicity
铁是人体必需的微量元素,在体内主要参与氧运输和能量代谢。然而,铁缺乏在世界范围却普遍存在[1-2]。膳食铁强化是解决人体铁缺乏的重要措施之一,但铁强化剂选择不当或铁添加量过多往往会造成铁中毒。铁强化剂的生物有效性决定其补铁效果,同时与铁毒性密切相关[3-4]。研究认为,铁生物有效性和毒性除与铁强化剂种类、铁水平及铁价态有关外,还与食物中的化学组成密切相关[4-6]。因此,研究食物中某些化学成分对铁生物有效性和毒性的影响,对解决人体铁缺乏及预防铁中毒具有重要的参考价值。本实验利用Caco-2细胞体外模型研究葡萄糖、乳糖、抗坏血酸及草酸对三价铁生物有效性和毒性的影响。
1 材料与方法
1.1 材料、试剂与仪器
Caco-2细胞购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
DMEM培养液、胰酶/EDTA液、D-Hank's液、青霉素、链霉素 美国Gibco公司;标准胎牛血清 杭州四季青生物有限公司;氯化铁(分析纯) 天津金汇太亚化学试剂有限公司;二甲基亚砜 Sigma分装;25cm2正方斜口培养瓶、96孔和24孔培养板 Corning公司;乳酸脱氢酶(LDH)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒、碱性磷酸酶(AKP)检测试剂盒、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒 南京建成生物工程研究所。
二氧化碳培养箱 德国Kendro Laboratory Products GmbH 公司;TE2000U倒置显微镜 日本Nikon 公司;680型酶标仪 美国 Bio-Rad公司;MTT 美国Sigma公司;AA-7003型原子吸收光谱仪 东莞市常平邦鑫伟业仪器制造厂。
1.2 细胞培养
Caco-2细胞被用于实验前经过20~43代的传代培养。Caco-2细胞生长在25cm2的斜口培养瓶中,培养液采用DMEM液,并含有10%胎牛血清、1g/100mL非必需氨基酸、20mmol/L的2-[4-(2-羟乙基)-1-对二氮己环]-乙磺酸(HEPES)、2mmol/L的L-谷氨酸盐、100U/mL青霉素G和100μg/mL链霉素。然后,将细胞培养瓶置于37℃,5%二氧化碳及95%相对湿度的二氧化碳培养箱中。每2~3d换一次培养液,到细胞完成贴壁融合后(或细胞长满90%以上培养瓶底壁),用胰酶/EDTA溶液将细胞从瓶壁消化掉,加新鲜培养液,充分吹打,使细胞混悬。将细胞悬液分别转入96孔和24孔培养板中,放二氧化碳培养箱中继续培养。当细胞生长达到贴壁融合后,将培养液撤出。将预先配制好的三价铁及与有机物混合的溶液分别加入各孔,继续在培养箱中培养24h后,分别测定培养液中细胞代谢产物,细胞酶活性和细胞内铁含量。
1.3 铁溶液配制
准确称取三氯化铁溶解于去离子水中,用0.22μm滤膜过滤除菌,配制成三价铁贮备液。吸取铁贮备液,用去离子水稀释至铁浓度为1.5mmol/L的实验液;同时取铁贮备液分别与葡萄糖、乳糖、抗坏血酸、草酸按照1:10和1:20的物质的量比配制成铁浓度为1.5mmol/L的Fe3+-有机物混合液;去离子水作为空白对照。
1.4 细胞铁吸收测定
准确吸取各铁溶液1.0mL加入培养孔中,每个铁处理设置6个重复,对照组为去离子水,将细胞培养板重新置37℃培养箱中继续培养24h。细胞经铁处理后,吸出培养液,用D-Hank’s液冲洗两次,每次2mL。将培养板放入超声波振荡器中破碎15min,此过程在4℃冷室内进行[7]。用2mL去离子水充分冲洗细胞入5mL塑料离心管中。取部分通过考马斯亮蓝法测定细胞蛋白质。其余细胞处理液于100℃,烘干24h,加入5mL浓硝酸,同时滴加5滴体积分数为30%的双氧水,在80℃条件下消化,消化残留物用1.4mol/L的硝酸溶液溶解,用去离子水定容至5mL。用原子吸收光谱仪测定消化液中铁含量。
1.5 细胞活力测定
采用3-(4,5)-二甲基-2-噻唑-(2,5)-二苯基溴化四氮唑蓝(MTT)吸收比色实验。Caco-2细胞经铁溶液处理后,除去培养液,用D-Hank’s液冲洗细胞两次。加0.4mg/mL MTT溶液0.2mL,置于培养箱中培养4h。小心将MTT溶液吸出,然后往各孔中加1mL二甲基亚砜(无菌态)。将培养板置37℃恒温振荡器中振荡10min后,用酶标仪于波长552nm处测定吸光度[8]。
1.6 乳酸脱氢酶(Lactate dehydrogenase,LDH)漏渗
LDH存在正常细胞的线粒体内,当细胞膜受到损坏时活细胞死亡,LDH便从细胞漏渗入培养液。细胞经铁溶液处理后,吸取培养液,利用LDH检测试剂盒,用分光光度计于波长540nm处测定吸光度[9]。
1.7 细胞酶活性测定
超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSHPx)和碱性磷酸酶(AKP)活性测定均采用试剂盒。
1.8 数据分析及处理
数据处理采用Excel 2003;采用DPS3.01统计软件进行单因素方差分析和LSD多重比较,以P<0.05为显著水平,实验结果用“平均数±标准差”表示;图表制作使用Sigmaplot10.0。
2 结果与分析
2.1 Fe3+-有机物对铁生物有效性的影响
不同有机物对三价铁生物有效性的影响见图1。与氯化铁组相比,葡萄糖、乳糖和抗坏血酸分别使铁生物有效性显著(P<0.05)提高了2.57、4.08、4.52倍,以抗坏血酸效果最好。相反,草酸的添加对三价铁生物有效性有一定抑制作用,但差异不显著。Fe3+-草酸使铁生物有效性降低了18.73%。
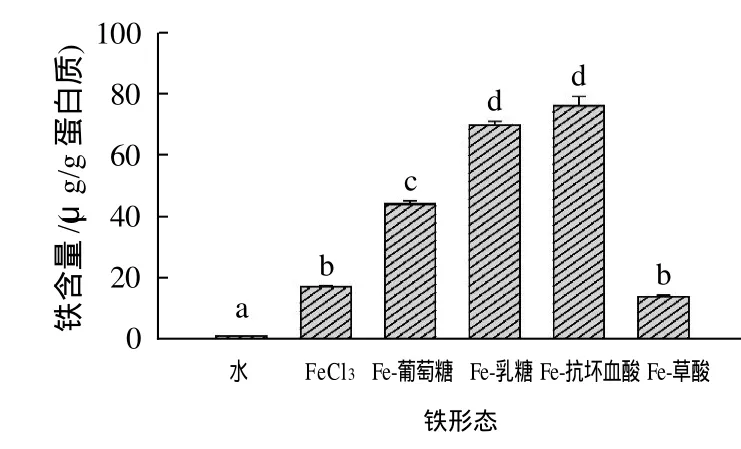
图1 Fe3+-有机物对铁生物有效性的影响(铁与结合物物质的量比为 1∶10)Fig.1 Effect of the presence of organic compounds on ironbioavailability (10∶1 ferric-to-organic compound molar ratio, hereinafter the same)
2.2 Fe3+-有机物对Caco-2细胞活性的影响

图2 Fe3+-有机物对Caco-2细胞活性的影响Fig.2 Effect of the presence of organic compounds on the viability of Caco-2 cells
图2显示为Fe3+-有机物结合对Caco-2细胞MTT吸收的影响。结果表明,Fe-抗坏血酸组Caco-2细胞MTT吸光度显著(P<0.05)高于空白对照组、FeCl3组和其他铁有机物复合组,且随着抗坏血酸含量增加,MTT吸光度显著增加(P<0.05)。Fe-葡萄糖复合对Caco-2细胞生活能力无显著影响。Fe-乳糖复合可降低细胞MTT吸收,尤其是铁与乳糖物质的量比为1:20时,细胞MTT吸收显著降低(P<0.05)。Fe-草酸显著降低了Caco-2细胞MTT吸光度(P<0.05)。
2.3 Fe3+-有机物对Caco-2细胞膜透性的影响
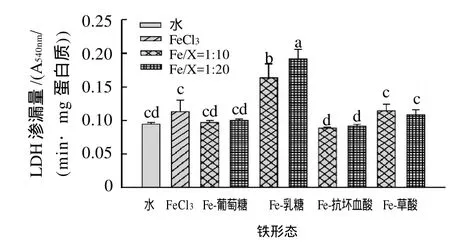
图3 Fe3+-有机物对Caco-2细胞膜透性的影响Fig.3 Effect of the presence of organic compounds on the membrane permeability of Caco-2 cells
三价铁及与有机物结合对Caco-2细胞LDH漏渗的影响见图3。与空白对照组相比,1.5mmol/L的三价铁增加了Caco-2细胞LDH的漏渗(P>0.05),尤其是三价铁与乳糖结合时,可显著提高细胞LDH的漏渗(P<0.05),且随乳糖水平增加而显著增加(P<0.05)。相反,三价铁与抗坏血酸结合可显著降低细胞LDH漏渗(P<0.05)。三价铁与葡萄糖或草酸结合对Caco-2细胞LDH漏渗无显著影响。
2.4 Fe3+-有机物对Caco-2细胞酶活性的影响
三价铁及与有机物结合对Caco-2细胞抗氧化酶(SOD和GSH-Px)和标志性酶(AKP)活性的影响见表1。结果表明,三价铁极显著的降低了Caco-2细胞SOD酶活性(P<0.01);而有机物可降低三价铁对Caco-2细胞内SOD的消耗,且随着葡萄糖、乳糖、抗坏血酸和草酸添加水平的增加,细胞SOD活性逐渐增加;而相对于空白对照组(去离子水),Fe-葡萄糖和Fe-乳糖组可显著降低细胞SOD活性(P<0.05),Fe-抗坏血酸和Fe-草酸组细胞SOD活性无显著改变。与FeCl3相比,Fe-葡萄糖和Fe-乳糖组可降低Caco-2细胞GSH-Px活性,而Fe-抗坏血酸结合可显著提高GSH-Px活性(P<0.05),Fe-草酸结合对其影响不大。三价铁及与有机物结合对Caco-2细胞标志性酶(AKP)活性影响表明,三价铁及与有机物结合均显著降低了Caco-2细胞AKP活性(P<0.05)。但三价铁与有机物结合后均不同程度的降低了三价铁对Caco-2细胞AKP活性的影响,且Fe-抗坏血酸和Fe-草酸组合效果最好(P<0.05)。
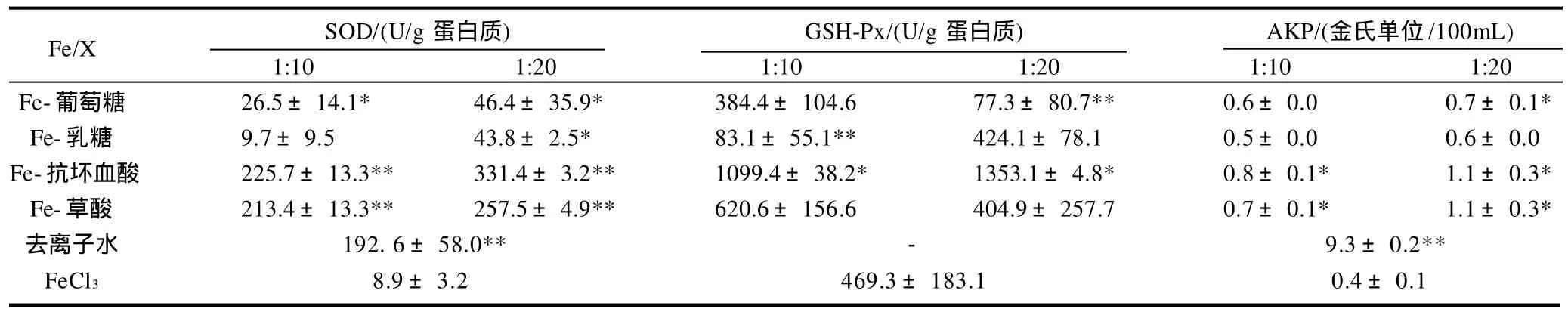
表1 Fe3+-有机物对Caco-2细胞酶活性的影响Table 1 Effect of the presence of organic compounds on the activities of SOD, ALK and GSH-Px in Caco-2 cells
3 结论与讨论
3.1 有机化合物对铁生物有效性的影响
铁生物有效性指的是能被生物体吸收利用并具有生理功能的部分,在实践中可通过含量、吸收、化学形态或生理功能的改善来评价铁生物有效性的高低。研究认为,铁生物有效性易受食物组成成分的影响,如半胱氨酸[10]、部分有机酸[11]、抗坏血酸[12]、某些糖类[13]等对铁吸收均有不同程度的促进作用;而植酸[14]、单宁酸[15]、植物纤维[16]、多酚类[17]、磷[18]、草酸[19]等却对铁吸收有抑制作用。本研究结果表明,抗坏血酸、乳糖和葡萄糖对三价铁生物有效性有显著的促进作用。抗坏血酸和乳糖均具有还原性,能够将三价铁还原成二价铁[12,20],而二价铁是肠道主要吸收形式。葡萄糖分子中含有游离的醛基,在氧化剂存在时,能被氧化成糖酸,从而降低溶液pH值,而弱酸条件有利于铁的吸收[7,12]。本研究表明,草酸能降低三价铁生物有效性,这一结果与早期的研究一致[11]。尽管草酸可降低溶液pH值,研究表明2mmol/L和4mmol/L的草酸可使中性溶液pH值降低为6.3和5.1,但草酸更容易与铁结合成难溶的草酸盐,从而降低铁的有效性[11]。
3.2 有机结合物对铁毒性的影响
MTT吸收量分析是免疫学细胞毒性测定的重要指标,由Mosmann首次应用于细胞免疫学。MTT反映细胞对外来刺激的敏感性,也是评价细胞存活率的重要指标[20]。本研究结果表明,三价铁对Caco-2细胞生存能力无显著影响,这一结果与早期的研究相同[4]。Fe-抗坏血酸结合显著地提高了Caco-2的生存能力,表明抗坏血酸的还原作用并未使转化的二价铁量达到毒害作用。同时LDH漏渗表明,抗坏血酸保护了细胞膜免受三价铁及其他氧化物的氧化损伤。MTT分析和LDH漏渗表明,乳糖尽管对铁生物有效性是有利的,但乳糖却促进三价铁的毒性,尤其是乳糖水平较高时,Fe-乳糖结合毒性更强。本研究还表明,Fe-草酸结合尽管对Caco-2细胞膜透性无显著影响,但却降低了细胞的生存能力,具体机制并未见报道。本研究认为,有可能是草酸与铁结合形成难溶性沉淀,覆盖于细胞层表面,从而影响细胞对营养物质及MTT的吸收所致。
三价铁及其有机结合物对Caco-2细胞酶活性的影响表明,三价铁离子显著降低了细胞SOD和AKP活性,而铁与有机物结合却在一定程度上提高了酶活性。无机铁离子被认为性质极不稳定,可诱导细胞膜脂质过氧化反应,产生氧化自由基。对大鼠的研究表明,无机铁离子可使大鼠体内氧化产物提高,而导致自由基增多,破坏体内的抗氧化体系平衡[21]。而三价铁与有机物结合可提高铁的稳定性,降低三价铁离子的氧化损失作用和产生自由基的概率。但有机物与三价铁的结合能力是不同的,本研究表明,抗坏血酸、草酸与铁的结合能力大于葡萄糖和乳糖,表现为Fe-抗坏血酸和Fe-草酸处理组细胞SOD、GSH-Px和AKP活性高于Fe-葡萄糖和Fe-乳糖组。
总之,抗坏血酸、葡萄糖、乳糖均有提高三价铁有效性的作用,尤其以抗坏血酸效果最好,草酸对三价铁生物有效性的影响不显著。抗坏血酸可显著降低三价铁毒性,草酸、高水平乳糖与三价铁结合可显著降低细胞的生存能力。
[1] UNICEF/UNU/WHO/MI. Preventing iron deficiency in women and children[C]//International Nutrition Foundation and the Micronutrient Initiative Boston. New York:Technical Workshop UNICEF, 1999:1-60.
[2] 王永飞, 马三梅, 冉艳红, 等. 利用植物基因工程改良铁营养成分的研究进展[J]. 食品科学, 2005, 26(4):248-251.
[3] BETTINA Z, MANSOUR S, MICHAELA Z, et al. Toxicological effects of iron on intestinal cells[J]. Cell Biochemistry and Function,2004, 22:143-147.
[4] HE Wanling, FENG Ying, LI Xiaoli, et al. Availability and toxicity of Fe (II) and Fe (III) in Caco-2 cells[J]. Journal of Zhejiang University Science B, 2008, 9(9):707-712.
[5] BETTINA Z, MICHAELA Z, PATRICIA P, et al. Iron uptake and toxicity in Caco-2 cells[J]. Journal of Microchemical, 2005, 79:393-397.
[6] 刘传国, 胡志和, 李娜. 含乳铁素的乳酸制品对淋巴细胞增值的影响[J]. 食品科学, 2007, 28(10):504-506.
[7] HE Wanling, FENG Ying, LI Xiaoli, et al. Comparison of iron uptake from reduced iron powder and FeSO4using the Caco-2 cell model:Effects of ascorbic acid, phytic acid, and pH[J]. Journal of Agricultural and Food Chemistry, 2008, 56:2637-2642.
[8] MOSMANN T. Rapid colorimetric assay for cellular growth and survival:Application to proliferation and cytotoxicity assays[J]. Journal of Immunological Methods, 1983, 65:55-63.
[9] 张卓然. 培养细胞学与细胞培养技术[M]. 上海:上海科学技术出版社, 2004:427-432.
[10] TAYLOR P G, MARTINEZ T C, ROMANO E L, et al. The effect of cysteine-containing peptides released during meat digestion on iron absorption in humans[J]. American Journal of Clinical Nutrition, 1986,43:68-71.
[11] SALOVAARA S, SANDBERG A S, ANDLID T. Organic acids influence iron uptake in the human epithelial cell line Caco-2[J]. Journal of Agricultural and Food Chemistry, 2002, 50:6233-6238.
[12] ZHU L, GLAHN R P, YEUNG C K, et al. Iron uptake by Caco-2 cells from NaFeEDTA and FeSO4:Effects of ascorbic acid, pH, and a Fe(II)chelating agent[J]. Journal of Agricultural and Food Chemistry, 2006,54:7924-7928.
[13] BAIK B H, LEE Y W, LEE Y B, et al. Antianemic agent containing iron and difructose:US, 5700832[P]. 1997-12-03.
[14] GLAHN R P, WORTLEY G M. Inhibition of iron uptake by phytic acid, tannic acid, and ZnCl2:Studies using anin vitrodigestion/Caco-2 cell model[J]. Journal of Agricultural and Food Chemistry, 2002, 50:390-395.
[15] SOUTH P K, MILLER D D. Iron binding by tannic acid:Effects of selected ligands[J]. Food Chemistry, 1998, 63:167-172.
[16] REINHOLD J, GARCIA L P M, ARIAS-AMANDO L, et al. Dietary fiber-iron Interactions:fiber-modified uptakes of iron by segments of rat intestine[C]//VAHOUNY G, KRITCHEVSKY D. Dietary Fiber in Health and Disease. New York:Plenum Press, 1982.
[17] ZIJP-ITSKE M, KORVER O, TIJBURG-LILIAN B M. Effect of tea and other dietary factors on iron absorption[J]. Critical Reviews in Food Science and Nutrition, 2000, 40:371-398.
[18] OIKET O S, MENKIR A, BUSSIE M D, et al. Assessment of concentrations of iron and zinc and bioavailable iron in grains of early-maturing tropical maize varieties[J]. Journal of Agricultural and Food Chemistry,2003, 51:3688-3694.
[19] STEINKE F, HOPKINS D. Biological availability to the rat of intrinsic and extrinsic iron with soybean protein isolates[J]. Journal of Nutrition,1978, 108:481-489.
[20] CARMICHAEL J. Evaluation of a tetrazoliumbased semiautomated colorimetric assay:Assessment of radiosensitivity[J]. Cancer Research,1987, 47:943-948.
[21] 赵宝路. 氧自由基和天然抗氧化剂[M]. 北京:科学出版社, 1999:42-50.
Effects of Organic Compounds on Bioavailability and Toxicity of Ferric Salts
HE Wan-ling,LI Xiao-li
(College of Animal Science and Technology, Henan University of Science and Technology, Luoyang 471003, China)
TS201.2
A
1002-6630(2010)17-0355-04
2010-01-06
河南科技大学博士启动基金项目(09001406);河南省教育厅自然科学项目(2010B230001);国家自然科学基金项目(20677051)
何万领(1976—),男,副教授,博士,主要从事微量元素与生物健康研究。E-mail:hwling674@yahoo.com.cn
