鸭肠道内产蛋白酶乳杆菌的分离筛选
2010-10-19潘道东
童 敏,潘道东*
(宁波大学生命科学与生物工程学院,浙江 宁波 315211)
鸭肠道内产蛋白酶乳杆菌的分离筛选
童 敏,潘道东*
(宁波大学生命科学与生物工程学院,浙江 宁波 315211)
分离筛选鸭肠道内产蛋白酶乳杆菌。利用脱脂乳培养基,从鸭消化道中分离筛选出两株产蛋白酶的乳酸菌,对菌体形态、染色反应、培养性状、生理生化性状进行系统研究,结合16S rRNA序列分析鉴定出筛选的乳酸菌为干酪乳杆菌鼠李糖亚种和干酪乳杆菌干酪亚种。
乳杆菌;产蛋白酶;分离;鉴定
Abstract:Two lactic acid bacterial stains having the ability to produce protease were isolated and screened from the gastrointestinal tract of duck with the aid of skim milk medium. The stains were identified asLactobacillus caseisubsp.,RhamnosusandLactobacillus caseithrough the systematic investigations of morphology, staining reaction, physiological and biochemical characteristics and 16S rRNA sequences analysis.
Key words:Lactobacillus;producing protease;screening;identification
对乳酸菌的分类、鉴定,传统的方法包括形态特征、生理生化反应及血清学反应等。这种方法都存在实验周期长,不能进行分型或鉴定到亚种,实验结果主观性强等缺点。本实验结合16S rRNA序列分析方法[2],通过提取样品中微生物的总DNA,从核酸水平对筛选的菌株进行鉴定,
国内外有较多报道从人、动物的消化道中成功分离乳杆菌[3-4],但从鸭肠中分离乳杆菌却未见报道。本实验从鸭肠道中分离出两株产蛋白酶乳杆菌,应用16S rRNA基因序列扩增方法进行分子水平上的鉴定,为进一步研究乳杆菌蛋白酶多态性选择优良菌种。
1 材料与方法
1.1 材料与试剂
绿头鸭 市售。
TaqDNA聚合酶、dNTP MasterMix、10×PCR缓冲液、DL2000 DNAMarker 大连宝生物工程有限公司;电泳级琼脂糖 BioBasic公司;6×DNA上样缓冲液 Takara公司。
1.2 培养基
MRS培养基、SL乳杆菌选择培养基[5]、生化实验培养基[6](糖发酵培养基、明胶、吲哚、硫化氢、耐酸、耐胆盐实验用培养基)。
1.3 仪器与设备
立式高压灭菌锅 上海申安医疗器械厂;恒温恒湿培养箱 宁波江南仪器厂;双控电泳仪 北京君意东方电泳设备有限公司;Mastercycler梯度PCR仪 德国Eppendorf公司;紫外凝胶成像系统 美国Bio-Rad公司。
1.4 方法
1.4.1 乳杆菌初步筛选
杀死鸭子后,无菌取出内脏,在无菌平皿内分出盲肠、小肠。取黄豆大小的内容物分别置于装有生理盐水的Eppendorf管中,10倍梯度稀释成7个梯度,各取0.2mL涂布于MRS培养基上,采用烛缸法[7],37℃培养48h。挑选白色、圆形、表面光滑湿润、边缘整齐、凸起的特征菌落,转接种于SL乳杆菌选择培养基,37℃培养48h。挑取单菌落进行镜检,挑选革兰氏阳性、镜检为杆状的菌落作为待筛选菌株。
7) 修复后结构增重小。复合材料补片密度较小,但力学性能优越,有较高的比强度和比刚度。复合材料补片以更小的尺寸和更轻的质量获得与传统金属材料同等的修复效果。
1.4.2 产乳酸的鉴定
通过纸层析乳酸定性实验确定出产乳酸细菌。分别将可疑细菌移入发酵培养基中,30℃静置培养12h,取10mL发酵液进行离心,对上清液进行纸层析。纸层析法[8]:新华1号滤纸,溶液系统为正丁醇、甲酸、水,其体积比为80:15:5,显色剂为0.04g/100mL溴酚蓝-乙醇溶液,0.1mol/L NaOH溶液调pH值为6.7,乳酸标准溶液体积分数为2%,标准液、各菌株发酵液以毛细管点样上行层析,显色比较各斑点的Rf值[9]与标准乳酸的Rf*值。
1.4.3 产蛋白酶菌株复筛
采用脱脂乳培养基[10],梯度稀释菌体进行涂布,挑选产生水解圈的菌株作为目标菌株。
1.4.4 生理生化鉴定
筛选出的目标菌株通过过氧化氢酶实验、糖类发酵实验、硝酸盐还原实验、产硫化氢实验、明胶液化实验、吲哚实验、耐酸耐碱实验等[11],从生理生化角度鉴定出所筛选菌株的种类。
1.4.5 乳杆菌基因组DNA的制备
取10mL目标菌株过夜培养物,在4℃、12000r/min离心收集菌体1mL,加入400μL STET(0.1mmol/L NaCl、10mmol/L Tris-HCl、1mmol/L EDTA、体积分数5% Triton X-100 pH8.0)、10μL Lys,37℃保温20min,加入等体积苯酚-异戊醇,12000r/min离心10.5min取上清,加等体积苯酚-异戊醇,12000r/min离心5min,取上清加入1/10醋酸钠和1倍体积乙醇,混匀-20℃放置10min,12000r/min离心10min,弃上清加入0.5mL 75%乙醇溶液洗涤DNA沉淀,最后将DNA溶于50μL双蒸水中,-20℃保存[12]。
1.4.6 16S rRNA的PCR扩增
PCR反应体系为灭菌三蒸水16μL、Buffer 2.5μL、Mg2+2.5μL、引物各0.5μL、DNA模板1μL、Taq酶0.2μL。引物 27f:5′-AGAGTTTGATCCTGGCTCAG-3′和 1492r:5′-TACGGCTACCTTGTTACGACTT-3′。在净化工作台冰上操作,扩增条件:95℃预变性5min;94℃变性50s,56℃退火50s,72℃延伸80s,循环30次;72℃延伸10min。
1.4.7 扩增产物的电泳分析及纯化
配制琼脂糖凝胶,取PCR扩增产物6.5μL,加入溴酚蓝指示剂,混匀后加样。95V电泳30min,溴化乙锭染色20min,在紫外凝胶成像系统中观察电泳结果。切下目的条带,回收纯化,以进行下一步的连接转化。
1.4.8 构建重组质粒
将PCR产物回收后,与载体T18在4℃条件下过夜连接,连接产物吸到100μL感受态细胞中,温和混匀,置于冰上30min。42℃热休克90s,迅速放回冰中,将细胞冷却1~2min后,加入800μL LB培养基,37℃、125r/min,摇荡培养细菌45~90min。4000r/min离心1min,沉淀菌体,吸去上清液,留250μL左右转化混合物铺于LB琼脂平板上(Amp+),室温下放置20~30min,待溶液完全被琼脂吸收后,倒置平皿37℃培养12~16h。随机挑取单菌落作PCR进行初步检测,并振荡培养。
1.4.9 菌种鉴定和测序
将过夜振荡培养的菌体送由上海生工生物工程技术有限公司测定序列,测序结果用Blast法[13]鉴定。
2 结果与分析
2.1 乳杆菌培养特征及形态特征
M RS培养基上,挑选菌落灰白色,扁平,表面光滑,边缘较整齐的菌落继续培养在SL培养基上,将长出的菌落进行革兰氏染色、镜检。淘汰球菌及链球菌,筛选出7株革兰氏染色阳性,无芽孢,杆状的菌株划斜面待进一步鉴定。
2.2 产乳酸鉴定结果
初筛获得的7株疑似菌株中有4株分别标记为S1、S2、S7、M13经过纸层析后斑点的Rf值与乳酸标准品的Rf*值大致相同,确定为产乳酸菌株。其余3株菌株没有出现相应的斑点,则不视为目标菌株。
2.3 产蛋白酶实验
经脱脂乳培养基复筛后,得到S1、S2水解圈较为明显,在梯度稀释6倍后在培养基上产生水解圈。S7没有出现水解圈,则排除在筛选对象之外。M13水解能力很差,只有在没有进行梯度稀释时有少量水解圈,故将其剔除。筛选出S1、S2两株产蛋白酶乳杆菌进行下一步鉴定,其菌体形态及水解圈见图1、2。

图1 菌株 S1、S2的菌体形态Fig.1 Morphology of strains S1and S2
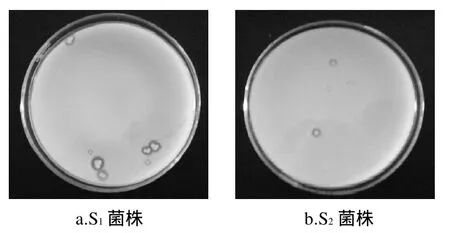
图2 菌株稀释10-6倍后在脱脂乳培养基上呈现的水解圈Fig.2 Hydrolysis ring of diluted strains (10-6) on skim milk mediu
2.4 生理生化鉴定

表1 菌株S1、S2生理生化特性Table 1 Physiological and biochemical characteristics of strains S1and S2
从表1可以看出,菌株S1、S2经过氧化氢酶实验、硝酸盐还原实验、产硫化氢实验、明胶液化实验、吲哚实验均呈阴性。通过《伯杰氏细菌鉴定手册》[13]进行比对,表明分离到的S1、S2菌株为乳杆菌。糖发酵实验结果表明S1、S2均能利用果糖、半乳糖、乳糖、葡萄糖、蔗糖、麦芽糖、甘露醇,不能发酵棉籽糖、鼠李糖、木糖,初步鉴定为干酪乳杆菌,生理生化实验结果为后续16S rRNA测序结果提供佐证,结合两者的结论使鉴定结果更为可信。
2.5 耐酸耐碱实验
从表2可以看出,S1可以在pH3.0~10.0生长,在pH5.0~7.0生长良好,而S2菌株对酸碱环境有更好的耐受能力,可以在pH2.5~11.0的环境中生长。两者对极端酸碱环境耐受能力均不强,适宜在pH5.0~7.0的环境中生长。
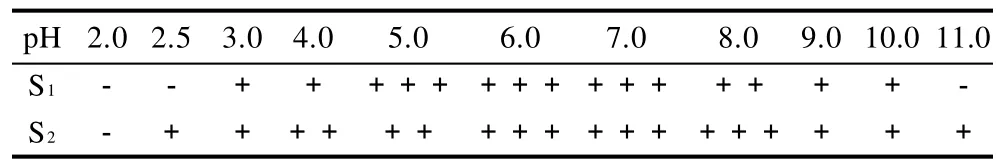
表2 菌株S1、S2耐酸耐碱实验结果Table 2 Acid-resistant and alkali-resistant tests of strains S1and S2
2.6 DNA的提取
所提取的DNA经琼脂糖凝胶电泳、溴化乙锭染色后在凝胶成像仪下观察,显示有明亮的条带出现,表明S1、S2菌株基因组DNA提取成功,结果见图3。
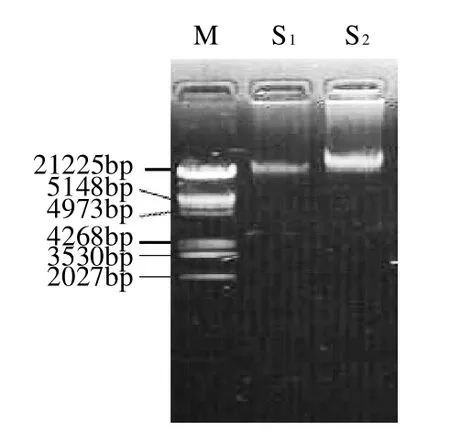
图3 菌株S1与S2基因组DNA电泳图谱Fig.3 Electrophoresis patterns of genomic DNA of strains S1and S2
2.7 目标片段的扩增

图4 S1、S2菌株16S rRNA基因PCR反应产物电泳图谱Fig.4 Electrophoresis patterns of PCR-amplified products of 16S rRNA of strains S1and S2
如图4所示,分离得到乳酸菌,目标片段扩增结果均为3500bp左右,表明16S rRNA扩增成功。
2.8 同源性比较分析
测序结果表明,从鸭肠中分离到的两株产蛋白酶菌株的16S rRNA序列长度分别为3486bp和3428bp,将该序列在GenBank上应用Blast程序与数据库中已有的乳酸菌16S rRNA部分序列进行同源性比较。发现所测得的S1序列与数据库中已发表的干酪乳杆菌鼠李糖亚种的16SrRNA序列进行相似性比较,同源性为99%。S2序列与数据库中已发表的干酪乳杆菌干酪亚种16S rRNA序列进行相似性比较,同源性为98%。
3 结 论
本实验从鸭肠中分离出两株乳杆菌,两者经脱脂乳培养基鉴定都具有产蛋白酶的能力,过氧化氢酶实验、硝酸盐还原实验、产硫化氢实验、明胶液化实验、吲哚实验均为阴性,结合革兰氏染色镜检,对照《伯杰氏细菌鉴定手册》[13]确定S1、S2号菌株为乳杆菌;根据糖类发酵实验结果,并通过16S rRNA鉴定表明S1、S2号菌株分别为干酪乳杆菌鼠李糖亚种与干酪乳杆菌干酪亚种。
乳酸菌之所以有水解乳蛋白的能力,是因为乳酸菌存在的乳蛋白水解系统将乳蛋白水解成多肽或氨基酸序列,不同的菌种所含有的蛋白酶种类不同,对于乳蛋白的水解切点也不同,所水解的产物也具有各异的生理功能。有报道[14-15]称乳酸菌蛋白酶水解系统包括胞壁蛋白酶、肽链内切酶、氨肽酶、pro-特异性肽酶等,胞壁蛋白酶首先把乳蛋白水解成一系列的短肽,然后由转运系统运输至胞内,再由胞内肽酶进一步将短肽水解成氨基酸或更小的肽段。可见,乳酸菌细胞壁蛋白酶在水解乳蛋白过程中占有非常重要的地位。本研究旨在筛选出产蛋白酶的乳酸菌后,进一步研究乳杆菌蛋白酶特别是胞壁蛋白酶的酶学特性及调控机制,以期了解乳杆菌胞壁蛋白酶的差异性与其发酵产品生理功能的关系,为进一步定向选育优良乳酸菌种提供参考。
[1] MANSO M A, LEONIL J, PIOT M, et al. Isolation and characterisation of aLactobacillus helveticusITG LH1 peptidase-rich sub-proteome[J].International Journal of Food Microbiology, 2005, 105(2):119-129.
[2] 杜晓华, 艾日登才次克, 李莉. 蒙古国地区酸乳中乳酸菌的鉴定及耐酸菌株筛选[J]. 微生物学通报, 2009, 36(7):994-1000.
[3] SHIRO I, TAKESHI A, SAYAKA W, et al. Isolation of halotolerantLactococcus lactissubsp. lactis from intestinal tract of coastal fish[J].International Journal of Food Microbiology, 2008, 121(1):116-121.
[4] 尹军霞, 沈国娟, 邹波, 等. 东北虎肠道降胆固醇双歧杆菌的分离鉴定[J]. 食品科学, 2009, 30(5):205-208.
[5] 杨洁彬, 凌代文. 乳酸菌:生物学基础及应用[M]. 北京:中国轻工业出版社, 1996.
[6] 赵斌, 何绍江. 微生物实验手册[M]. 北京:科学出版社, 2002.
[7] 伍时华, 黄翠姬, 石媛靖, 等. 酸乳菌种分离纯化方法[J]. 食品科学,2004, 25(10):162-166.
[8] 刘晓辉, 陈顺, 高晓梅, 等. 酸菜中乳酸菌的分离筛选与鉴定研究[J].中国酿造, 2009(2):62-64.
[9] 潘道东. 抗ACE活性之瑞士乳杆菌的筛选[J]. 食品科学, 2008, 29(2):145-148.
[10] 冯新忠, 王咏星, 范镇明, 等. 额尔齐斯河野生丁肠道产蛋白酶菌株的初步鉴定及产酶条件的研究[J]. 食品工业科技, 2008(4):104-106.
[11] 张大为, 张洁, 丁成华. 婴儿肠道内嗜酸乳杆菌L2的筛选及菌株代谢产物的初步分析[J]. 食品科学, 2008, 29(4):253-258.
[12] SAMBROOK J, RUSSEL D W. 分子克隆实验指南[M]. 黄培堂, 译.3版. 北京:科学出版社, 2002:87-105.
[13] 布坎南R E, 吉本斯N E. 伯杰氏细菌鉴定手册[M]. 8版. 北京:科学出版社, 1984.
[14] TERESA Z, ANNAMARIA R, EUGENIO P. Enzymatic activities of lactic acid bacteria isolated from Cornetto di Matera sourdoughs[J].International Journal of Food Microbiology, 2007, 115(2):165-172.
[15] NSEREKO V L, SMILEY B K, RUTHERFORD W M, et al. Influence of inoculating forage with lactic acid bacterial strains that produce ferulate esterase on ensilage and ruminal degradation of fiber[J]. Animal Feed Science and Technology, 2008, 145(1/4):122-135.
Isolation and Screening of Protease-producingLactobacilliin Duck Gastrointestinal Tract
TONG Min,PAN Dao-dong*
(College of Life Science and Biotechnology, Ningbo University, Ningbo 315211, China)
Q93.331
A
1002-6630(2010)17-0197-04
2010-01-09
国家自然科学基金项目(30972130);江苏省科技支撑计划项目(BE2009366);国家农业转化基金项目(2009GB2C220412);国家“863”计划项目(2007AA10Z357)
童敏(1985—),女,硕士研究生,研究方向为食品生物技术。E-mail:tongmin1106@126.com
*通信作者:潘道东(1964—),男,教授,博士,研究方向为乳品科学。E-mail:daodongpan@163.com
