草鱼胶原凝集素基因的克隆及其功能分析
2010-10-16李琴马梅生胡成钰
李琴,马梅生,胡成钰
南昌大学生物科学系,南昌 330031
草鱼胶原凝集素基因的克隆及其功能分析
李琴,马梅生,胡成钰
南昌大学生物科学系,南昌 330031
从草鱼Ctenopharyngodon idella肝肾cDNA文库中克隆得到胶原凝集素基因。草鱼胶原凝集素全长cDNA为1128 bp,其中5′非编码区229 bp,3′非翻译区104 bp,最大开放阅读框为795 bp,编码264个氨基酸。系统进化分析表明草鱼胶原凝集素与斑马鱼的亲缘关系最近。根据草鱼胶原凝集素序列特征,克隆了包含糖基识别域(CRD)的cDNA,并进行原核表达、纯化获得其重组蛋白PCRD。进行PCRD与6种细菌的凝集和糖抑制实验,结果表明半乳糖、葡萄糖、甘露糖和麦芽糖 4种糖都会使 PCRD与嗜水气单胞菌的凝集明显下降甚至极大地干扰凝集;麦芽糖使金黄色葡萄球菌的凝集明显下降,而肽聚糖和甘露糖会使凝集受到抑制;此外,PCRD的凝集反应不依赖Ca2+。
C-型凝集素,胶原凝集素,糖基识别域,表达,草鱼
Abstract:The grass carp(Ctenopharyngodon idella)collectin gene was cloned from mixed liver and kidney cDNA library.The full length sequence of grass carp collectin was 1128 bp, contained a 5′ untranslated region of 229 bp and a 3′ untranslated region of 104 bp.The open reading frame of grass carp collectin was 795 bp which could code a 264 amino acids polypeptide, including a terminal codon.Phylogenetic analyses showed that grass carp collectin shared the highest homology with that of zebrafish(Danio rerio).To understand the function of grass carp collectin, we expressed and purified the recombinant protein(PCRD)that comprised carbohydrate recognition domain(CRD).Agglutination of Aeromonas hydrophila and Staphylococcus aureus etc.and sugars inhibition experiments showed that: galactose, glucose, mannose and maltose could inhibit the agglutination of Aeromonas hydrophila.Maltose could lower the agglutination of Staphylococcus aureus, whereas peptidoglycan and glucose inhibited it well.In addition, the activity of grass carp collectin could not dependent on Ca2+.
Keywords:C-type lectin, collectin, carbohydrate recognition domain(CRD), expression, grass carp
C-型凝集素(C-type lectins)是凝集素的重要一员,它是一种Ca2+依赖的糖结合蛋白,在机体的先天免疫和获得性免疫、控制糖蛋白的生物合成等方面发挥着重要功能[1-3]。虽然在不同的物种中,C-型凝集素差异很大,但一般至少含有1个由约130个氨基酸残基组成的糖基识别域(Carbohydrate recognition domain,CRD)[4-5]。根据CRD的一级结构的差异可以将C-型凝集素分为蛋白聚糖、Ⅱ型跨膜受体、胶原凝集素、选凝素、白细胞受体、巨噬细胞甘露糖受体、单一或原始凝集素7个家族[6-7]。而且,目前仍有一些新的C-型凝集素成员陆续报道。
胶原凝集素(Collectin)是一种可溶性的模式识别受体,包括甘露糖结合凝集素(MBL)、肺表面活性物质脱辅基蛋白(SP)A和D、肝胶原凝集素1(CL-L1)、46 kDa胶原凝集素(CL-46)、胶固素(Conglutinin)等,是脊椎动物先天免疫中的重要分子,参与多种病原微生物的识别与清除以及免疫细胞的识别与迁移。胶原凝集素的功能主要由CRD调节。CRD可选择性识别多种微生物和病毒感染细胞表面具有末端甘露糖(Man)、甘露糖胺(ManNAc)及岩藻糖(Fuc)等的糖结构,并通过触发各种识别和清除机制如激活补体、调理吞噬及中和病毒等而发挥胶原凝集素先天免疫的作用[8]。
目前已先后在人 Homo sapien及小鼠的 Mus musculus等多种动物中报道了胶原凝集素基因,并开展了胶原凝集素与自身免疫性疾病和抗感染免疫的病理生理等方面的研究[9]。作为构成细胞先天免疫第一道防线,胶原凝集素在斑马鱼Danio rerio等多种鱼类中广泛存在[10-13],但对其功能的研究还不多见。本研究从草鱼肝肾cDNA文库中筛选到1个克隆,经测序和特征分析确定其为草鱼胶原凝素(GenBank Accession No.GQ141696)。原核表达、亲和纯化获得了草鱼胶原凝素包含糖基识别域的重组蛋白(PCRD)。凝集实验表明PCRD具有凝集多种细菌的功能,同时也初步分析了PCRD凝集细菌的分子机理。本实验对了解鱼类胶原凝集素的功能具有一定的意义。
1 材料和方法
1.1 材料
草鱼肝肾 cDNA文库(载体为 pBluescriptⅡ S K ,宿主菌为大肠杆菌DH5α)由本实验室保存。表达载体pET32a购自Novagen公司。表达菌BL21(DE3)pLysS购自Promega公司。凝集用实验菌株由南昌大学生物基础实验中心提供。引物合成、测序由上海生工生物工程技术服务有限公司完成。
限制性内切酶 EcoRⅠ、XhoⅠ及连接试剂盒购自 TaKaRa公司;胶回收试剂盒、质粒小提纯化试剂盒购自天根公司;PCR产物纯化试剂盒购自BBI公司;His·Bind Purification Kit购自 Novagen 公司。
1.2 草鱼胶原凝素基因的克隆及其分子特征
根据已报道的人及鼠C-型凝集素cDNA序列设计、合成、标记探针序列5'-TGGAACGATGTCCCCT GCTCTGACTCT-3',用该探针筛选草鱼肝肾全长cDNA文库,发现编号为YG006-E03的克隆有杂交带。然后采用 pBluescriptⅡSK载体上的通用引物T3(5'-ATT AAC CCT CAC TAA AGG GAA-3')和T7(5'-TAA TAC GAC TCA CTA TA-3'),扩增该克隆。反应体系为:水18.75 μL,10×PCR反应缓冲液2.5 μL,2.5 mmol/L dNTPs 1 μL,10 μmol/mL 引物各 0.5 μL,菌液 1.5 μL,Taq 酶 0.25 μL。PCR 反应条件:94℃预变性5 min;94℃变性30 s,59℃退火30 s,72℃延伸90 s,30个循环;72℃延伸10 min。
测序后使用ORF finder、SMART等在线软件进行推译和预测,分析其序列的分子特征后,确定其为草鱼胶原凝素。
1.3 胶原凝集素的系统进化分析
在GenBank中检索胶原凝集素,氨基酸序列经Clustal W软件排序比对分析同源性。遗传进化分析通过软件MEGA4用邻位连法计算。
1.4 PCRD重组蛋白的原核表达及纯化
根据草鱼胶原凝集素的序列特征设计 1对引物:5'-CCGGAATTCATG-AGTCCATGCCCAGAGA ACTG-3'和5'-ACGCTCGAGCTA-CCTCTGAGAATT TCACCG-3',克隆草鱼胶原凝集素CRD cDNA序列。将目的片段连接至载体pET-32a,测序验证后转化大肠杆菌BL21(DE3)。
将BL21(DE3)菌接入20 mL含终浓度50 μg/mL Amp的 LB培养基中,37℃振荡培养过夜,接种于200 mL含Amp的LB培养基中,37℃振荡培养至OD600为0.6~0.8时,加终浓度1 mmol/L的IPTG诱导表达5 h。
SDS-PAGE电泳检验蛋白质表达效果:12 000 r/min离心10 min,收集200 mL重组菌,以12 mL bindingbuffer重悬,超声破碎。12 000 r/min离心30 min,收集上清液。
按His-Bind Kit操作手册纯化带(His)6标签的目的蛋白。洗脱的蛋白质溶液再经透析纯化获得PCRD。
1.5 PCRD凝集实验
于96孔板中加入20 μL浓度为0.670 mg/mL的PCRD,每孔中加入大肠杆菌、产气杆菌、变形杆菌、金黄色葡萄球菌、枯草芽孢杆菌、嗜水气单胞菌(菌悬液光密度值OD600分别为:0.015、0.044、0.015、0.024、0.032、0.021)各 20 μL。摇匀后放置 1 h,以不加重组蛋白而加生理盐水作为对照,镜检结果。将含有1 mmol/L CaCl2的PCRD作为对照。
1.6 糖抑制实验
分别在嗜水气单胞菌悬液中加20 μL 80 mmol/L的实验用糖液(生理盐水配制):半乳糖、葡萄糖、甘露糖、麦芽糖。金黄色葡萄球菌悬液中加肽聚糖、甘露糖、麦芽糖做糖抑制实验(方法同1.5)。放置1 h,镜检。
2 结果
2.1 草鱼胶原凝集素基因的克隆及分子特征
在草鱼肝肾 cDNA文库中筛选得到一个编号为YG006-E03的克隆,其核苷酸序列为1128 bp(图1)。经测序和生物信息学分析,鉴定为草鱼胶原凝集素全长 cDNA(图2)。

图1 草鱼胶原凝集素基因的克隆Fig.1 Cloning of grass carp collectin gene by PCR.M: DNA marker DL2000; 1: PCR products of rass carp collectin gene.

图2 草鱼胶原凝集素全长cDNA及其推导的氨基酸Fig.2 Nucleotide sequence and deduced amino acid sequence of grass carp collectin.EPN motif was denoted by shadows.The transmembrane domain was denoted by underline.The carbohydrate recognition domain(CRD)was denoted by real line frames.
测序结果表明,草鱼胶原凝集素基因全长1128 bp,其中含有5′端非翻译区229 bp,3′端非翻译区104 bp(末端具18 bp的Poly(A)尾巴),1085 bp处为加尾信号(AATAAA)。开放阅读框(ORF)位于230~1025 bp处,编码1个由264个氨基酸组成的蛋白质(图2)。其中,46~68 aa为跨膜区,125~256 aa为糖基识别域(CRD)。
2.2 胶原凝集素的系统进化分析
从图3可以看出,胶原凝集素进化过程中,斑马鱼、草鱼、石斑鱼、青 鳉 进化关系较近,鸡、鼠、人、牛处于一支,家蚕和淡水鳌虾处于一分支。
2.3 PCRD的纯化
目的多肽与预期大小一致。采用 Ni-NTA树脂亲和层析纯化表达产物,得到纯化的融合蛋白PCRD(图4)。产物透析浓缩后于−70℃保存备用。
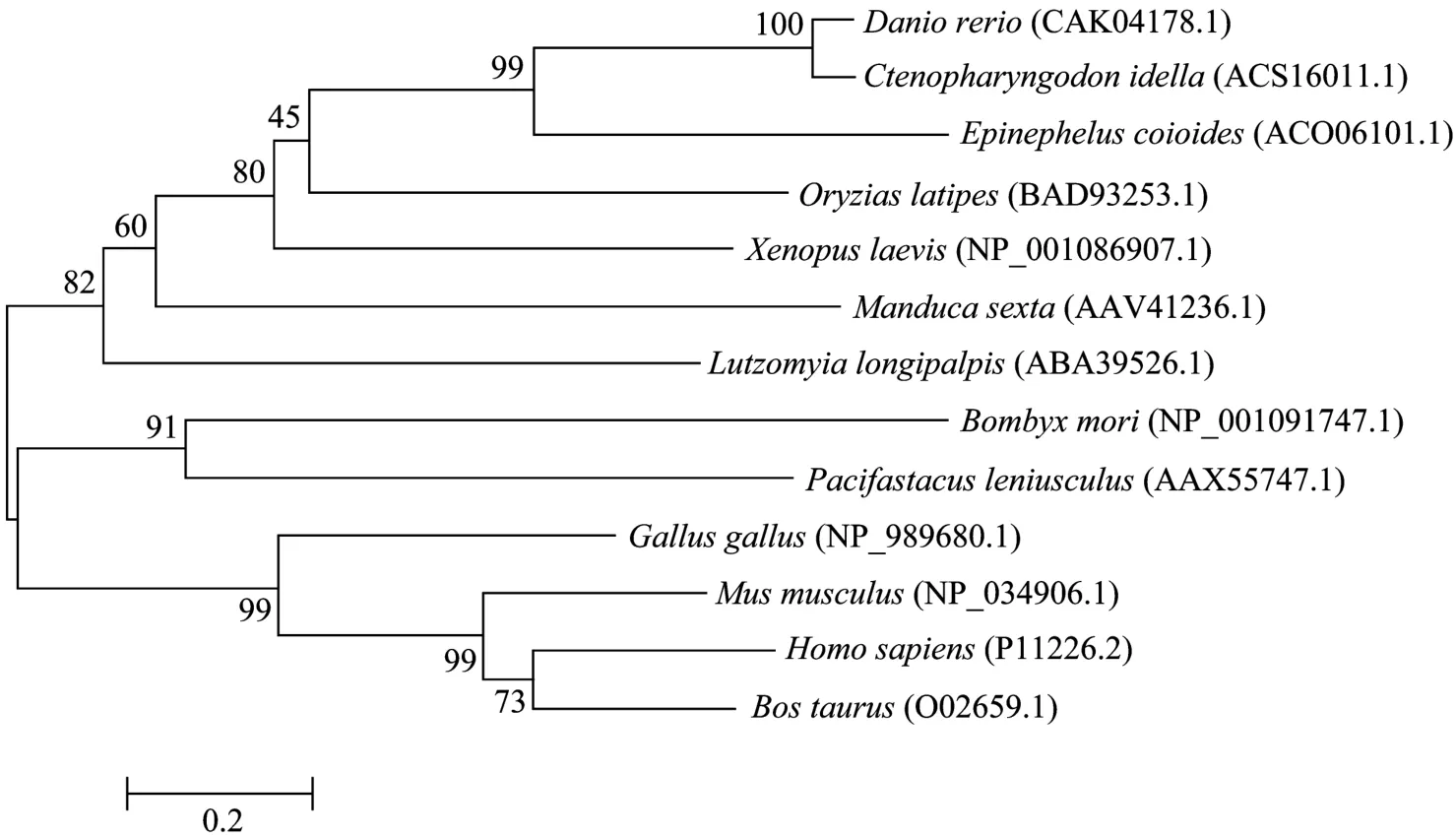
图3 胶原凝集素的系统进化分析Fig.3 Phylogenetic analysis of collectins.Note: Danio rerios, Ctenopharyngodon idella, Epinephelus coioides, Oryzias latipes,Xenopus laevis, Manduca sexta, Lutzomyia longipalpis, Bombyx mori, Pacifastacus leniusculus, Gallus gallus, Mus musculus, Homo sapiens, Bos taurus represent the collectin gene of zebra fish(CAK04178.1), grass carp(GQ141696), Orange-spotted grouper(ACO06101.1), medaka(BAD93253.1), Africa Xenopus laevis(NP_001086907.1), tobacco hornworm(AAV41236.1), Sand flies(ABA39526.1), silkworm(NP_001091747.1), crayfish(AAX55747.1), chicken(NP_989680.1), mouse(NP_034906.1), human(P11226.2), bull(O02659.1), respectively.Sequence accession No.is showed in brackets of the figure.

图4 PCRD的原核表达及纯化Fig.4 Prokaryotic expression and purification of PCRD.Protein was isolated by 12% SDS-PAGE.M: mid-range protein molecular weight marker; 1: non-induced; 2: induced; 3:purified protein.
2.4 PCRD的凝集功能
实验结果显示,草鱼PCRD对6种细菌都有不同程度的凝集作用(表 1),Ca2+不影响凝集。为了解草鱼PCRD与细菌结合的分子机理,选用了革兰氏阴性菌的嗜水气单胞菌和革兰氏阳性菌的金黄色葡萄球菌进行糖抑制实验(表2)。
加入半乳糖、葡萄糖、甘露糖和麦芽糖4种糖后,PCRD与嗜水气单胞菌的凝集明显下降,尤其是甘露糖和麦芽糖会极大地干扰凝集。加入麦芽糖,PCRD与金黄色葡萄球菌的凝集明显下降,而肽聚糖和甘露糖会使凝集受到抑制。
3 讨论
CRD中的EPN基序是C-型凝集素分类的重要标志。一般来说,EPN基序仅在胶原凝集素和选凝素中存在[8]。但选凝素是 C型凝集素中唯一一个CRD位于N端的成员,它介导细胞之间相互识别与黏附。因此,无论是在结构上还是在功能上,胶原凝集素和选凝素都有较大的不同。另一方面,本研究克隆的草鱼胶原凝集素(GQ141696)与斑马鱼的亲缘关系最近(图3), 并与石斑鱼、青 鳉 等胶原凝集素的序列长度很相近,都有EPN基序和1个明显的跨膜区。基于以上证据,推测GQ141696属于C-型凝集素基因家族的胶原凝集素基因。

表1 PCRD对细菌和酵母的凝集作用Table 1 Agglutination of bacteria by PCRD

表2 PCRD对嗜水气单胞菌、金黄色葡萄球菌的糖抑制凝集作用Table 2 Agglutination inhibition of sugars for Aeromonas hydrophila and Staphylococcus aureus by PCRD
细菌性疾病给草鱼养殖带来相当大的危害。其中,嗜水气单胞菌为革兰氏阴性菌,能引起草鱼的细菌性败血症、溃烂病等。金黄色葡萄球菌属于革兰氏阳性菌,也会引起一些细菌性疾病症状。鱼类的免疫系统不像高等动物那样完善,胶原凝集素等非特异性免疫因子在防御病原微生物过程中发挥重要作用。本研究结果初步证实:体外表达的PCRD不但能较为显著地凝集嗜水气单胞菌和金黄色葡萄球菌,此外,还能凝集大肠杆菌、产气杆菌、变形杆菌、枯草芽孢杆菌等多种细菌(表 1)。这表明草鱼胶原凝集素能识别和结合多种不同的异种细胞,因此,它是一种非特异性、广谱性的凝集因子。
草鱼胶原凝集素的广谱性凝集可能与其具有多价性的糖结合位点有关,这些位点在识别和结合外源微生物的细胞壁或细胞膜内复杂的糖分子过程中发挥着重要作用[14]。其中,EPN 3个氨基酸残基的性质可能是 CRD-配体结合特异性的主要决定因素[15]。为验证糖类与凝集反应的关系,本研究选择了半乳糖、葡萄糖、肽聚糖、甘露糖、麦芽糖分别与嗜水气单胞菌、金黄色葡萄球菌混合。从糖抑制效果来看,各种糖有很大的不同。其中,甘露糖对两种菌的凝集都有干扰作用(表 2)。这种与甘露糖的特异性结合在人及小鼠等胶原凝集素中也广泛存在[16]。奇怪的是,与甘露糖不同,麦芽糖虽然干扰了PCRD凝集嗜水气单胞菌,但只是降低了金黄色葡萄球菌的凝集。同样,半乳糖、葡萄糖降低了嗜水气单胞菌的凝集,而肽聚糖则使PCRD失去对金黄色葡萄球菌的凝集。因此,胶原凝集素凝集细菌的分子机理可能十分复杂。一方面,可以理解的是胶原凝集素对不同糖分子的亲和性有较大的差异,而另一方面,是什么原因造成了胶原凝集素对同一种糖类分布在不同细胞上的凝集反应的差异?是否胶原凝集素凝集反应还需要其他的一些因子,特别是一些离子的参与?
虽然属于C型凝集素家族成员,但草鱼胶原凝集素发挥功能时并不需要 Ca2+的参与(表 1)。这可能与它不含钙离子依赖性特征基序“QPD”、“KPS”和“LDN”有关。有趣的是,这种不依赖 Ca2+的胶原凝集素同样存在于其他鱼和低等动物中。例如,柳叶鱼Osmerus lanceolatus的胶原凝集素有不依赖Ca2+的 β-半乳糖结合活性[17];印度对虾 Penaeus indicus和圣保罗对虾Penaeus paulensis胶原凝集素也不需要二价离子(Ca2+和Mg2+)激活[18]。
REFERENCES
[1]Chen CL, Rowley AF, Newton RP, et al.Identification,purification and properties of a beta-1,3-glucan-specific lectin from the serum of the cockroach, Blaberus discoidalis which is implicated in immune defense reactions.Comp Biochem Physiol B, Biochem Mol Biol,1999, 12(2): 309−319.
[2]Stratton L, Wu S, Richards RC, et al.Oligomerisation and carbohydrate binding in an Atlantic salmon serum C-type lectin consistent with non-self recognition.Fish Shellfish Immunol, 2004, 17(4): 315−323.
[3]Jiang H, Ma C, Lu ZQ, et al.β-1,3-glucan recognition protein-2 from Manduca sexta: an acute-phase protein that binds β-1,3-glucan and lipoteichoic acid to aggregate fungi and bacteria and stimulate prophenoloxidase activation.Insect Biochem Mol Biol, 2004, 34(1): 89−100.
[4]Drickamer K.Two distinct classes of carbohydraterecognition domains in animal lectins.J Biol Chem, 1988,263(20): 9557−9560.
[5]Drickamer K, Taylor ME.Biology of animal lectins.Annu Rev Cell Biol, 1993, 9: 237−264.
[6]Drickamer K.Ca2+-dependent carbohydrate-recognition domains in animal proteins.Curr Opin Struct Biol, 1993,3(3): 393−400.
[7]Kilpatrick DC.Handbook of Animal Lectins: Properties and Biomedical Applications.Chichester: John Wiley &Sons, 2000.
[8]Chen ZL.The superfamily of mammalian C-type lectin.Prog Biochem Biophys, 1997, 24(6): 491−496.陈政良.哺乳类C型凝集素超级家族.生物化学与生物物理进展, 1997, 24(6): 491−496.
[9]Wang FY, Chen ZL.Mannose-binding lectin with antiinfection immunity in children.Foreign Med Sci(Sect Mat Child Health), 2002, 13(3): 140−142.王方勇, 陈政良.甘露糖结合凝集素与小儿抗感染免疫.国外医学(妇幼保健分册), 2002, 13(3): 140−142.
[10]Dong CH, Yang ST, Yang ZA, et al.A C-type lectin associated and translocated with cortical granules during oocyte maturation and egg fertilization in fish.Dev Biol,2004, 265(2): 341−354.
[11]Ourth DD, Narra MB, Simco BA.Comparative study of mannose-binding C-type lectin isolated from channel cat fi sh(Ictalurus punctatus)and blue cat fi sh(Ictalurus furcatus).Fish Shellfish Immunol, 2007, 23(6):1152−1160.
[12]Zhang H, Robison B, Thorgaard GH, et al.Cloning,mapping and genomic organization of a fish C-type lectin gene from homozygous clones of rainbow trout(Oncorhynchus mykiss).Biochim Biophys Acta, 2000,1494(1/2): 14−22.
[13]Savan R, Endo M, Sakai M.Characterization of a new C-type lectin from common carp Cyprinus carpio.Mol Immunol, 2004, 41(9): 891−899.
[14]Kerrigan AM, Brown GD.C-type lectins and phagocytosis.Immunobiology, 214(2009): 562−575.
[15]Chen ZL.Molecular mechanism of carbohygrate recognition selectively for mannan-binding protein.Chem Life, 1996, 16(6): 3−5.陈政良.甘露聚糖结合蛋白选择性糖识别的分子机制.生命的化学, 1996, 16(6): 3−5.
[16]Zuo DM, Zhang LY, Lu X, et al.Prokaryotic expression of Balb/C mouse MBL-A carbohydrate recognition domain.J First Mil Med Univ, 2009, 29(2): 267−270.左大明, 张丽芸, 卢晓, 等.Balb/Cdx小鼠甘露聚糖结合凝集素-A糖识别域的原核表达.南方医科大学学报,2009, 29(2): 267−270.
[17]Hosono M, Sugawara S, Ogawa Y, et al.Purification,characterization, cDNA cloning, and expression of asialofetuin-binding C-type lectin from eggs of shishamo smelt(Osmerus [Spirichus]lanceolatus).Biochim Biophys Acta, 2005, 1725(2): 160−173.
[18]Jayasree S.Biological properties of a natural agglutinin in the hemolymph of Indian white prawn, Penaeus indicus H.Aquaculture, 2001, 194(3/4): 245−252.
Cloning and functional analysis of the collectin gene from the grass carp Ctenopharyngodon idella
Qin Li, Meisheng Ma, and Chengyu Hu
Department of Bioscience, Nanchang University, Nanchang 330031, China
Received:July 18, 2009;Accepted:October 22, 2009
Supported by:Key Scientific and Technological Project of Jiangxi Province(No.20061B0260301), Educational Commission of Jiangxi Province(No.GJJ09057), Innovation Project in Graduate Education of Jiangxi Province(No.YC08A018).
Corresponding author:Chengyu Hu.Tel: +86-791-8785566; E-mail: hucy2008@21cn.com江西省重点科技攻关项目(No.20061B0260301),江西省教育厅项目(No.GJJ09057),江西省研究生创新专项资金项目(No.YC08A018)资助。
