两种浓缩方法在水样脊髓灰质病毒检测中的应用
2010-10-16王昆鹏吴明红
杨 明, 沈 杨, 许 海, 王昆鹏, 吴明红
(上海大学环境与化学工程学院,上海 200444)
两种浓缩方法在水样脊髓灰质病毒检测中的应用
杨 明, 沈 杨, 许 海, 王昆鹏, 吴明红
(上海大学环境与化学工程学院,上海 200444)
水样中病毒颗粒的有效浓缩和富集是病毒检测的首要任务.分别应用氯化钠-氯化铝沉淀法和滤膜吸附法,对模拟水样和实际水样的脊髓灰质病毒进行浓缩分离.经过核酸提取后,通过 RT-nest-PCR分子生物学技术扩增特异性核酸片段检测病毒,结果发现,两种浓缩方法对水样中的脊髓灰质病毒都能有效地回收富集及检测.通过计算,分别检测到污水处理厂进水口中病毒存在所用水样的有效体积,氯化钠-氯化铝沉淀法为 3.5 mL,滤膜吸附法为2.1 mL.应用氯化钠-氯化铝沉淀法对另外 3个污水处理厂水样的病毒检测发现,进水口和出水口均有脊髓灰质病毒的存在.另外,制备了包含脊髓灰质病毒特异性核酸片段的阳性质粒标准品,为开展水体环境中有害病毒的检测工作奠定研究基础.
氯化钠-氯化铝沉淀法;滤膜吸附法;肠道病毒;逆转录 PCR;巢式 PCR
Abstract:Effective enrichment and recovery of virus particles from water is the p rimary task in virus detection in water samples.The present study used sodium chloride-aluminum chloride precipitation method and cation-coated filter method to concentrate polioviruses from a simulated virus contaminated water samp le and a real untreated water samp le collected from a sewage treatment p lant in Shanghai.RNA was extracted from concentrated viruses and then reverse transcrip tion-PCR(RT-PCR)and nest PCR were perfomed.The results revealed that polioviruses could be detected from the real water sample by meansof two concentration methods,indicating that viruses had been effectively recovered from water by those two methods.Thepresenceof polioviruseswasdetected from virtual volume of 3.5 mL untreated water sample using sodium chloride-aluminium chloride precipitation method and from virtual volume of 2.1 mL untreated water sample using cation-coated filter method.We also found the presence of polioviruses in the influent and effluent water samples collected from another three sewage treatment p lants using sodium chloride-aluminium chloride p recip itation method and RT-nest-PCR detection. In addition,a recombinent plasmid containing poliovirus-specific fragmentwas constructed and prepared asa positive experimental control for the further poliovirusdetection.Our study p rovided p reliminary data for applicationsof the two differentmethods for virus concentration in water samples and observed potential enteroviruspollution in aquatic environment in Shanghai.
Key words:NaCl-AlCl3precipitation method; cation-coated filter method; enterovirus; reverse transcrip tion-PCR(RT-PCR);nest PCR
污染水体中存在着大量的有机物质,适于各种微生物的生长,因此,污染水体是仅次于土壤的第二种微生物天然培养基[1].水体中的微生物主要来源于土壤以及人类和动物的排泄物,其中病毒的种类包括肠道病毒、腺病毒、肝炎病毒、轮状病毒、星状病毒和诺如病毒等.水环境污染或水系传播而引起的病原体感染是当今世界危害范围最广的环境问题[2].全世界每年由于肠道感染引起痢疾的病例多达 40亿例次,死亡人数多达 220万,成为全球疾病之首[3].因此,对饮用水、环境水源乃至各级污水中污染病毒的检测,是预防控制疾病,评估水源卫生质量、环境卫生情况的一项有价值的工作[4].
肠道病毒的常规检查方法主要有细胞培养法和免疫学方法等.这些方法检测步骤繁琐,操作复杂,检测所需时间较长,而逐渐被分子生物学检测水中病毒的方法所替代.该方法检测水体病毒具有快速、特异性强、灵敏性高的特点,一般分为如下几个步骤:病毒的浓缩和分离、病毒核酸的纯化和提取、病毒核酸的检测.在实践中,对水样中病毒颗粒的有效浓缩和富集是病毒检测的首要任务.常用的水样中肠道病毒的浓缩方法有免疫学反应法、吸附-洗脱法、过滤法、沉淀法等[5],其中吸附洗脱法和絮凝沉淀法是最主要的方法.絮凝沉淀法利用化学物质的絮凝作用,操作简单,应用广泛;膜吸附-洗脱法则利用病毒的胶体性质和蛋白质特性,该方法在国外研究中应用较多[6].目前,国内对水环境中病毒的检测研究不多[7-12],但是,随着公众对水体环境安全的日益重视,病毒检测必不可少.本研究分别采用氯化钠-氯化铝沉淀法[13-14]和滤膜吸附法[15-16]两种方法,对模拟水样和实际水样的脊髓灰质病毒进行浓缩富集,应用分子生物学技术检测特异性核酸片段,并制备阳性质粒标准品,为今后开展水体环境中有害病毒的检测工作奠定研究基础.
1 实验材料与方法
1.1 材料
脊髓灰质炎减毒活疫苗 (猴肾细胞),中国医学科学院医学生物学研究所.模拟水样由 500 mL无菌去离子水中人工添加 0.2 mL脊髓灰质炎减毒活疫苗获得,实际水样取自上海市某污水处理厂 (A厂)的进水口水样,检测水样分别取自上海市 3个污水处理厂 (B厂、C厂和 D厂)的进水口和出水口.A厂、B厂污水处理能力 <5×104m3/d,C厂、D厂污水处理能力≥2×105m3/d.
病毒 RNA提取试剂盒 (TIANamp Virus RNA Kit),天根生化科技有限公司;PrimeScrip tTMOne Step RT-PCR kit、ExTaq热启动聚合酶、PMD18-T质粒连接试剂盒、E.coli HB101感受态细胞、DL 2000 DNA Marker等,宝生物工程有限公司;凝胶回收试剂盒和质粒提取试剂盒,上海生物工程有限公司;0.45μm HA过滤膜 (直径 47 mm)、YM-50超滤管,M ILL IPORE公司;实验所用引物[17],上海生物工程有限公司合成,核酸序列如表 1所示;氯化钠、六水合氯化铝、无水乙醇等试剂等均为国产分析纯,国药集团化学试剂有限公司.

表 1 引物序列Table 1 Sequence of pr imer s
1.2 实验方法
1.2.1 水中病毒的浓缩分离方法
1.2.1.1 氯化钠-氯化铝沉淀法
在待检水样中加入氯化钠颗粒和六水氯化铝溶液,使其终浓度分别达到 1%和 0.005~0.010 mol/L;4℃静置过夜后,4℃5 000 r/min离心15 min;弃上清,沉淀物用 1 mL甘氨酸-EDTA缓冲液洗脱;4℃1 500 r/min离心 10 min,取上清,置于 1.5 mL离心管中,-20℃冻存待检.
后来,学者们继续提出了适用于文化系统迥异的不同民族的文学研究的“阐发研究”和特别关注一国作家或作品在其他国家的接受情形的比较文学的“接受研究”。
1.2.1.2 滤膜吸附法
待检水样过滤膜前,先用 5 mL 250 mmol/dm3氯化铝溶液润洗滤膜,使其带正电荷;然后将 500mL待测水样、200 mL 0.5 mmol/dm3硫酸依次通过滤膜;弃滤液,再用 10 mL 1.0 mmol/dm3氢氧化钠溶液洗脱病毒;收集滤液,加入 50μL 100 mmol/dm3硫酸和 1 mL 10×Tris-EDTA(TE)缓冲液.将上述溶液加入 YM-50超滤管中,20℃,5 000 g离心10 min,收集浓缩液约 500μL,置于 1.5 mL离心管中,-20℃冻存待检.
1.2.2 病毒 RNA的提取
病毒 RNA提取按照试剂盒说明书进行.取 140 μL病毒浓缩液加入至含有 560μL carrier RNA工作液的 1.5 mL的 RNase free的灭菌离心管中,涡旋震荡 30 s;室温孵育 15 min,加入 560μL无水乙醇,涡旋震荡 30 s,转移至包含吸附柱的收集管装置中;8 000 r/min离心 1.5 min,弃废液,依次加入清洗液重复离心操作;弃废液,室温放置 5 min;加入 60μL RNase free dd H2O,室温放置 5 min;8 000 r/min离心 1.5 min,收集病毒 RNA.
1.2.3 病毒核酸的 RT-nest-PCR检测
取待检 RNA样品 (0.5~1.0μg),按照一步法RT-PCR反转录试剂盒操作说明书,依此加入 25μL 2×1 Step Buffer,2μL PrimeScrip t 1 Step Enzyme Mix,通用正向引物 20 pmol,反向外侧引物 20 pmol,加入 RNase free dd H2O补足至终体积为 50μL.在PCR仪上按照以下程序完成一步法 RT-PCR反应:50℃30 min,94℃预变性 2 min;94℃30 s,55℃45 s,72℃80 s,30 cycles;72℃延伸 5 min.反应结束后,取反应液 1μL,依次加入 2.5μL 2×PCR Buffer,0.5μL dNTPMixture(10 mmol/dm3each),通用正向引物 16 pmol,反向内侧引物 16 pmol,0.25 μLTakara ExTaq HS(5 U/μL),加入 RNase free dd H2O补足至终体积为 25μL.在 PCR仪上按照以下程序完成巢式 PCR(nest PCR)反应:94℃预变性2 min,94℃30 s,60℃45 s,72℃80 s,30 cycles;72℃延伸 5 min.反应结束后,取适量反应液用1.2%琼脂糖凝胶电泳检测结果.如果电泳图谱中能检测到脊髓灰质病毒扩增的特异性条带,即代表阳性结果,等同于检测到样品中脊髓灰质病毒的存在.
在无菌环境中切下含有脊髓灰质病毒 RT-nest-PCR特异性扩增条带的琼脂糖凝胶,按照凝胶回收试剂盒操作说明回收 DNA片断,16℃与 pMD18-T载体连接过夜;次日,将连接产物转化至 E.coli HB101感受态细胞中.取 200μL转化细菌液涂布在含氨苄青霉素(100μg/mL)的 LB平板上,37℃过夜培养;次日挑取单个菌落置于含氨苄青霉素 (100μg/mL)的 LB液中,37℃摇床培养过夜,按照质粒小量纯化试剂盒说明书,提取质粒制备脊髓灰质病毒核酸片段质粒标准品.测序工作由上海生物工程有限公司完成,基因核酸序列同源序列分析应用BLAST比对.
2 结 果
2.1 脊髓灰质病毒标准品 RT-nest-PCR检测方法的建立
以脊髓灰质炎减毒活疫苗提取 RNA,进行一步法 RT-PCR和巢式 PCR反应,琼脂糖凝胶电泳在500~750 bp间分别检测到特异条带,与预期的目的片段大小一致.图1中:第 1泳道为一步法 RT-PCR后目标片段,核苷酸长度为 671 bp;第 2泳道为巢式PCR后目标片段,核苷酸长度为 575 bp.从琼脂糖凝胶电泳的检测结果可看出,经过 RT-nest-PCR方法扩增阳性标准品,扩增条带清晰特异,表明本次实验中一步法 RT-PCR和巢式 PCR相结合的方法可用于后续水样中脊髓灰质病毒的检测工作.

图1 脊髓灰质病毒标准品 RT-nest-PCR扩增产物琼脂糖凝胶电泳图Fig.1 Agarose gel analysis of RT-nest-PCR products of poliovirus standard
2.2 脊髓灰质病毒特异性核酸片段重组质粒标准品的制备
对已连接入脊髓灰质病毒核酸片段的 pMD18-T重组质粒进行测序,结果获得一条 575 bp长的核苷酸片段.该序列与国际基因数据库中已发表的脊髓灰质病毒的核苷酸序列 (Genbank accession No.DQ890385)进行序列比对,结果发现,其核酸序列与已发表的脊髓灰质病毒的核苷酸序列完全一致,即相似度为 100%(见图2).这证明用 RT-nest-PCR方法已经成功地扩增到脊髓灰质病毒的核苷酸片段.同时,制备的包含脊髓灰质病毒核酸片段的质粒标准品,可用于后续水样中脊髓灰质病毒检测时的阳性对照品.

图2 RT-nest-PCR方法扩增片段序列与已知脊髓灰质病毒核酸序列比对Fig.2 Alignment of nucleic acid sequence of RT-nest-PCR product w ith known poliovirus sequence
2.3 两种浓缩方法在检测水样病毒核酸中的应用
取人工添加脊髓灰质病毒的模拟水样 500 mL,应用膜吸附法洗脱液提取核酸 RNA后,进行一步法RT-PCR和巢式 PCR反应检测脊髓灰质病毒.结果显示,可检测出病毒核酸 (见图3).这说明膜吸附法可有效地浓缩分离模拟水样中的病毒.取 A厂进水口水样,应用氯化钠-氯化铝沉淀法和滤膜吸附法浓缩分离病毒,分别提取核酸 RNA,并分别进行一步法 RT-PCR和巢式 PCR反应检测脊髓灰质病毒.应用氯化钠-氯化铝沉淀法,取水样 100 mL浓缩分离病毒.应用滤膜吸附法,取 30 mL原水样稀释至 500 mL,浓缩分离病毒.琼脂糖凝胶电泳检测结果显示 (见图4),在 2份 RNA待检样品中都检测到脊髓灰质病毒,这表明氯化钠-氯化铝沉淀法和滤膜吸附法两种病毒浓缩方法都能有效地分离浓缩水样中的病毒.计算能检测到病毒核酸的水样的有效体积,氯化钠-氯化铝沉淀法为 3.5 mL,滤膜吸附法为2.1 mL.

图3 模拟水样中检测脊髓灰质病毒电泳图Fig.3 Agarose gel analysis of RT-nest-PCR product of poliov irus in con tam inated water sam p le
2.4 污水处理厂水样中病毒的检测
应用氯化钠-氯化铝沉淀法浓缩分离 B,C,D厂进水口和出水口水样中的病毒.进水口水样取 100 mL,出水口水样取 1 L.分别提取 6个水样中的病毒核酸 RNA,进行一步法 RT-PCR和巢式 PCR反应检测脊髓灰质病毒.琼脂糖凝胶电泳检测结果显示 (见图5),在 3个水厂的进水口和出水口中都检测到了脊髓灰质病毒的特异性核酸片段.RT-PCR检测所用有效水样体积,进水口为 1.17 mL,出水口为 11.70 mL.

图4 A污水处理厂进水口检测脊髓灰质病毒电泳图Fig.4 Agarose gel analysis of RT-nest-PCR products of poliovirus from the influnent water of No.A wast water treatment plant
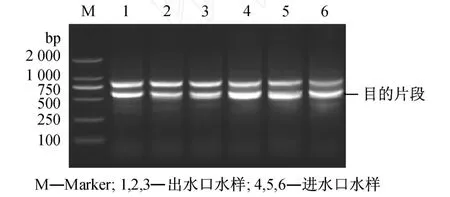
图5 B,C,D污水处理厂检测脊髓灰质病毒电泳图Fig.5 Agarose gel analysis of RT-nest-PCR products of poliovirus from No.B,C and D wast water treatment plant
3 讨 论
本实验尝试用两种浓缩方法对水样中的病毒颗粒进行富集,结果应用氯化钠-氯化铝沉淀法和滤膜吸附法,对某污水处理厂进水口采集实际水样的检测中都发现了脊髓灰质病毒的存在.氯化钠-氯化铝沉淀法利用了化学物质的絮凝作用,病毒吸附到预先形成的铝盐沉淀物上,从而达到浓缩病毒的作用.其优点在于操作方法简单,材料成本低,不需要特殊的试剂和设备,适于基层实验室使用[18].研究发现,对于相对洁净、悬浮物较少的水样,氯化钠-氯化铝沉淀法分离水样中的病毒,其回收率比起滑石粉-硅藻土浓缩法和阳电滤膜过滤法较高[13].膜吸附-洗脱法是利用病毒的胶体性质和蛋白质的特性,由于滤膜和含有病毒的水体相互独立,不需要在水相中产生新的固体相吸附病毒,因此,该方法相对于氯化钠-氯化铝沉淀法更具可操作性[6].本实验中的滤膜吸附法由 Haramoto等[15]改进.水样过膜前,用 A lCl3溶液过膜可增加病毒对膜的吸附;水样过膜后,用H2SO4(pH=3.0)淋洗滤膜可去除多价阳离子促进洗脱,从而提高病毒回收率;用 NaOH(pH=10.8)溶液代替牛肉浸膏作为洗脱液,可减少后续 cDNA合成和 PCR扩增中的抑制因子,从而增加病毒核酸检测的灵敏度.
采用本次实验的方法,在上海市的 3个污水处理厂的进水和出水水样中都检测到了脊髓灰质病毒核酸片段.该研究结果与以下研究相似:姬晓琴等[7]的研究结果显示在西安市石桥污水净化中心的二级处理水中肠道病毒的阳性检出率为 87.5%;程莉等在北方某市污水厂的进水和不同工艺水中斗检测到了轮状病毒的存在,病毒检出率为 100%.水体中病毒等病原微生物由于个体小抗性大,在自然环境中的生存能力比细菌强,常规水处理技术很难将其彻底消灭去除,因而常规的大肠杆菌生物检测指标不能反映水体中病毒污染的情况.值得一提的是,本实验中所用的 RT-nest-PCR方法具有快速、灵敏、特异性强的特点,尤其对于那些应用细胞培养法难于分离培养的病毒而言更具优势,能够满足水体病毒的检测要求.但是,该方法不能准确反映水样中所检测病毒的感染性,因此,在评价水体中病毒污染程度方面仍具有一定的局限性.
[1] 王子健,王东红.饮用水安全评价 [M].北京:化学工业出版社,2008:297-306.
[2] 仇付国,王晓昌.水环境中病毒的分布存活及其健康风险评价[J].西安建筑科技大学学报:自然科学版,2007,39(1):115-118.
[3] FRANCOIS G.World water actions:making water flow for all[C]∥Water Action Unit,Word Water Council.2003:125.
[4] 翁康生,陆晔,刘国星,等.水生生物学技术检测水中病毒[J].中国卫生检验杂志,2002,12(5):630-632.
[5] 陈小岳,田海林.水体肠道病毒的浓集及核酸检测方法的应用[J].职业与健康,2007,23(4):293-295.
[6] 张崇森,刘永军,王晓昌,等.环境水体中肠道病毒的膜吸附-洗脱-浓缩方法研究 [J].环境科学,2008,28(7):1543-1547.
[7] 徐凌云,赵文彬,刁连东,等.环境水中脊髓灰质炎病毒二年循环动态研究 [J].中国流行病学杂志,1996,17(4):236-238.
[8] 郑耀通,林奇英,谢联辉.闽江流域福州过境段水体病毒污染调查分析[J].中国环境检测,2004,20(5):39-43.
[9] 邵荣标,周步全,吴巨飞,等.水样中脊髓灰质病毒检测方法的实验研究[J].江苏预防医学,2005,16(3):1-4.
[10] 程莉,何晓青,李伟,等.北方某市城区水环境中轮状病毒的初步检测[J].生态毒理学报,2007,2(2):202-207.
[11] 张崇森,刘永军,王晓昌,等.环境水体中肠道病毒的膜吸附-洗脱-浓缩方法研究 [J].环境科学,2008,28(7):1543-1547.
[12] 姬晓琴,张崇森,刘永军.二级处理出水中肠道病毒的PCR检测研究 [J].江苏环境科技,2008,21(1):68-70.
[13] 赵淑敏,田勇琴,孟昭英,等.三种浓缩方法在水体病毒分离中的比较研究[J].环境与健康杂志,1996,13(3):120-122.
[14] 郭润霞,黄海云,冀玲,等.三氯化铝-氯化钠絮凝法浓缩水中肠道病毒[J].环境与健康杂志,1997,14(4):176-176.
[15] HARAMOTO E,KATAYAMA H,OHGAKI S.Detection of noroviruses in tap water in Japan by means of a new method for concentrating enteric viruses in large volumes of fresh water[J]. Applied and Environmental M icrobiology,2004,70(4):2154-2160.
[16] HARAMOTO E,KATAYAMA H,OGUMA K,et al.Application of Cation-coated filter method to detection of noroviruses,enteroviruses,adenoviruses,and Torque Teno viruses in the Tamagawa river in Japan[J].Applied and EnvironmentalM icrobiology,2005,71(5):2403-2411.
[17] 袁长青,叶建锋,李君文.改进的 PCR技术快速检测水中肠道病毒的研究[J].中国卫生检验杂志,2000,10(4):395-397.
[18] 吴楚,吴纵斌.水中病毒的检测方法研究[J].现代农业科学,2008,15(8):48-50.
(编辑:刘志强)
Application of Two M ethods for Concentrating Viruses and Detection of Polioviruses in Water Samples
YANGMing, SHEN Yang, XU Hai, WANG Kun-peng, WU M ing-hong
(School of Environmental and Chemical Engineering,ShanghaiUniversity,Shanghai200444,China)
X 17
A
1007-2861(2010)05-0465-06
10.3969/j.issn.1007-2861.2010.05.004
2010-07-12
国家自然科学基金资助项目 (40830744,40973073,40973072);上海高校选拔培养优秀青年教师科研专项基金资助项目(SHU08021);上海大学创新基金资助项目(A10011109006)
吴明红 (1968~),女,教授,博士生导师,研究方向为污染控制与环境毒理.E-mail:mhwu@staff.shu.edu.cn
