一种利用分泌型荧光素酶基因表达变化监测活细胞中miRNA活性的新方法
2010-10-16田文洪董小岩王刚吴小兵
田文洪,董小岩,王刚,吴小兵
1 中国疾病预防控制中心 病毒病预防控制所 病毒基因工程国家重点实验室,北京 100052 2 复旦大学生命科学学院 遗传学研究所 遗传工程国家重点实验室, 上海 200433 3 北京五加和分子医学研究所有限公司,北京 100176
一种利用分泌型荧光素酶基因表达变化监测活细胞中miRNA活性的新方法
田文洪1*,董小岩1,2,3*,王刚1,吴小兵1
1 中国疾病预防控制中心 病毒病预防控制所 病毒基因工程国家重点实验室,北京 100052 2 复旦大学生命科学学院 遗传学研究所 遗传工程国家重点实验室, 上海 200433 3 北京五加和分子医学研究所有限公司,北京 100176
建立了一种以分泌型的荧光素酶Gluc为报告基因的 miRNA传感器质粒(命名为 Gsensor)监测活细胞中miRNA(microRNA)活性的方法。首先构建了 pAAV2neo-Gluc-MCS-polyA质粒作为 Gsensor的空载体,同时其中的MCS位点可供插入miRNA的靶序列。以miR142-3p为检测对象,将1个和3个拷贝的与miR142-3p完全互补靶序列分别插入pAAV2neo-Gluc-MCS-polyA中,构建成miR142-3p Gsensor和miR142-3p Gsensor-3。将它们分别转染至U937细胞中,检测培养上清中Gluc的表达水平。结果显示二者均可有效反映 U937细胞中 miR 142-3p的抑制活性(分别与Gsensor空载体相比),提示Gsensor中采用一个拷贝的miRNA靶序列即可满足检测要求。并且miR142-3p Gsensor也能有效地反映出Anti-miR142对miR142-3p活性的抑制作用。随后,分析了时间、转染剂量对Gsensor检测结果的影响。结果表明,在U937细胞中miR142-3p Gsensor表现的miR142-3p活性在48 h后趋于稳定;Gsensor转染剂量在0.001~0.05 pg/cell范围内不影响其功能。最后,利用miR142-3p Gsensor 检测了HEK293、U937、K562、SP2/0和P815细胞内miR142-3p活性,结果发现miR142-3p活性在U937、K562、SP2/0和P815细胞中均较高,而在HEK293中几乎没有活性。用 QRT-PCR方法检测miR142-3p的相对拷贝数。结果表明,在HEK293、U937和 K562细胞中,miR142-3p活性与其相对拷贝数呈正相关。本研究表明Gsensor可作为一种有效的miRNA活性检测工具,为体外实时动态监测miRNA活性提供了一种新方法。
miRNA,miRNA活性,Gsensor,监测
Abstract:We developed a method for monitoring of miRNA activity in live cells by a secreted luciferase gene based plasmid sensor named as Gsensor.Firstly, we constructed pAAV2neo-Gluc-MCS-polyA as “empty Gsensor”, which contained multiple cloning sites(MCS)for miRNA target inserted.To detect miR142-3p activity, miR142-3p Gsensor and miR142-3p Gsensor-3 were constructed by inserting one or three complementary miR142-3p targets into pAAV2neo-Gluc-MCS-ployA.Subsequently,miR142-3p Gsensor and miR142-3p Gsensor-3 were respectively transfected into U937 cells and Gluc activity was assayed in the supernatant 48 h post transfection.Results showed that both of them effectively indicated miR142-3p activity of inhibiting Gluc expression compared with empty Gsensor.Simultaneously, miR142-3p Gsensor also demonstrated the inhibition of miR142-3p activity by Anti-miR142 when they were cotransfected into U937 cells.This implied one copy of miRNA target in Gsensor was sensitive enough for investigation of miRNA activity.We further analyzed factors affecting Gsensor function including time and dose, and found that miR142-3p activity sensed by miR142-3p Gsensor rose within 48 h post transfection and approached stable thereafter.Transfected dose varying among 0.001−0.05 pg/cell had little effect on its function.Using miR142-3p Gsensor, we further detected miR142-3p activity in HEK293, U937, K562, SP2/0 and P815 cells.Results suggested that miR142-3p activity was high in U937, K562, SP2/0 and P815 cells and almost negative in HEK293.miR142-3p activity was positively correlated with its relative copies in HEK293, U937 and K562 detected by QRT-PCR.In conclusion, Gsensor proved to be an effective tool for monitoring of miRNA activity in live cells, and provide a new method for monitoring miRNA activityin vitro.
Keywords:miRNA, miRNA activity, Gsensor, monitor
miRNA是生物体内源的长度为18~25个核苷酸的非编码RNA[1]。目前,在人类中已发现700多种miRNA[2]。在体内,miRNA与AGO等蛋白形成RISC(RNA Induced Silencing Complex),识别并结合mRNA 3′UTR的靶序列,导致mRNA的降解和翻译抑制,在转录后水平上对基因的表达进行负调控[3]。研究发现,miRNA参与人类大约1/3基因的表达调控[4],在细胞分裂[5]、分化[6]、死亡[7]、凋亡[8]和新陈代谢[9]以及干细胞的分化[10]、肿瘤的发生[11]等诸多生理病理过程中发挥重要作用。
目前已经有许多检测miRNA表达水平的方法,包括Northern blotting、QRT-PCR、原位杂交、RAKE(RNA-primed array-based Klenow enzyme assay)和miRNA标记法(Ambion)[12]。然而,这些方法均不能检测miRNA的活性,并且操作繁琐。虽然现有的以Fluc(Firefly Luciferase)为报告基因的miRNA传感器可有效地检测miRNA活性,但是由于Fluc不能分泌,每次检测均需裂解细胞,因此该传感器不能方便地应用于 miRNA活性的连续监测。Gluc(GaussiaLuciferase)来源于海洋桡脚类动物Gaussia princeps,具有易分泌、检测灵敏度高、反应不依赖于 ATP等特点[13-14]。本研究拟利用 Gluc的这些特点构建一种以Gluc为报告基因的 miRNA活性检测传感器miRNA Gsensor。将miRNA Gsensor和Gsensor空载体(Empty Gsensor)分别转染细胞,检测细胞培养上清中的Gluc活性差异。利用miRNA抑制基因表达原理,推测检测细胞内miRNA活性。
1 材料与方法
1.1 质粒、菌株和细胞
pGluc-Basic质粒购自NEB公司;pAAV2neo、pAAV2neo-Fluc和携带 3个 miR142-3p靶序列的pAAV2neo-tri142T质粒由本室构建保存;Max Efficiency DH5аTM为 Invitrogen公司产品;HEK293、U937、K562、P815和SP2/0细胞购自ATCC,由本室保存,用含10%胎牛血清的DMEM培养液培养。
1.2 试剂
限制酶和连接酶购自NEB公司;质粒大提试剂盒购自Qiagen公司;DMEM培养基、胎牛血清和脂质体lipofectamineTM2000均为Invitrogen公司产品;Gaussialuciferase assay kit购自 NEB 公司;Luciferase assay system购自Promega公司。
1.3 Gsensor的构建
按照标准的分子克隆方法构建Gsensor空载体:pAAV2neo-Gluc-MCS-polyA。首先根据pGluc-Basic序列设计引物。上游引物:5′-TTAGGTACC CCAGC CACCATGGGAGTC-3′,下游引物:5′-TGCCGAATT CCTCGAGCGGCCGCTTAGT-3′,下划线标记处为酶切位点,上游引物酶切位点为KpnI,下游为EcoR I,用于将 PCR产物克隆入 pAAV2neo载体。引物由Invitrogen公司合成。然后,以pGluc-Basic为模板,PCR扩增得到含Gluc目的片段,插入pAAV2neo载体,获得 Gsensor空载体,酶切测序鉴定。设计并由Invitrogen公司合成2条寡聚核苷酸:5′-AATTC TCCATAAAGTAGGAAACACTACA-3′和 5′-GATCT GTAGTGTTTCCTACTTTATGGAG-3′,下划线标记处分别为 miR142-3p序列和与其完全互补的靶序列,于95℃ 10 min,室温放置2 h退火后,形成包含EcoR I、BglII粘性末端和miR142-3p靶序列的接头,插入Gsensor空载体,获得pAAV2neo-Gluc-142T,命名为 miR142-3p Gsensor,测序鉴定。将含有Gluc片段的PCR产物插入pAAV2neo-tri142T载体,获得 pAAV2neo-Gluc-tri142T,命名为 miR142-3p Gsensor-3,酶切测序鉴定。
1.4 转染
用100 μL含10% FBS的DMEM培养液将细胞接种于96孔细胞培养板,立即进行转染实验。参照说明书用lipofectamineTM2 000将empty Gsensor、miR142-3p Gsensor或miR142-3p Gsensor-3分别转染至细胞中。每孔具体转染过程为:DNA加入25 μL OPTI-MEM培养液,0.25 μL lipofectamineTM2 000加入25 μL OPTI-MEM培养液,分别混匀,于室温放置5 min。然后将2种液体混匀,于室温放置20 min后,加入细胞中,并前后摇晃96孔细胞培养板使液体混匀,于37℃的5% CO2孵箱中培养。
为了进一步验证Gsensor的功能,empty Gsensor或miR142-3p Gsensor与Anti-miR142共转染U937细胞,并同时转染pAAV2neo-Fluc质粒作为内参,校正转染效率。具体过程为:U937细胞接种于 96孔细胞培养板(1×104cells/孔),empty Gsensor 或miR142-3p Gsensor、pAAV2neo-Fluc各 50 ng和0~15 pmol Anti-miR142 加入 25 μL OPTI-MEM 培养液,0.75 μL lipofectamineTM2 000 加入 25 μL OPTI-MEM培养液,分别混匀,于室温放置5 min。然后将2种液体混匀,于室温放置20 min后,加入细胞中,并前后摇晃96孔细胞培养板使液体混匀,于37℃的5% CO2孵箱中培养。
1.5 荧光素酶活性测定
1.5.1 Gluc活性测定
转染不同时间点后,每孔取20 μL细胞培养上清,加入Gaussialuciferase assay kit中的底物 50 μL,用发光检测仪(ModulusTMLuminometer)测定其相对光强度单位(Relative light unit,RLU),每次测定收集光子10 s。
1.5.2 Fluc活性测定
参照luciferase assay system(Promega)说明书制备细胞裂解液,每孔取20 μL细胞裂解液,加入luciferase assay system(Promega)中的底物 100 μL,并按照Gluc活性测定方法检测发光强度。
1.6 QRT-PCR测定miR142-3p相对拷贝数
按照说明书,用 Trizol试剂(Invitrogen)提取细胞内总RNA。用BioPhotometer plus(Eppendorf)测定提取RNA浓度。参照TaqMan MicroRNA Assay(Ambion)说明书,在96孔板中,加入0.6 μg总RNA于15 μL反应体系中,放入Applied Biosystems 9 700 Thermocycler中,按程序(16℃ 30 min,42℃ 30 min,85℃ 5 min)进行逆转录过程。然后,应用Applied Biosystems 7900HT fast real-time PCR system进行Real-time PCR 过程。具体为:根据TaqMan MicroRNA Assay说明书,在96孔板中加入1.33 μL逆转录产物于20 μL反应体系中,按以下过程扩增:95 ℃ 1 0 min ;95℃ 15 s,60℃ 1 min,40个循环。所有反应均重复4次。
1.7 统计分析
利用单因素方差分析(One-way ANOVA)处理数据,当P<0.05时,具有显著性差异。
2 结果
2.1 U937细胞中miR142-3p活性
Gluc基因分别插入 pAAV2neo、pAAV2neotri142T载体,获得 empty G-sensor和 miR142-3p Gsensor-3(图1A,C)。将单个拷贝的完全互补的miR142-3p靶序列克隆入empty Gsensor的EcoR I和BglII之间,获得 miR142-3p Gsensor(图1B)。为了验证 Gsensor的有效性,empty Gsensor、miR142-3p Gsensor和miR142-3p Gsensor-3分别转染 U937细胞。转染48 h后,测定细胞培养上清中Gluc活性,结果如图2A所示,转染 miR142-3p Gsensor和miR142-3p Gsensor-3的细胞培养上清中Gluc活性明显低于 empty Gsensor(P<0.01);虽然转染miR142-3p Gsensor 的细胞培养上清中Gluc活性高于miR142-3p Gsensor -3,但两者之间并无显著性差异(P=0.21345>0.05)。这表明Gsensor中包含单拷贝miRNA靶序列就可有效地指示细胞内miRNA活性。由于插入单拷贝miRNA靶序列在载体构建上的简便性,因此选择其作为后续细胞内miR142-3p活性检测的工具。

图1 Gsensor结构示意图Fig.1 Schematic map of Gsensors.ITR: AAV2 inverted terminal repeat; CMV: cytomegalovirus promoter;Gluc:Gaussialuciferase; BGH: bovine growth hormone polyA signal.miR142T: miR142-3p target sequence.(A)Schematic map of empty Gsensor.(B)Schematic of miR142-3p Gsensor.(C)Schematic map of miR142-3p Gsensor-3.
为了进一步验证 Gsensor的有效性,empty Gsensor或 miR142-3p Gsensor与Anti-miR142共转染 U937细胞,并同时转染 pAAV2neo-Fluc以校正转染效率。转染24 h后,测定细胞培养上清中Gluc活性,并用Fluc活性校正转染效率差异,比较empty Gsensor和 miR142-3p Gsensor 表达Gluc差异,换算成相对荧光素酶水平(Relative luciferase level,RLL),即 miR142-3p Gsensor表达 Gluc占 empty Gsensor表达Gluc的百分比。结果见图2B,RLL随着转染Anti-miR142浓度的增加而升高。
2.2 Gsensor功能影响因素分析
为了分析时间对 Gsensor作用的影响,等量的empty Gsensor和miR142-3p Gsensor分别转染U937细胞,转染后不同时间点测定细胞培养上清中Gluc活性,并换算成 RLL。结果如图3A所示,转染后RLL逐渐开始下降,直到48 h趋于平稳。
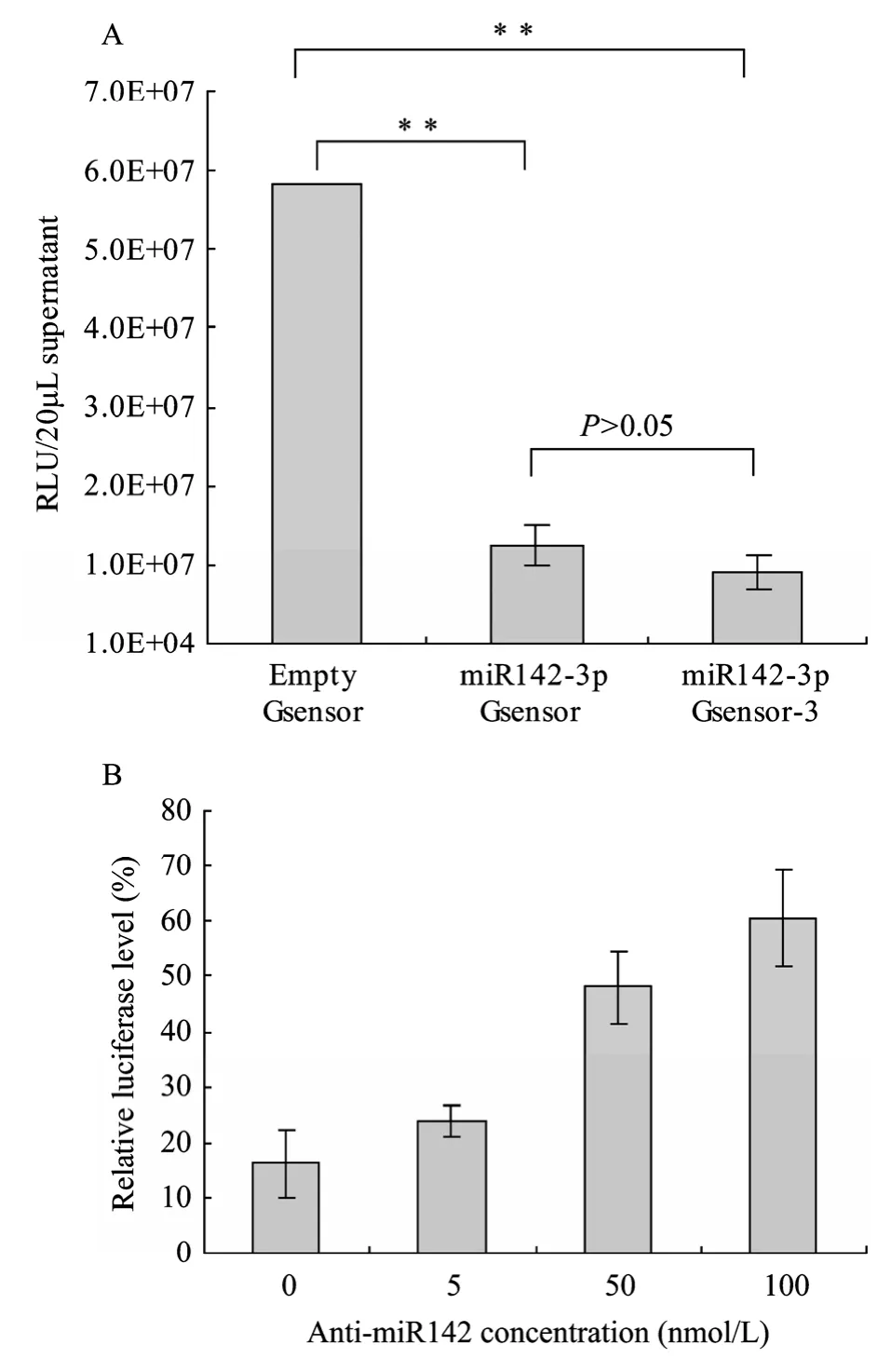
图2 Gsensor功能验证Fig.2 Validation of Gsensor.(A)Indicating miR142-3p activity by miR142-3p Gsensor and miR142-3p Gsensor-3 in U937 cells.Results were shown with±s.Data was analyzed using one-way ANOVA.RLU, relative light unit.**,P<0.01.(B)Enhancing miR142-3p activity by Anti-miR142.Differences in transfection efficiency were normalized using Fluc activity.Relative luciferase level=SGluc/CGluc.Gluc, Gluc activity.S, cells transfected with miR142-3p Gsensor.C, cells transfected with empty Gsensor.Results were represented with±s.
为了分析转染剂量对 Gsensor功能的影响,首先保持转染细胞数量不变,将不同剂量(0.01、0.1、0.2 μg/孔)的 empty Gsensor和 miR142-3p Gsensor转染U937细胞。转染48 h后测定细胞培养上清中Gluc活性(图3B),同时换算成RLL(图3C),单因素方差分析发现不同剂量组间未见统计学差异(P=0.2883)。然后固定每孔转染的Gsensor剂量(0.1 μg/孔),变化转染的U937细胞数量(2 000~100 000/孔)。同样转染48 h后检测细胞培养上清中Gluc活性(图3D),换算成图3E表示的RLL值,单因素方差分析发现不同数量细胞组间(2 000~20 000/孔)没有统计学差异(P=0.1567)。

图3 Gsensor功能影响因素分析Fig.3 Factors affect miRNA Gsensor.(A)miR142-3p activity variation with time in U937 cells.Relative luciferase level was represented with±s.(B)Gluc activity in the supernatant of U937 cells transfected with different doses of DNA.Results were represented with±s.RLU, relative light unit.(C)Relationship between relative luciferase level and DNA doses transfected.(D)Gluc activity in the supernatant of U937 cells with different cell number.Results were represented with±s.(E)Relationship between relative luciferase level and cell number.
2.3 Gsensor测定不同细胞miR142-3p活性
利用已建立的 Gsensor方法,本研究检测了HEK293、U937、K562、P815和 SP2/0细胞中的miR142-3p活性。细胞培养上清中的Gluc活性如图4A所示,RLL值如图4B所示。从图4B的结果可知,HEK293细胞的RLL值大约为100%,表明该细胞内未检测到miR142-3p活性,但K562、U937、P815和 SP2/0的 RLL值均小于 20%,提示miR142-3p活性较高。

图4 HEK293、U937、K562、P815和 SP2/0细胞中miR142-3p活性测定Fig.4 miR142-3p activity in HEK293, U937, K562, P815 and SP2/0 cells.(A)Gluc activity varied in the supernatant of HEK293, U937, K562, P815 and SP2/0 cells.Results were represented with±s.(B)Relative luciferase level in HEK293,U937, K562, P815 and SP2/0 cells.Relative luciferase level=SGluc/CGluc.Gluc:Gaussialuciferase activity; S: cells transfected with miR142-3p Gsensor; C: cells transfected with empty Gsensor.Results were represented with±s.
2.4 miR142-3p拷贝数与其活性的关系
为了分析miRNA拷贝数与其活性之间的关系,应用TaqMan MicroRNA Assay(Ambion)系统,检测了 HEK293、U937和K562细胞中miR142-3p的相对拷贝数。由图5的结果可知,miR142-3p在细胞中的相对拷贝数为:K562>U937>HEK293,与细胞内的miR142-3p活性一致。
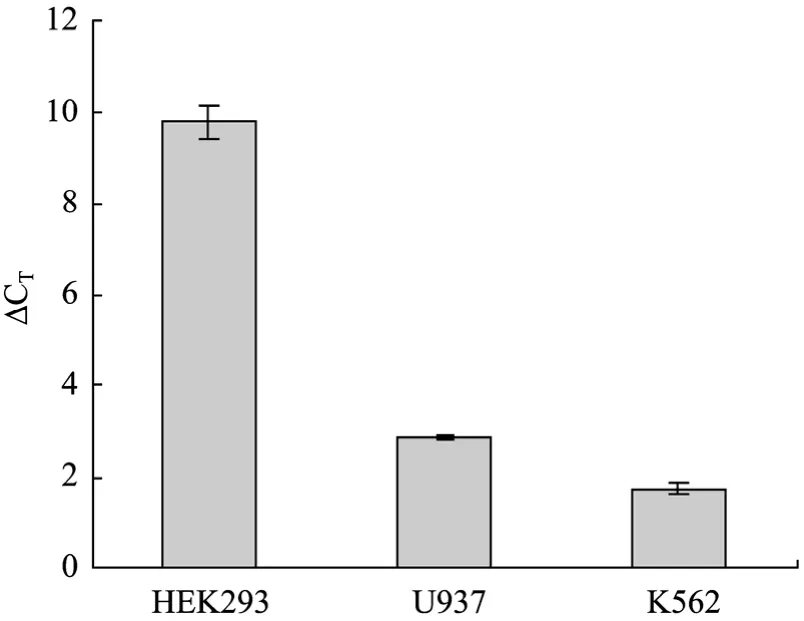
图5 HEK293、U937和K562细胞中miR142-3p相对拷贝数测定Fig.5 Relative copies of miR142-3p in HEK293, U937 and K562 cells.Relative copy number was assayed using QRT-PCR(Ambion).∆CT=CT-miR142-3p−CT-EC.CT-miR142-3p: CTvalue of miR142-3p; EC: endogenous control and U6B selected as endogenous control in this assay; CT-EC: CTvalue of EC.
3 讨论
实时动态地监测细胞内 miRNA活性变化有助于认识miRNA参与调节体内生理病理过程的机制。遗憾的是,现有 Northern blotting和 QRT-PCR等miRNA检测技术只能检测miRNA表达水平不能检测miRNA活性。而且,需要裂解细胞和提取RNA,操作过程繁琐、费时。本研究描述了一种利用Gsensor灵敏、简便和无创伤检测细胞内miRNA活性的方法,使实时动态监测细胞内miRNA活性成为可能。
本研究通过计算转染miRNA Gsensor的细胞中的Gluc活性与转染empty Gsensor的Gluc活性的比值(RLL值)来表示细胞内的 miRNA活性。由于Gluc分泌性好,不用裂解细胞直接取细胞培养上清即可检测细胞内Gluc表达情况,催化反应不依赖于ATP,因此相比于Fluc(Firefly luciferase),Gluc表达检测更加简单、方便和快捷。同时不用裂解细胞,可以长期持续地检测相同细胞的Gluc表达,使实时动态监测miRNA活性成为可能。
本研究中,基于miRNA调节基因表达的机制,构建了以Gluc为报告基因的携带单个和 3个拷贝miR142-3p完全互补靶序列的miR142-3p Gsensor和miR142-3p Gsensor-3(图1B、1C),同时构建不携带miRNA 靶序列的 empty Gsensor(图1A)。选用miR142-3p活性较高的造血干细胞系来源细胞株U937[15-16],验证 miR142-3p Gsensor和 miR142-3p Gsensor-3的功能,发现这两种Gsensor均可有效地指示 U937细胞内 miR142-3p活性,且两者之间无统计学上差异(图2A)。应用miR142-3p Gsensor检测了Anti-miR142对U937细胞内mR142-3p活性的抑制作用,采用RLL值表示细胞内的miRNA活性,结果表明 miR142-3p Gsensor有效地揭示了Anti-miR142的抑制作用。这表明Gsensor中插入某种miRNA的单拷贝的靶序列已经能够用于miRNA活性检测。为了更好地模拟体内一个基因通常只携带单个拷贝某种 miRNA靶序列的情况,以及考虑Gsensor构建的简便性,选择miR142-3p Gsensor进行其余实验。
Gsensor连续96 h监测U937细胞内miR142-3p活性,结果发现 Gsensor所指示的 miR142-3p活性随时间逐渐增加,48 h后达到峰值并保持不变(图3A)。这可能是由于miRNA形成RISC并识别其靶序列,从而抑制基因表达是一个过程,导致miRNA的抑制作用滞后于基因表达,但随着时间的延长,miRNA的抑制作用与基因表达达到动态平衡,因此Gsensor表现出的miRNA活性趋于平稳。提示选择合适的检测时间点,有助于真实地反映细胞内miRNA活性。因此,本研究选择转染后48 h测定细胞中的miRNA活性。另外,本研究结果表明,转染剂量在 0.001~0.05 pg/cell范围内变化时,不影响Gsensor的功能,降低了转染操作时对剂量的限制,方便了操作过程。
质粒对某些细胞转染效率低,可能成为质粒型miRNA传感器应用的障碍。但在本研究中,Gsensor对不易转染的悬浮细胞 SP2/0细胞也能灵敏地反映出细胞内的miR142-3p活性,分析原因可能有以下2点:首先,Gluc检测灵敏度高,分别是Fluc的100倍[13],SEAP(secreted alkaline phosphatase)的 1 000倍[17];其次,由于 Gluc活性可在 37℃细胞培养液中稳定保持48 h[14],因此Gluc在细胞培养液中的积累可显著提高Gsensor的灵敏度。
此外,本研究还应用miR142-3p Gsensor测定了HEK293、U937、K562、P815和 SP2/0中 miR142-3p活性。结果表明,在造血干细胞系来源的U937、K562、P815和SP2/0细胞中miR142-3p活性较高,在非造血干细胞来源的HEK293细胞中miR142-3p活性则几乎测不到。这提示miR142-3p在造血干细胞系中具有一定的保守性,可能在造血干细胞系的发育中发挥重要作用。而且miR142-3p活性与其相对拷贝数呈正相关。这也说明在细胞生长适宜的条件下,miRNA活性与其拷贝数呈现相似的变化规律。
总之,本研究提出了一种基于Gsensor的简单、方便和非创伤的miRNA活性检测方法,可实时动态检测细胞内miRNA活性,为miRNA的活性检测提供了新的选择工具。
REFERENCES
[1]Bartel DP.MiRNAs: genomics, biogenesis, mechanism,and function.Cell, 2004, 116(2): 281–297.
[2]Griffiths-Jones S.The microRNA registry,Nucl Acids Res,2004, 32: D109–D111.
[3]Doench JG, Sharp PA.Specificity of microRNA target selection in translation repression.Genes Dev, 2004, 18(5): 504–511.
[4]Lewis BP, Burge CB, Bartel DP.Conserved seed pairing,often flanked by adenosines, indicates that thousands of human genes are microRNA targets.Cell, 2005, 120(1):15–20.
[5]Careton M, Cleary MA, Linsley PS.MicroRNAs and cell cycle regulation.Cell Cycle, 2007, 6(17): 2127–2132.
[6]Iovino N, Pane A, Gaul U.miR-184 has multiple roles inDrosophilafemale germline development.Dev Cell, 2009,17(1)123–133.
[7]Ambros V.MicroRNA pathways in flies and worms:growth, death, fat, stress, and timing.Cell, 2003, 113(6):673–676.
[8]Jovanovic M, Henqartner MO.miRNAs and apoptosis:RNAs to die for.Oncogene, 2007, 25(46): 6176–6187.
[9]Dang CV, Le A, Gao P.MYC-induced cancer cell energy metabolism and therapeutic opportunities.Clin Cancer Res, 2009, 15(21): 6479–6483.
[10]Xu N, Papagiannakopoulos T, Pan GJ,et al.MicroRNA-145 regulates OCT4, SOX2, and KLF4 and represses pluripotency in human embryonic stem cells.Cell, 2009, 137(4): 647–658.
[11]Schichel R, Boyerinas B, Park SM,et al.MicroRNAs: key players in the immune system, differentiation,tumorigenesis and cell death.Oncogene, 2008, 27(45):5959–5974.
[12]Lu J, Tsourkas A.Imaging individual microRNAs in single mammalian cellsin situ.Nucleic Acids Res, 2009,37(14): e100.
[13]Tannous BA, Kim DE, Fernandez JL,et al.Codon-optimizedGaussialuciferase cDNA for mammalian gene expression in culture andin vivo.Mol Ther, 2005, 11(3): 435–443.
[14]Wurdinger T, Badr C, Pike L,et al.A secreted luciferase forex vivomonitoring ofin vivoprocesses.Nat Methods,2008, 5(2): 171–173.
[15]Chen CZ, Li L, Lodish HF,et al.MicroRNAs modulate hematopoietic lineage differentiation.Science, 2004,303(5654): 83–86.
[16]Brown BD, Venneri MA, Zingale A,et al.microRNA regulation suppresses transgene expression in hematopoietic lineages and enables stable gene transfer.Nat Med, 2006, 12(5): 585–591.
[17]Tannous BA.Gaussialuciferase reporter assay for monitoring biological processes in culture andin vivo.Nat Protoc, 2009, 4(4): 582–591.
A novel method for monitoring miRNA activity by expression changes of secreted luciferase gene in live cells
Wenhong Tian1*, Xiaoyan Dong1,2,3*, Gang Wang1, and Xiaobing Wu1
1 State Key Laboratory for Molecular Virology and Genetic Engineering, Institute for Viral Disease Prevention and Control, Chinese Center for Disease Prevention and Control, Beijing 100052, China 2 State Key Laboratory of Genetic Engineering, Institute of Genetics, School of Life Science, Fudan University, Shanghai 200433, China 3 Beijing Fiveplus Molecular Medicine Institute, Beijing 100176, China
Received:January 28, 2010;Accepted:March 26, 2010
Supported by:Special Key Program on Infectious Diseases of China(No.2008ZX10002-023).
Corresponding author:Xiaobing Wu.Tel: +86-10-63523187; Fax: +86-10-63532053; E-mail: wuxb0168@vip.sina.com*These authors contributed equally to this study.传染病重大专项(No.2008ZX10002-023)资助。
