苦黄口服液质量标准研究
2010-10-16王恒斌韦英杰阙瑞艳荆海英曾陵
王恒斌,韦英杰,阙瑞艳,荆海英,曾陵
(1.常熟雷允上制药有限公司,江苏 常熟 215500;2.江苏省中医药研究院,江苏 南京 210028)
苦黄口服液质量标准研究
王恒斌1*,韦英杰2,阙瑞艳1,荆海英1,曾陵1
(1.常熟雷允上制药有限公司,江苏 常熟 215500;2.江苏省中医药研究院,江苏 南京 210028)
目的:建立苦黄口服液的质量标准。方法:用薄层色谱法对制剂中的苦参、大黄、大青叶进行定性鉴别;采用HPLC测定苦参中的苦参碱含量。结果:薄层色谱斑点清晰,阴性样品无干扰;苦参碱在0.193 6~7.744 0μg具有良好的线性关系,r=1.000 0,加样回收率为101.1%(n=6),RSD=2.87%。结论:该方法简便、精确、重现性好,可以很好地确保产品质量。
苦黄口服液;薄层鉴别;含量测定
苦黄口服液是常熟雷允上制药有限公司正在研制的药品,由大黄、苦参、大青叶等5味中药组成。临床用于因湿热内蕴引起的黄疸型病毒性肝炎患者的退黄。为了控制该制剂质量,保障患者的用药安全,我们用薄层色谱法对制剂中的苦参、大黄、大青叶进行了定性鉴别;采用HPLC对苦参中的苦参碱含量进行了测定。
1 仪器与试药
1.1 仪器
Agilent1100高效液相色谱仪,自动进样系统;HUV2-3A紫外分析仪(广州市产品质量监督检验所产品技术开发公司)。
1.2 试药
甲醇为色谱醇,三氯甲烷、丙酮、甲酸乙酯等均为分析纯,薄层板(青岛海洋化工厂)。苦参碱对照品(批号110805-200507)、大黄素对照品(批号110756-200110)、靛蓝对照品(批号110716-200509)、大黄对照药材(掌叶大黄,批号121249-200402)(中国药品生物制品检定所),苦黄口服液(常熟雷允上制药有限公司生产的中试样品,批号KH090113,KH090122,KH090226)。分别缺苦参和大黄的苦黄口服液阴性对照品(常熟雷允上制药有限公司)。苦参购自山东青州,大黄购自甘肃陇西,经常熟雷允上制药有限公司荆海英主管中药师鉴定为正品。
2 方法与结果
2.1 鉴别
2.1.1 苦参鉴别 取本品5mL,加浓氨试液2mL,充分摇匀,加三氯甲烷2次,每次15mL,合并提取液,水浴蒸干,残渣加无水乙醇1mL使溶解,作为供试品溶液。另取苦参碱对照品,加无水乙醇制成每1mL含1mg的溶液,作为对照品溶液。按苦黄口服液工艺分别制备缺失苦参药材的阴性样品,同时制备苦参药材提取液作为阳性样品,参照供试品溶液的制备方法制备苦参阴性对照溶液和苦参阳性对照溶液。照薄层色谱法(《中国药典》2005年版一部附录ⅥB)试验,吸取上述供试品溶液2μL及上述对照品溶液10μL,分别点于同一以羧甲基纤维素钠为粘合剂的硅胶G薄层板上,以丙酮-乙醚-醋酸乙酯-浓氨液(4∶3∶1∶0.1)为展开剂,展开,取出,晾干,喷以改良碘化铋钾试液。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。阴性试验表明,对所测成分无干扰,见图1。
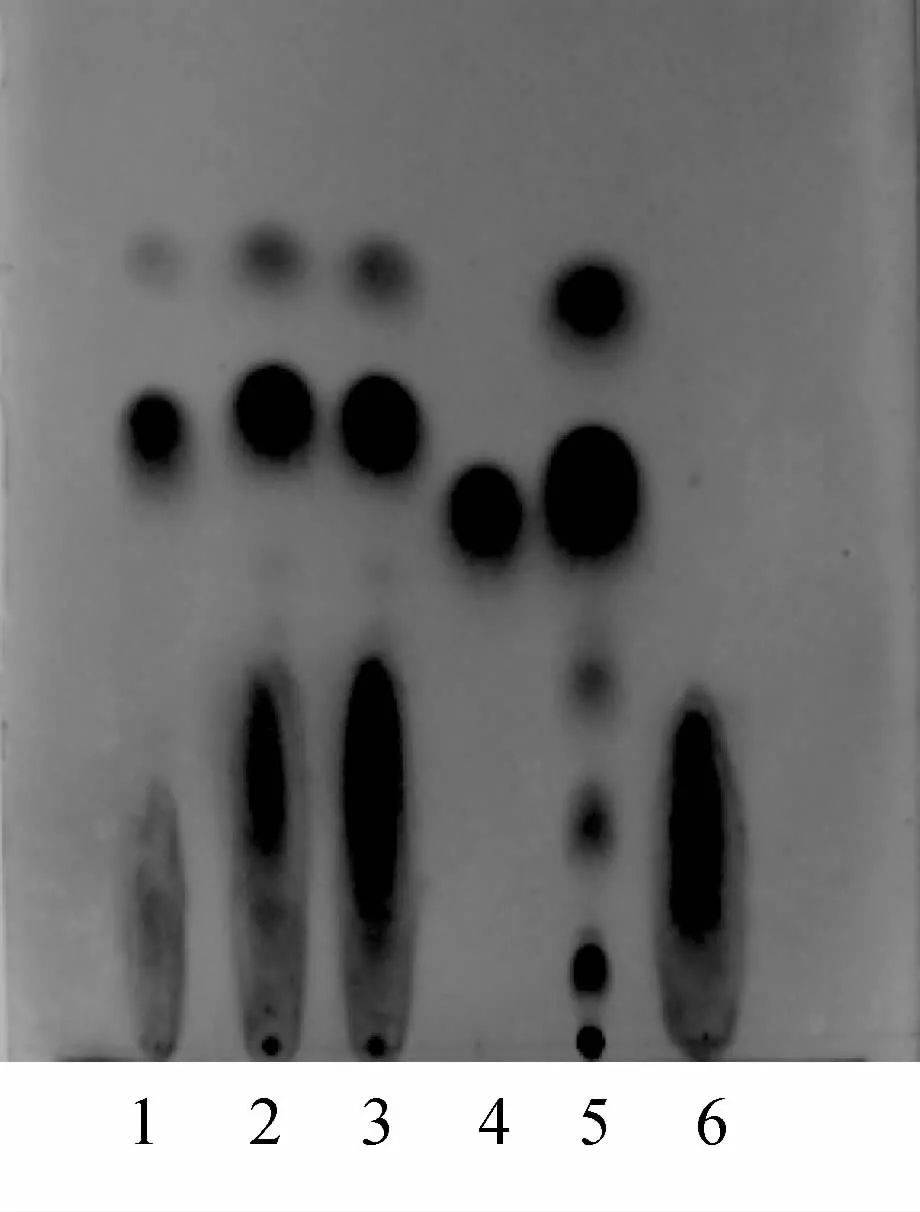
图1 苦参TLC图
2.1.2 大黄鉴别 取本品3.5mL,加水20mL,摇匀,加混合酸[冰醋酸-盐酸(5∶1)]8mL和三氯甲烷50mL,置水浴上加热回流1h,放冷,分取三氯甲烷液,蒸干,残渣加三氯甲烷1mL,使溶解,作为供试品溶液。另取大黄对照药材0.2g,加甲醇20mL,浸泡1h,滤过,取滤液5mL,蒸干,残渣加水10mL使溶解,再加盐酸1mL,加热回流30min,立即冷却,用三氯甲烷分2次振摇提取,每次20mL,合并三氯甲烷液,蒸干,残渣加三氯甲烷1mL使溶解,作为对照药材溶液。再取大黄素对照品,加甲醇制成每1mL含0.1mg的溶液,作为对照品溶液。按苦黄口服液工艺分别制备缺失大黄药材的阴性样品,同时制备大黄药材提取液作为阳性样品,参照供试品溶液的制备方法制备大黄阴性对照溶液和大黄阳性对照溶液。照薄层色谱法(《中国药典》2005年版一部附录ⅥB)试验,吸取上述供试品溶液和大黄对照药材各4μL及上述对照溶液10μL,分别点于同一以羧甲基纤维素钠为粘合剂的硅胶G薄层板上,以石油醚(30~60℃)-甲酸乙酯-甲酸(15∶5∶1)的上层溶液为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。供试品色谱中,在与对照品和对照药材溶液色谱相应的位置上,显相同的橙黄色荧光斑点;置氨蒸气中熏后,日光下检视,斑点变为红色。阴性试验表明,对所测成分无干扰。见图2~3。

图2 大黄TLC图(荧光)
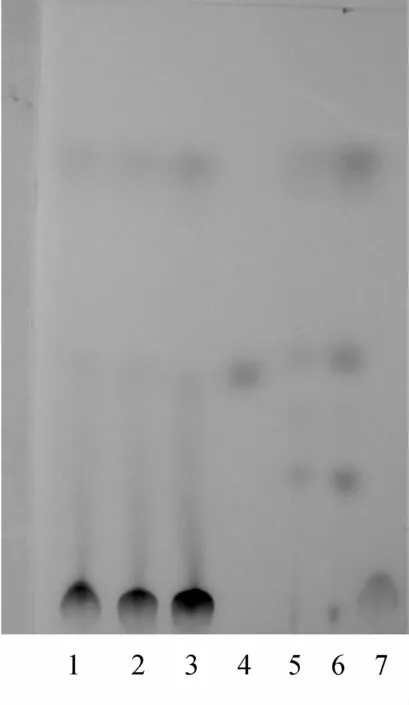
图3 大黄TLC图(氨气显色)
2.1.3 大青叶鉴别 取靛蓝对照品,加三氯甲烷制成每1mL含1mg的溶液,作为对照品溶液。按苦黄口服液工艺分别制备缺失大青叶药材的阴性样品,同时制备大青叶药材提取液作为阳性样品,参照[2.1.2]项下供试品溶液的制备方法制备大青叶阴性对照品溶液和大青叶阳性对照品溶液。照薄层色谱法(《中国药典》2005年版一部附录ⅥB)试验,直接吸取[2.1.2]项下的供试品溶液50μL作为大青叶鉴别的供试品溶液,同时吸取上述对照溶液50μL、靛蓝对照品溶液5μL,分别点于同一以羧甲基纤维素钠为粘合剂的硅胶G薄层板上,以苯-三氯甲烷-丙酮(5∶4∶1)为展开剂,展开,取出,晾干。供试品色谱中,在与对照品色谱相应位置上,显相同的蓝色斑点。阴性试验表明,对所测成分无干扰。见图4。

图4 大青叶TLC图
2.2 苦参碱含量测定
2.2.1 色谱条件与系统适用性试验 以十八烷基硅烷键合硅胶为填充剂(适用pH 1.5~11.5)。Agilent Zorbax C18Extend(5μm,250mm×4.6mm);以甲醇-0.1%氨水溶液(48∶52)为流动相;流速:1mL·min-1;柱温:40℃,进样量:10μL,检测波长:220nm。理论板数按苦参碱峰计算应不得低于3 000。
2.2.2 溶液的制备 对照品溶液制备:精密称取苦参碱对照品适量,加50%甲醇溶解,制成每1mL含苦参碱0.2mg的溶液,作为对照品溶液。
供试品溶液制备:取本品1mL,置10mL容量瓶中,加50%甲醇稀释至刻度,摇匀,作为供试品溶液。
缺苦参阴性对照品溶液制备:取缺失苦参药材的阴性样品1mL,按上述供试品溶液制法制备苦参阴性对照品溶液。
2.2.3 专属性试验 分别精密吸取对照品溶液、供试品溶液、阴性对照品溶液各10μL注入液相色谱仪,记录色谱图,结果表明阴性样品对所测成分无干扰。见图5~7。
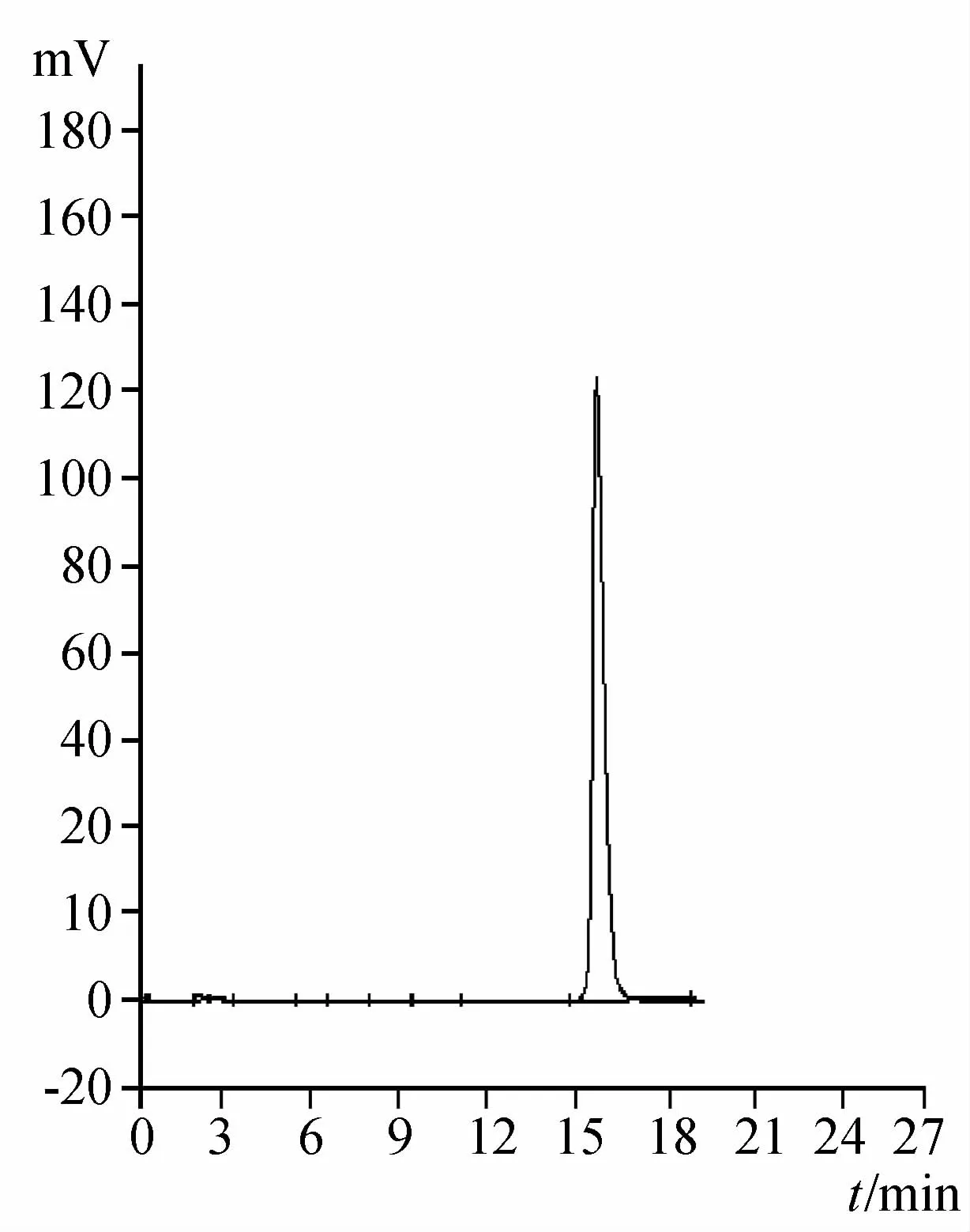
图5 苦参碱对照HPLC图
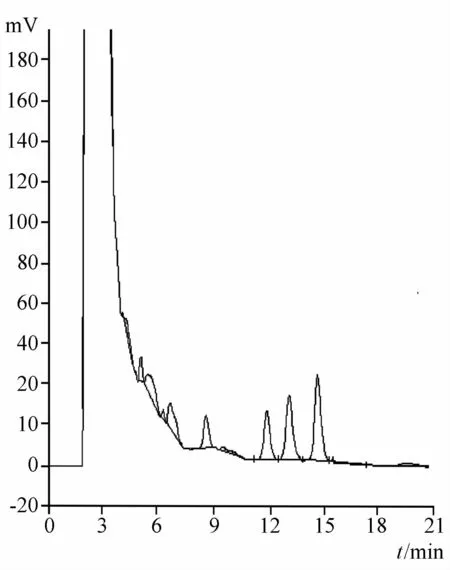
图6 缺苦参的阴性对照品HPLC图
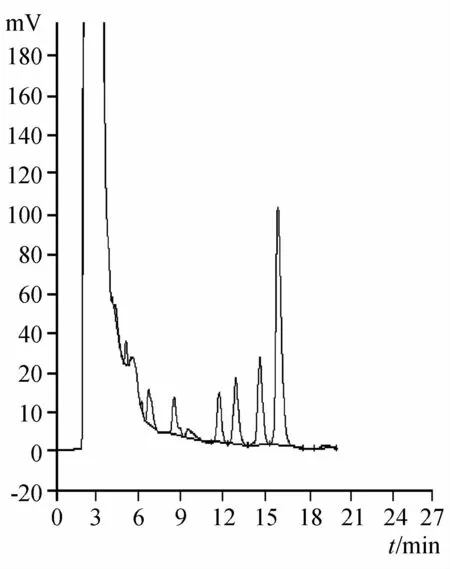
图7 苦黄口服液样品HPLC图
2.2.4 线性关系考察 分别吸取浓度为0.387 2,0.193 6,0.019 36,0.001 936,0.000 193 6 mg·mL-1的苦参碱对照品溶液注入液相色谱仪,结果苦参碱的回归方程为A=1 049.95C-12.356,r=1.000 0;线性范围为0.193 6~7.744 0μg。
2.2.5 精密度试验 精密称取同一批号苦黄口服液(KH090113)待测样品1份,按2.2.2项下制备供试品溶液,重复进样6次记录峰面积,结果RSD=1.53%,表明方法精密度良好。
2.2.6 重现性试验 精密称取同一批号苦黄口服液(KH090113)样品6份,按2.2.1.2项下制备供试品溶液,分别测定苦参碱含量,结果RSD=0.81%,表明方法重现性良好。
2.2.7 稳定性试验 精密称取同一批号苦黄口服液(KH090113)待测样品1份,按2.2.1.2项下制备供试品溶液,分别在0,4,6,8,12,18,24,48h测定,记录峰面积,峰面积RSD=1.08%,符合规定,表明样品48h内稳定。
2.2.8 加样回收率试验 精密量取已知含量的苦黄口服液(KH090113批,苦参碱的含量为2.412mg·mL-1)0.5mL置10mL量瓶中,按约1∶1的比例精密加入苦参碱对照品,加50%甲醇定容至10mL,摇匀,过滤,精密量取续滤液进样10μL进行色谱分析,测定峰面积,计算回收率,结果见表1。
2.2.9 样品含量测定 通过以上方法学的考察,证明苦参碱含量测定方法稳定可靠。并按上述方法对KH090113,KH090122,KH090226 3批样品进行测定,结果平均含量分别为24.12,22.02,21.61mg/支。
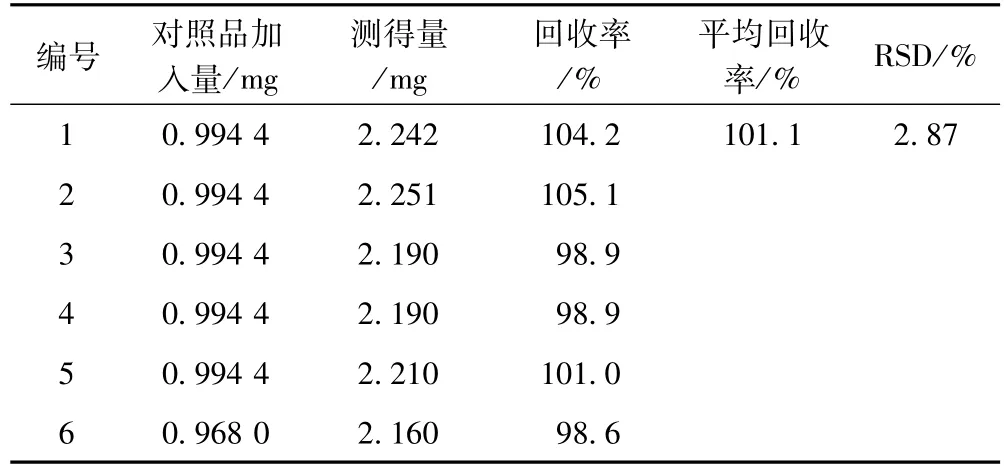
表1 苦参碱回收率试验
3 讨论
本文曾采用甲醇-0.02%三乙胺水溶液(48∶52),甲醇-水(0.03%氨水)(52.5∶47.5)为流动相,结果苦参碱分离效果不好,理论塔板数不符合要求,后经多次摸索,改用甲醇-0.1%氨水溶液(48∶52)为流动相,分离效果改善明显[1-3]。故列入苦黄口服液质量标准中。
本文建立的定性、定量方法,能够很好地控制苦黄口服液的质量。
[1]国家药典委员会.中国药典(一部)[S].北京:化学工业出版社,2005:141.
[2]徐宏峰,黄超,陈科力,等.高效液相色谱法测定青柏洁身洗液苦参碱含量[J].医药导报,2009,28(11):1501-1502.
[3]薛瑞,常博扬,狄天云,等.HPLC法不同色谱柱测定苦参碱含量的比较分析[J].宁夏医学杂志,2006,28(7):518-519.
Quality Control of Kuhuang Oral Liquid
Wang Hengbin,Wei Yingjie,Que Ruiyan,Jing Haiying,Zeng Ling
(1.Changshu Leiyunshang Pharmaceutical Co.,Ltd.,Changshu Jiangsu215500,China;2.Jiangsu Provincial Institute of Traditional Chinese Medicine,Nanjing Jiangsu210028,China)
Objective:To establish the quality standard of Kuhuang oral liquid.Methods:TLC was used for the identification of sophorae flavescentis radix,rhei radix et rhizome and isatidis folium;and HPLC was used to determine the content of matrine which is the efective substance in the preparation.ResultsThe TLC spots developed were fairly clear,and the blank test showed no interference.The linear range of Matrine was 0.193 6~7.744 0μg,the average recovery was 101.1%,and RSD was 2.87%in HPLCmethods.ConclusionThe methods is simple and reliable.It can be used in quality control of Kuhuang oral liquid.
Kuhuang oral liquid;TLC;HPLC
*王恒斌,Tel:(0512)52823272,E-mail:whb2002y@163.com
2010-04-02)
