硫普罗宁预防食道癌放疗肺损伤 49例临床观察
2010-10-15李智强王小龙
周 雷,李智强,王小龙
食道癌是临床常见肿瘤,放疗为有效的治疗方法,但常并发放射性肺炎。为预防放射性肺损伤,我们对硫普罗宁预防食道癌放疗肺损伤的作用进行了临床观察,现将结果报告如下。
1 临床资料
1.1 一般资料 本资料 98例食道癌患者,均为经胃镜病理检查确诊均为食道中段癌。KPS评分≥80分,既往无胸部放射治疗史,无并发慢性支气管炎、肺炎及严重肺间质纤维化者。年龄 42~79岁,中位年龄 41岁。
1.2 治疗方法 全部病例按入院顺序(单双号)分为治疗组和对照组,2组病例均采用一前野加两背斜野,野宽 6~7 cm,野长为病灶外放 4~5 cm,DT 36-40 Gy后缩野,用 6mm X线常规分割照射,总剂量 DT 60-66 Gy。对照组仅做常规放疗,治疗组放疗同时加用硫普罗宁 0.3 g/d静脉滴注(与放疗同步)。
1.3 观察指标 放疗中详细记录患者的咳嗽、胸闷、憋气、心慌等症状;放疗前、中(40Gy时)、结束及放疗后 1个月、3个月、6个月、12个月均行胸部 CT检查。根据胸部CT检查结果和临床症状,放射性肺炎诊断标准:放射过程中和(或)后出现咳嗽、胸闷、气短、肺部啰音等症状体征,亦可无临床症状体征;CT胸部检查在放射治疗部位或边缘处早期肺纹增多、增粗、模糊或斑片状浸润影,可除外其他原因者,后期肺纤维化改变,诊断为放射性肺炎,发生于放疗过程中至结束后 12周为急性放射性肺炎,发生于放疗结束后 3~10个月为慢性放射性肺炎肺纤维化。
1.4 统计学方法 本组数据采用 SPSS10.0统计软件处理,进行 χ2检验。(P<0.05)为差异有显著性。
2 结果
急性放射性肺炎、肺纤维化的发生率治疗组分别为8.16%、6.12%;对照组分别为 24.5%、20.4%。2组结果比较,差异有显著性,见表1、表2。
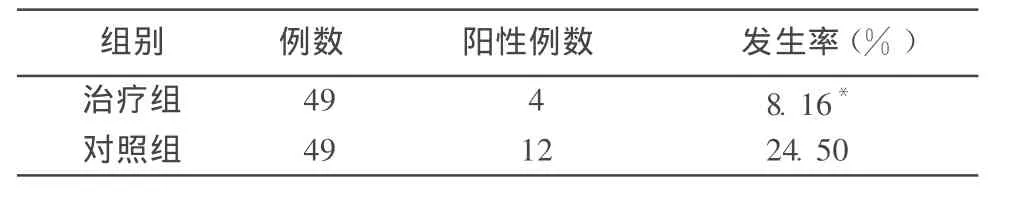
表1 2组急性放射性肺炎发生例数比较

表2 2组放射性肺纤维化发生例数比较
3 讨论
放疗是肿瘤综合治疗的一种手段,随着放疗的广泛应用放射性肺炎的发病率亦相应上升。放射性肺炎是胸部恶性肿瘤经放射治疗后的常见并发症。胸部肿瘤患者接受放疗后,引起的肺放射损伤分急性放射性肺炎和慢性肺纤维化,二者是一个连续变化的过程。放射性肺炎的发生率为 1%~34%,放射学改变的发生率则高达 15%~100%[1]。通常在完成放射治疗后 1~3个月出现放射性肺炎,6~24个月后可发生永久性肺纤维化[2]。严重者可医治无效而死亡。因此,有效治疗放射性肺炎,是肿瘤放疗中亟待解决的问题。
胸部肿瘤放疗后放射性损伤的发生机理尚未完全阐明,有学者[3]认为与小血管及肺泡型细胞损伤、自由基产生过多、细胞因子含量增多等密切相关,还可能受炎症介导物、补体、干扰素和淋巴细胞活素等的影响,肺内自由基的形成直接导致细胞的破坏。特别是血浆转化生长因子 TGF-B1含量的变化与放射性肺损伤的程度相关,它在放射性肺损伤的修复中发挥重要作用[4]。细胞因子、成纤维细胞和肺泡型细胞之间相互作用激活纤维细胞和肺泡型细胞,修复其损伤而导致纤维化。吴开良和李艳如[5]报道照射后 1个月以渗出为主,3个月以增生为主,6个月以纤维化、胶原化为主,说明放射性肺炎的发生是一个动态的过程,当肺中发生放射性损伤时,肺泡型细胞与成纤维细胞等将释放 TGF-B等细胞因子。
放射性肺损伤病理上大体分 3期:即渗出期、机化期和纤维化期。各期之间可相互重叠。在渗出期(0~2个月),照射区受损伤肺组织的毛细血管充血和血栓形成,富含蛋白质和细胞的液体渗入间质和肺泡,引起间质水肿和肺泡浸润;而渗出期病变具有可逆性;但纤维化的发生,往往是不可逆的[6]。有资料表明:肺受照射后数小时,就有多种因素因子表达,细支气管和肺泡上皮是细胞因子的主要来源,细胞因子促进炎性细胞的入侵、聚集和活性,导致急性放射性肺炎的发生[7]。孙苏平等[8]报道当肺组织照射剂量仅为 20GY时,TGF-B就有明显的升高,而且TGF-B在放射性肺纤维化的形成过程中有非常重要的作用。
硫普罗宁是一种含有巯基的甘氨酸衍生物,通过提供疏基,活化超氧化物歧化酶,抑制过氧化物产生[9],清除自由基,增强肝脏解毒功能,稳定肝细胞膜和线粒体膜,参与嘌呤类核苷酸的合成,促进肝细胞再生和修复,防止三酰甘油在体内堆积,抑制成纤维细胞增生,阻断并逆转肝损伤[10]。
硫普罗宁一方面可以通过巯基与体内的自由基结合,可以转化成易代谢的酸类物质,从而加速自由基的排泄;另一方面可以中和氧自由基,避免活性氧和氧自由基产生过氧化脂质,从而避免细胞的损伤,并可促进正常细胞蛋白质的合成,起到保护正常细胞的作用。
硫普罗宁通过上述机制减少了放射后正常肺组织自由基的含量,从而减轻了放疗后肺组织的过氧化损伤和成纤维细胞增生,起到了保护正常组织细胞膜、恢复细胞功能和减轻放射后肺损伤的作用。
本文资料中,对照组急性放射性肺炎的发生率为 24.5%,而治疗组急性放射性肺炎的发生率仅为 8.16%,2组差异有显著性,说明硫普罗宁能够降低放射性肺损伤的发生率,在临床上有一定的预防作用,值得推广应用。
[1]Movasaa B.Puknonary radiation injury[J].Chest,1997,111(4):1061.
[2]任少华.放疗致肺损伤的诊断与治疗[J].国外医学◦呼吸系统分册,1998,18(1):24.
[3]Fu XL,Huang H,Bente IG,et al.Predicting the risk of symptomatic radiation-induced lung injury using both the physical and biologic parameters V(30)and transforminggrowth factor beta[J].Int JRadiat Oncol Biol Phys,2001,50(4):899.
[4]李容清,金治宁.TGF-B1在放射性纤维化形成中的作用及其意义[J].中国癌症杂志,2001,11(3):2671.
[5]吴开良,李艳如.不同分割照射所致放射性肺损伤及茶色素对其影响[J].中华放射医学与防护杂志,2001,21(1):411.
[6]郑 红,金冶宁.放射性肺损伤的研究进展[J].第二军医大学学报,2002,23(11):1264.
[7]Rube CE,Uthe D,Wilfe F,et al.The bronchiolar epithelium as a promintent source of pro-inflammatory cytokines after lung irradiation[J].Int JRadiata Oncol Biolphys,2005,61(5):1482-1492.
[8]孙苏平,金冶宁,魏 怡,等.转化生长因子-B1的表达与肺放射性损伤关系研究[J].中华放射肿瘤学杂志,1999,8(3):1551.
[9]国家食品药品监督管理局安全监管司,国家食品药品监督管理局药品评价中心◦国家基本药物[M].北京:人民卫生出版社,2005.06.
[10]肖作汉,朱小英.硫普罗宁(凯西莱)联合 C2干扰素治疗慢性乙型肝炎肝纤维化 30例[J].中西医结合肝病杂志,2005,15(4):24.
