多菌灵在加工番茄农田土壤中的残留动态
2010-10-13冯燕燕侯振安林秀周川赵靓
冯燕燕,侯振安,林秀,周川,赵靓
(石河子大学农学院资源与环境科学系,石河子832003)
多菌灵在加工番茄农田土壤中的残留动态
冯燕燕,侯振安,林秀,周川,赵靓
(石河子大学农学院资源与环境科学系,石河子832003)
为评价多菌灵在新疆干旱区农田土壤中的残留动态和安全性,在加工番茄农田进行了多菌灵施用的田间试验,采用高效液相色谱法测定了多菌灵在土壤中的残留降解动态。结果表明:高效液相色谱法具有较高的检测精度,添加回收率为87.3%~94.5%,最低检测浓度为0.03mg/kg,符合农药残留分析的要求。多菌灵施用后7d,其在土壤中的残留率为30%~46%,28d时残留率低于10%,60d后多菌灵残留量均低于最低检测限(≤0.03 mg/kg)。多菌灵在土壤中的残留量随着多菌灵浓度增加而增加,半衰期却随着多菌灵浓度的增加而减小,多菌灵在加工番茄农田土壤中的半衰期为6.48~10.27d。
多菌灵;加工番茄;农药残留;半衰期
农药在土壤中的残留是导致农药对环境造成污染和生物危害的根源。当土壤中农药残留积累到一定程度后,不仅会对土壤生物造成毒害,还可以通过挥发、扩散、质流产生转移,污染大气、地表水体和地下水,并可通过生物富集和食物链,最终危害人体健康[1]。因此,农药在土壤中的残留引起人们的关注。
多菌灵,又名棉萎灵、苯并咪唑44号,化学名2-苯并咪唑基氨基甲酸甲酯,是一种高效、广谱、低毒的内吸性苯并咪唑类杀菌剂,除了可叶面喷雾外,还可用于拌种和浇土,对子囊菌、半知菌等引起的真菌病害具有保护和治疗作用,主要用于大田作物、蔬菜、果树及经济作物等的多种病害防治[2]。多菌灵的残效期较长,随着多菌灵使用时间和使用量的累积,其对环境的危害越来越大。多菌灵的毒性表现于多方面,例如致癌致突变和生殖毒性,尤其对生殖系统影响最为显著,且在低剂量时对哺乳动物有毒害作用。Nakai等[3]和 Akbarsha等[4]研究发现低剂量多菌灵对雄性大鼠生精功能造成损伤并影响其生育力。多菌灵对人、畜均有一定毒性,可引起抽搐、精神恍惚、恶心呕吐、胸闷、头晕等中毒症状[5]。因此,有关多菌灵残留及其环境污染问题备受关注。
近年来,在多菌灵残留的测定方法方面开展了大量研究,包括高效液相色谱法[6-9]、液质联用[10-11]、液相-荧光检测[12-13]、离子交换色谱法[14]、分光光度法[15]等,其中高效液相色谱法是多菌灵残留检测使用较为普遍的方法。目前,国内外学者对多菌灵在作物及土壤中的残留降解动态及其对土壤环境的影响方面开展了一些研究[16-20]。从已有的研究结果看,由于生态气候条件和土壤类型的差异,多菌灵在不同地区农田土壤中的降解半衰期差异较大。新疆是我国最大的加工番茄制品加工出口基地,但关于新疆干旱区加工番茄农田施用多菌灵后的残留降解动态及其对土壤环境的影响方面的报道很少[21]。本研究探讨了多菌灵在新疆加工番茄农田土壤中的残留降解动态,旨在为多菌灵农药的合理使用提供科学依据。
1 材料和方法
1.1 材料
土壤类型为灌耕灰漠土,土壤质地为壤土,全氮0.21g/kg,有机质12.68g/kg,速效磷20.59mg/kg,速效钾150.74mg/kg,pH 8.71,土壤溶液电导率(EC 1∶5)0.17ds/m。供试农药为多菌灵(80%可湿性粉剂),作物为加工番茄(品种:里格尔87-5)。
Agilent1200液相色谱仪,带紫外检测器和色谱工作站,振荡器,旋转蒸发仪(Buchi)。
二氯甲烷、石油醚、甲醇、无水硫酸钠、氯化钠、盐酸、氢氧化钠、N,N-二甲基甲酰胺均为色谱纯。
多菌灵标准品(≥99.5%):购自农业部农药检定所。
1.2 方法
1.2.1 试验设计
试验在石河子大学农学院试验站进行。
将多菌灵农药的施用量设置6个水平:0、5、10、20、50和100mg/kg(按照0~15cm 土壤干重计算)。每个处理重复4次,共24个试验小区,试验小区面积为10m2。
加工番茄种植采用覆膜滴灌方式,全生育期灌水7次,总灌水量为450mm;其他栽培方式参考当地大田生产。分别在施药后1、3、5、7、14、21、28、35和42d,在每个小区按对角线取5点,采集表层土壤(0~15cm)混合土样。
土壤样品置于冰柜中,冷冻(-20℃)保存待测。
1.2.2 土壤中多菌灵残留分析方法
称取20g土样于250mL具塞三角瓶中,加80 mL甲醇和0.2mol/L盐酸溶液10mL,振荡提2h后布氏漏斗抽滤,50mL甲醇洗残渣,合并滤于250 mL平底烧瓶中,在旋转蒸发仪上真空浓缩至20~30mL,留待液-液分配。
将浓缩后的提取液转移至250mL分液漏斗中,加入0.2mol/L盐酸溶液10mL和40mL蒸馏水,再加入40mL石油醚剧烈振荡1min,静置分层后弃去上层有机相。水相用1mol/L NaOH溶液调节pH至6.5,再加入20mL饱和NaCl溶液,用40mL二氯甲烷萃取3次。萃取液经过5g无水Na2SO4干燥后合并收集于250mL平底烧瓶中,减压浓缩至近干,N,N-二甲基甲酰胺定容至5mL,经0.45μm的滤膜过滤到进样瓶,待HPLC检测。
1.2.3 HPLC检测条件
色谱柱:4.6mm (id)×150mm,ZORBAX SBC18柱,粒径5μm;流动相:甲醇-水(65∶35);流速:0.8mL/min;检测波长:281nm;进样量:5μL;柱温:25℃;多菌灵相对保留时间约2.8min,柱温25℃。
1.2.4 标准储液的制备
准确称取0.005g(精确至0.1mg)多菌灵标准,置于5mL容量瓶,用N,N-二甲基甲酰胺溶解并定容至刻度,摇匀后即为标准母液。
1.2.5 残留量计算公式
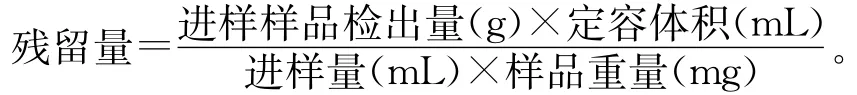
2 结果与分析
2.1 标准曲线
采用外标法定量,将多菌灵的标准母液用N,N-二甲基甲酰胺稀释成质量浓度为1、5、10、20、40、50、60、80、100ng/μL的标准溶液,在1.2.3色谱操作条件下进行检测,并以峰面积A为纵坐标,多菌灵浓度C(ng/μL)为横坐标作图(图1),同时用最小二乘法进行线性回归,得标准曲线回归方程:
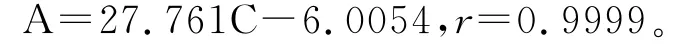
多菌灵浓度为1~100ng/μL,与峰面积值有极显著的线性关系(P<0.001)。
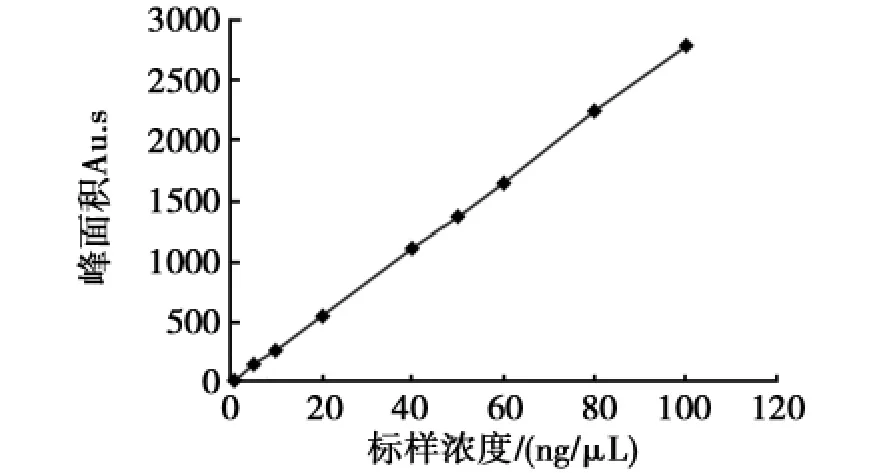
图1 多菌灵标准曲线Fig.1The standard curve of carbendazim
2.2 方法的准确度和精密度
多菌灵在空白土壤中的添加浓度分别为0.5、2、10mg/kg,按本文中1.2.2和1.2.3所述方法进行处理,每个浓度进行3个平行试验,计算回收率和相当标准偏差。测定土壤的添加回收率为87.9%~94.51%(表1)。多菌灵标样色谱图、土壤空白色谱图和土壤加标色谱图见图2。
该方法的最低检出量为0.5×10-9g,最低检测浓度为0.03mg/kg,灵敏度较高。
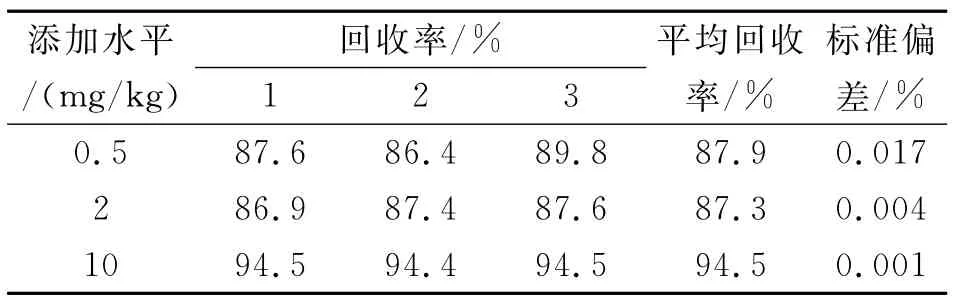
表1 多菌灵在土壤中的添加回收率Tab.1Recovery of carbendazim applied in soil
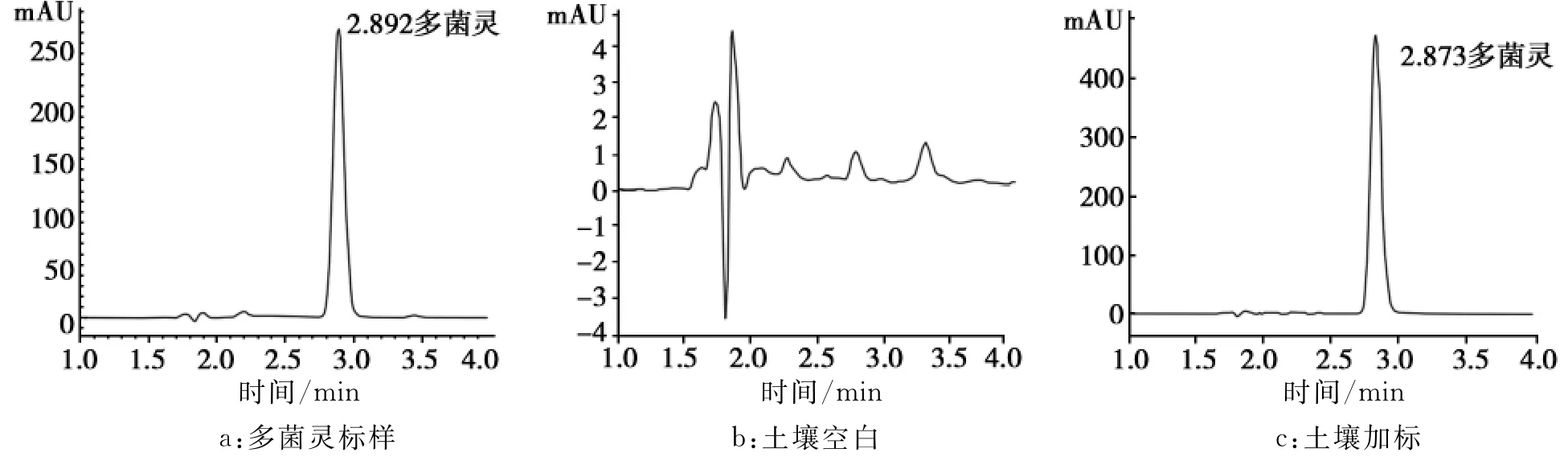
图2 色谱图Fig.2HPLC chrarmtogram
2.3 多菌灵在土壤中的残留动态
5个多菌灵处理(5、10、20、50和100mg/kg)在加工番茄农田土壤中的农药残留动态见图3。
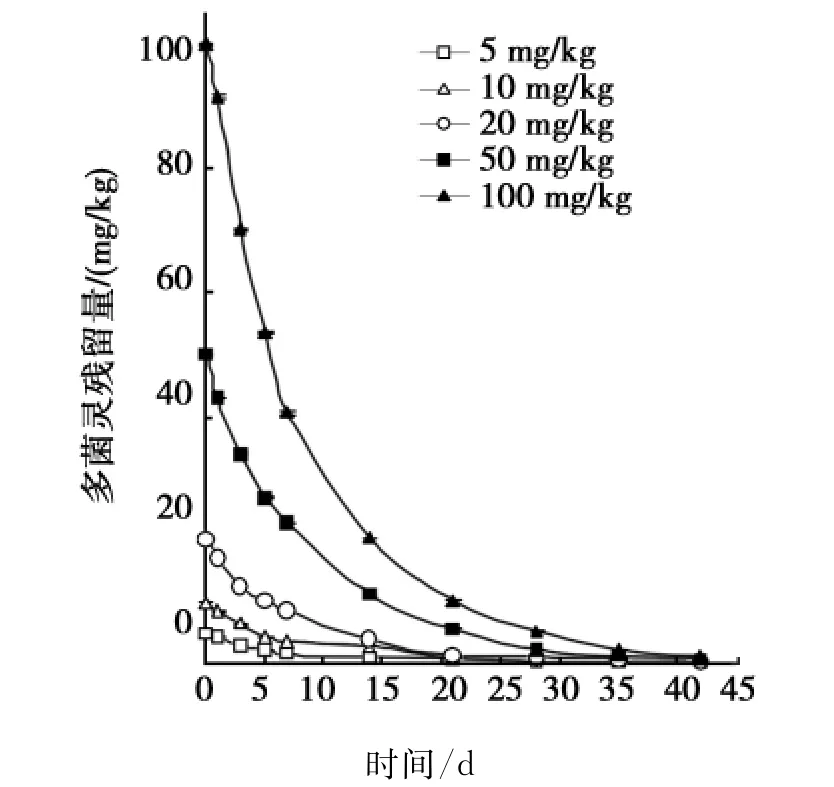
图3 土壤中多菌灵的残留降解动态曲线Fig.3Degradation curve of carbendazim in soil
由图3可见,多菌灵在土壤中的残留量随着使用量的增加而显著增加。多菌灵施用7d后,在加工番茄农田土壤中残留率为30%~46%;施用28d后,其在土壤中的残留率已不到10%;在多菌灵施用后42 d,5个多菌灵处理(5、10、20、50和100mg/kg)土壤中多菌灵的残留量分别为0.28、0.32、0.34、0.73、1.25 mg/kg;60d后,多菌灵残留量均低于最低检测限(≤0.03mg/kg)
2.4 多菌灵在土壤中的降解半衰期
多菌灵在加工番茄农田土壤中的残留量随着时间的推移呈明显下降趋势,且二者间呈指数关系,符合一级动力学方程:
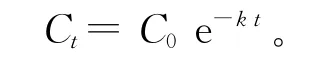
上式中,Ct为施药后土壤中的农药残留量,C0为施药后土壤中的最初累积量,k为降解常数,t为施药后的天数。
不同处理多菌灵在土壤中的的降解动态方程见表2。经显著性检验,方程的相关系数均达到极显著水平。根据多菌灵的降解动态方程,计算得到不同浓度多菌灵(5.0、10.0、20.0、50.0和100.0mg/kg)在加工番茄农田土壤中的半衰期分别为10.27、9.07、6.48、6.78和6.61d。
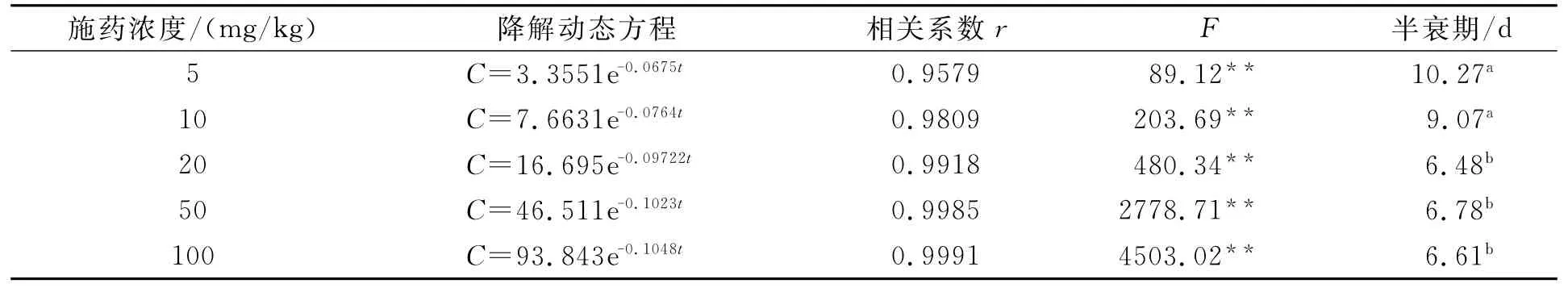
表2 多菌灵在土壤中的降解动态方程Tab.2Degradation dynamics of carbendazim in soil
3 讨论
本研究应用高效液相色谱法测定加工番茄农田土壤中的多菌灵残留,检测中多菌灵的保留时间约2.8min,这与刘文杰等[22]的检测相似(2.68min);但明 显 低 于 其 他 的 相 关 报 道[16,19,23](5.5~9.2 min),这可能与检测所用的仪器和色谱条件有关。添加回收率在87.3%~94.5%,土壤中多菌灵的最低检测浓度为0.03mg/kg,这表明检测方法定量准确、灵敏度高,可以满足农药残留分析要求。
本试验条件下多菌灵在加工番茄农田土壤中的降解半衰期为6.48~10.27d,这与王中等[24]对香兰草农田土壤中多菌灵的降解半衰期为7.6~9.0d的研究结果相似。但是,大量研究表明多菌灵在土壤中的降解与多种环境因素有关[25]。向月琴等[20]报道室内模拟条件下多菌灵在黄松土中的降解半衰期为6.8~8.6d;张玉婷等[18]报道,天津和江苏两地小麦农田土壤中多菌灵的降解半衰期分别为34.5和26.6d;张浩等[19]报道,吉林和黑龙江两地大豆农田土壤中多菌灵的降解半衰期分别为55.2和57.1d;樊丹等[26]报道湖北茶园土壤中多菌灵的降解半衰期为5.9d。同时,在同一地区不同年度内多菌灵的降解半衰期也有较大差异,金仁耀等[16]连续2年的研究表明,多菌灵在衢州和南宁两地土壤中的降解半衰期分别为2.59、3.65d和13.95、8.15 d。此外,多菌灵降解半衰期的差异也与土壤质地有关,Sangita等[27]认为多菌灵在粘土和粘壤土中的降解较在砂土中快。
本研究的结果表明,多菌灵初始浓度5.0和10.0mg/kg处理的降解半衰期为10.27和9.07d,显著高于20.0、50.0和100.0mg/kg处理的6.48、6.78和6.61d。这与向月琴等[20]的研究结果一致。有研究指出,低浓度多菌灵的降解速率低于高浓度,与土壤中微生物利用并降解农药的特点有关。残留农药浓度较低的情况下,微生物趋于利用其他有机物,对农药的利用效率较低,这是导致低浓度多菌灵降解速率下降的原因[28]。
本研究选择新疆石河子作为研究区,以新疆北疆地区的典型地带性土壤灌耕灰漠土为研究对象,探讨了多菌灵在加工番茄农田土壤中的残留动态,研究结果对于指导该地区多菌灵农药的合理使用具有一定的参考价值。本研究中多菌灵的施用方式采用土壤喷药,这与实际农业生产中的植物喷施有一定的差异,同时,研究所涉及的区域较少,研究时限也较短,因此研究结果还需要进一步的验证。
[1]张利,刘红玉,张慧,等.湖南东部地区稻田土壤中有机氯农药残留及分布[J].环境科学研究,2008,21(1):118-123.
[2]刘乾开,朱国念.新编农药使用手册[M].2版.上海:上海科学技术出版社,1999.
[3]Nakai M,Hess R A,Moore B J,et al.Acute and longterm effects of a single dose of the fungicide carbendazim (methyl2-benzimidazole carbamate)on themale reproductive system in the rat[J].J of Andro,1992,13:507-511.
[4]Akbarsha M A,Kadalmani B,Girija R,et al.Spermatotoxic effect of carbendazim[J].Indian Journal of Experimental Biology,2001,39:921-924.
[5]郝金芝.高效液相色谱法测定水果中的多菌灵[J].中国卫生检验杂志,2004,14(5):586.
[6]桂文君,黄雅丽,吴慧明,等.多菌灵在柑桔及土壤中的HPLC残留分析方法[J].现代农药,2004,3(3):25-28.
[7]沈菁,刘军,刘建.高效液相色谱法测定柑橘和土壤中残留的多菌灵[J].色谱,2009,27(3):308-312.
[8]张浩,张祥辉,逯忠斌,等.高效液相色谱法同时测定食用菌中的多菌灵和噻菌灵残留量[J].农药,2008,47(7):517-518.
[9]张琦,董慧茹,黄丽丽.固相萃取-高效液相色谱法测定河水中的多菌灵含量[J].环境化学,2008,27(1):119-120.
[10]量程朴,唐慧敏,杨淑娴,等.应用液质联用仪测定番茄、黄瓜中多菌灵残留[J].现代农药,2009,8(3):36-37.
[11]刘慧群,刘新刚,董丰收,等.超高效液相色谱-串联质谱测定蔬菜、水果和土壤中多菌灵的残留研究[J].农药科学与管理,2009,30(4):20-24.
[12]杨秀敏,陈永艳,胡彦学,等.固相微萃取-高效液相色谱-荧光检测法分析苹果汁中的多菌灵和噻菌灵[J].中国食品学报,2007,7(5):122-127.
[13]Halko R,Sanz C P,Ferrera Z S,et al.Determination of benzimidazole fungicides in soil samples using microwave-assisted micellar extraction and liquid chromatography with fluorescence detection[J].Journal of AOAC International,2006,9(5):1403-1409.
[14]何强,孔祥虹,赵洁,等.固相萃取-离子交换色谱法测定浓缩苹果汁中残留的苯菌灵、多菌灵、噻菌灵[J].色谱,2008,26(5):563-567.
[15]范宁云,蔡兴,李彩霞.分光光度法测定蔬菜中多菌灵残留量新方法的研究[J].甘肃科技,2009,25(2):52-53.
[16]金仁耀,桂文君,寿林飞,等.多菌灵在柑橘和土壤中的残留及降解动态研究[J].江苏农业科学,2005,18(2):111-114.
[17]游子涵,陈智东,柳训才,等.油菜植株及其土壤中多茵灵残留检测及动态[J].农药,2006,45(8):552-553.
[18]张玉婷,郭永泽,刘磊,等.50%多菌灵WP在小麦和土壤中残留动态研究[J].天津农业科学,2007,13(4):52-54.
[19]张浩,王岩,逯忠斌.40%多菌灵SC在大豆和土壤中的残留动态[J].农药,2006,45(10):695-696.
[20]向月琴,高春明,庞国辉,等.土壤中多菌灵的降解动态及其对土壤微生物群落多样性的影响[J].土壤学报,2008,45(4):699-704.
[21]冯燕燕,蔡继红,侯振安,等.多菌灵对新疆灰漠土壤中六种酶活性的影响[J].石河子大学学报:自然科学版,2009,27(4):413-418.
[22]刘文杰,万英,庞新安,等.高效液相色谱法同时测定土壤中多菌灵、吡虫啉和甲基托布津的残留[J].分析测试学报,2007,26(1):133-135.
[23]张浩,王岩,刘冬华,等.大豆植株及土壤中多菌灵残留分析方法的研究[J].吉林农业大学学报,2004,26(5):535-537.
[24]王中,侯宪文,邓晓,等.多菌灵在香草兰和土壤中的残留动态[J].生态环境学报,2009,18(2):535-539.
[25]Jones S E,Williams D J,Holliman P J.Ring-tesing and field-validation of a terrestrial model ecosystem(TEM)-an instrument for testing potentially harmful substances:fate of the model chemical carbendazim[J].Ecotoxicology,2004,13:29-42.
[26]樊丹,甘小泽,卢耀英,等.多菌灵在茶叶中的残留动态研究[J].农业环境科学学报,2005,24(增刊):298-300.
[27]Sangita T,Ravi B,Mathur R P.Degradation of organophosphorus and carbamate pesticides in soils-HPLC determination[J].Biomedical Chromatography,1995,9:18-22.
[28]Nannipieri P,Bollag J M.Use of enzyme to detoxify pesticidecontaminated soils and waters[J].Journal of Environmental Quality,1991,20:510-517.
The Residue Dynamic of Carbendazim in Soil of Processing Tomato Field
FENG Yanyan,HOU Zhen′an,LIN Xiu,ZHOU Chuan,ZHAO Jing
(Department of Resources and Environmental Sciences,Shihezi University,Shihezi 832003,China)
In order to make a standard procedure for the safe use of carbendazim on soil and processing tomato,a tomato field experiment was conducted and the residue dynamic of carbendazim in soil were analyzed by HPLC.Results showed that the recovery rates ranged from 87.3%to 94.5%,and the determination limits was 0.03mg/kg in soil.The residues of carbendazim in soil were occupied for 30%~46%of the initial concentration 7days after treatment and were no more than 10%of that 28days after treatment.The final residues of carbendazim in soil were less than the limit of detection (≤0.03mg/kg)60days after treatment.With the carbendazim concentration increase in the residues of carbendazim in soil were increased and the half-lives of carbendazim in soil were shorted.The half-lives of carbendazim in soil of processing tomato field were from 6.48to 10.27d.
carbendazim;processing tomato;pesticide residue;half-life
S48
A
2010-01-10
国家科技支撑计划项目(2007BAC20B04)
冯燕燕(1983-),女,硕士研究生,专业方向为土壤生态环境。
侯振安(1972-),男,教授,从事绿洲农业资源高效利用研究;e-mail:hzhe_agr@shzu.edu.cn。
