人胰高血糖素样肽-1类似物基因治疗对STZ诱导糖尿病大鼠的拮抗作用*
2010-10-10李晓丽马卫列张志珍
李晓丽,刘 振,马卫列,张志珍△
(广东医学院:1.生物化学与分子生物学教研室,湛江524023;2.衰老研究所,东莞523808)
目前,糖尿病患病率呈增长趋势,已成为中国继心血管疾病、肿瘤之后的第3位疾病[1]。人胰高血糖素样肽-1(human glucagon-like peptide-1,hGLP-1)是一种肠促胰岛素激素,能有效降低血糖,促进胰岛素分泌,促进胰岛β细胞增殖并抑制其凋亡,在糖尿病基因治疗中具有很大潜力[2-3]。本课题组在前期研究中,已成功构建了 hGLP-1类似物基因(2×Val2-hGLP-1)重组表达质粒[4],本实验旨在将这一重组质粒通过尾静脉注射导入体内,观察其对链脲佐菌素(STZ)诱导的糖尿病大鼠的拮抗作用,为临床治疗提供一定的实验基础。
1 材料与方法
1.1 实验动物 SPF级SD雄性大鼠40只,体质量200~220 g,由广东医学院实验动物中心提供,许可证号:SCSK(粤)2008-0008。
1.2 实验材料与试剂 STZ(Merck公司),葡萄糖检测试剂盒、总胆固醇检测试剂盒(上海荣盛生物科技有限公司),胰岛素检测试剂盒(Beckman coulter公司),兔抗大鼠胰岛素抗体、辣根过氧化物酶标记的羊抗兔IgG(北京博奥森生物科技有限公司),DAB辣根过氧化物酶显色试剂盒(碧云天生物技术研究所),质粒DNA大提试剂盒(天根生物科技有限公司),阳离子脂质体(Lipofectamine Invitrogen公司),空载体 pIRES2-EGFP(Invitrogen公司),hGLP-1类似物基因重组表达质粒(p IRES2-EGFP/2×Val2-hGLP-1,由本室构建)。
1.3 实验方法
1.3.1 糖尿病模型建立及实验分组 将大鼠随机分为正常对照组、糖尿病模型组、空载体对照组、基因治疗拮抗组,每组 10只。糖尿病模型组、空载体对照组和基因治疗拮抗组于实验开始后第7、8、9、10、11天连续腹腔注射STZ。每组大鼠分别在实验前1 d禁食12~14 h,自由进水,次日清晨按 40 mg/kg体质量腹腔注射1%STZ,并连续注射5 d[5-6],其中基因治疗拮抗组于第1天通过尾静脉注射阳离子脂质体包裹的重组质粒溶液70μg/只,并于第10天加强1次;空载体对照组按相同方式给予脂质体包裹的空载体溶液;正常对照组给予等体积生理盐水。
表1 hGLP-1基因拮抗治疗对糖尿病大鼠血糖、胰岛素及总胆固醇含量的影响(n=10,±s)
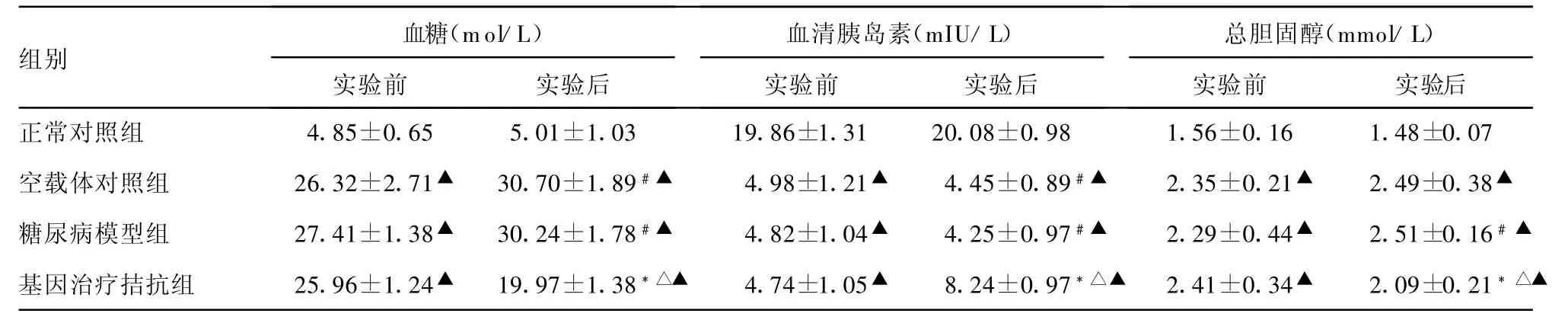
表1 hGLP-1基因拮抗治疗对糖尿病大鼠血糖、胰岛素及总胆固醇含量的影响(n=10,±s)
与实验前比较,*:P<0.01,#:P<0.05;与糖尿病模型组、空载体对照组比较,△:P<0.01;与正常对照组比较,▲:P<0.01。
血糖(mol/L)血清胰岛素(mIU/L)总胆固醇(mmol/L)组别实验前 实验后 实验前 实验后 实验前 实验后正常对照组 4.85±0.65 5.01±1.03 19.86±1.31 20.08±0.98 1.56±0.16 1.48±0.07空载体对照组 26.32±2.71▲ 30.70±1.89#▲ 4.98±1.21▲ 4.45±0.89#▲ 2.35±0.21▲ 2.49±0.38▲糖尿病模型组 27.41±1.38▲ 30.24±1.78#▲ 4.82±1.04▲ 4.25±0.97#▲ 2.29±0.44▲ 2.51±0.16#▲基因治疗拮抗组 25.96±1.24▲ 19.97±1.38*△▲ 4.74±1.05▲ 8.24±0.97*△▲ 2.41±0.34▲ 2.09±0.21*△▲
1.3.2 小量多次给STZ后各组糖尿病成模率 于实验第1、5、10、15、20天将大鼠空腹 12 h,眼眶静脉窦采血,4 ℃、4 000 r/min离心10 min分离血清,按试剂盒说明书进行血糖测定,计算各组大鼠成模率。
1.3.3 血糖、血清胰岛素及总胆固醇含量测定 实验前、后,按照上述方法采血并按试剂盒说明书检测血糖、血清胰岛素、总胆固醇水平。
1.3.4 组织细胞中hGLP-1表达的观察 实验结束后,将大鼠处死,迅速取出肾脏、肝脏和肌肉组织制作组织印片,借助荧光显微镜观察组织细胞中绿色荧光蛋白(GFP)的表达。
1.3.5 免疫组化分析胰岛中胰岛素分泌水平的变化 实验结束后,将大鼠处死,迅速取出胰腺组织,置于10%的甲醛中固定,石蜡包埋切片,厚度为 4μm,常规脱蜡至水,用 3%的H2O2阻断内源性过氧化物酶,微波加热暴露抗原,滴加兔抗大鼠胰岛素抗体(1∶100),4℃过夜,用PBS洗涤后滴加羊抗兔二抗,于37℃孵育1 h,DAB显色3~5 min,脱水、透明、封片后进行观察。采用Imagepro Plus图像分析软件,每张切片随机选取10个视野,分析胰岛素染色平均光密度(mean density)=光密度总和(IOD SUM)/胰岛素染色面积(area)。
1.4 统计学方法 应用SPSS13.0统计软件进行统计分析,计量资料以±s表示,组间比较采用方差分析,以 P<0.05为差异有统计学意义。
2 结 果
2.1 STZ处理后大鼠糖尿病成模率 见图1。以相同方式给予STZ后,各组大鼠的糖尿病成模率出现显著差异。基因治疗拮抗组大鼠糖尿病成模率在 STZ处理后第10、15、20天,分别为26.01%、48.69%、48.69%,显著低于糖尿病模型组和空载体对照组(48.25%、100%、100%,P<0.01)。STZ处理后5~15 d,各组大鼠的糖尿病成模率均上升(P<0.01)。
2.2 实验前、后大鼠血糖、血清胰岛素及总胆固醇含量 各组大鼠的血糖、胰岛素及胆固醇含量见表1。基因治疗拮抗组大鼠给予hGLP-1类似物基因后,其糖尿病症状得到缓解,与糖尿病模型组、空载体对照组比较,其血糖水平显著降低,血清胰岛素水平明显升高,同时总胆固醇水平也明显改善(P<0.01或P<0.05)。
2.3 组织细胞中hGLP-1表达分析 见图2。荧光显微镜观察到绿色荧光蛋白(GFP)在肝脏(图 A)、肌肉组织(图B)及肾脏(图C)中的表达。本实验采用p IRES2-EGFP真核表达载体,该载体多克隆位点和EGFP编码区基因之间设计有核糖体进入位点(IRES),能够确保插入的hGLP-1类似物基因与GFP编码基因共同转录,荧光显微镜观察到GFP表达,初步证明了载体已转入糖尿病大鼠体内,并在组织中表达。
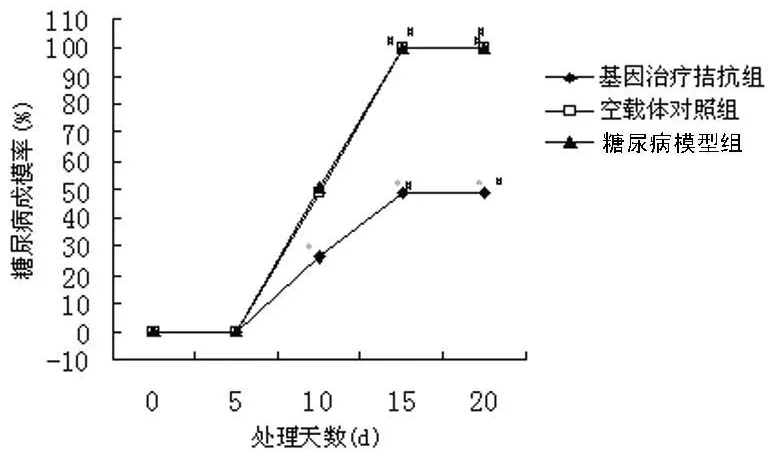
图1 STZ处理后大鼠糖尿病成模率
2.4 胰岛素分泌水平的变化 见图3。与正常对照组(图A)比较,糖尿病模型组(图B)和基因治疗拮抗组(图C)胰岛内胰岛素分泌颗粒减少。但经过hGLP-1类似物基因治疗后,基因治疗拮抗组胰岛素染色阳性区域的平均光密度(99.91±10.01)显著高于糖尿病模型组(91.46±8.23,P<0.05)。
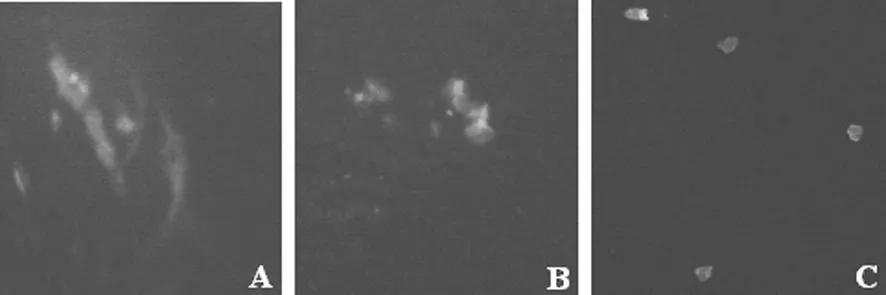
图 2 组织细胞中 hGLP-1表达的观察(×100)
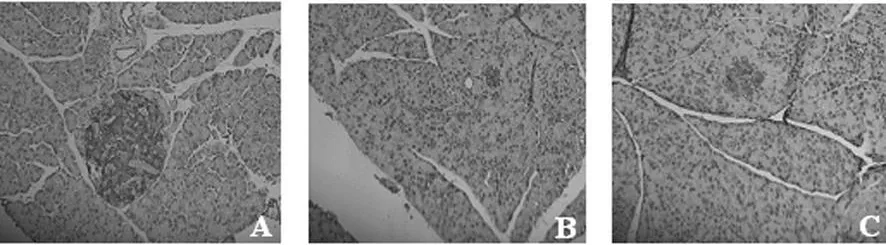
图3 胰岛内胰岛素分泌的变化(×100)
3 讨 论
hGLP-1是一种肠促胰岛素激素,进食时小肠上段受到营养物质的刺激,其下段的 L细胞便会分泌出这种肽类激素。它能有效降低机体血糖水平,是目前能诱导胰岛素分泌的最强物质之一。但由于丝氨酸蛋白酶-二肽酰基肽酶Ⅳ(DPPⅣ)的降解,其在体内的半寿期明显缩短[7]。为了提高其降糖效果,延长半寿期,基于抵抗DPPⅣ的hGLP-1类似物已陆续推向市场,但重复多次的给药方式使肽类药物在临床的应用受到限制,而基因治疗作为一种新的治疗策略,可以将外源基因转入体内,使目的蛋白持续性得以表达,因此,基因治疗在糖尿病治疗中已显示出巨大前景[8-10]。为此,作者在对hGLP-1基因修饰的基础上构建了含类似物基因的重组表达质粒,通过阳离子脂质体介导将质粒转染到大鼠体内,观察其对STZ诱导糖尿病大鼠的拮抗作用。在基因治疗过程中,可选择腺病毒载体、腺相关病毒载体、脂质体介导等方法将外源目的基因转入体内。本研究选用经典的基因转染方法——脂质体介导,用阳离子脂质体Lipofectamine包裹外源hGLP-1类似物基因,通过尾静脉注射导入体内。hGLP-1类似物基因可能通过内吞、凝集等机制,随血流进入到肝脏、肌肉组织等细胞中表达。相对于病毒载体介导外源基因的转染方法,脂质体转染安全简便[11],但转移效率较低是其缺陷,因此,在后续实验中要对如何提高基因转染效率、增强目的蛋白的靶向性等问题进行探索。
本实验在用STZ处理大鼠前7 d,通过尾静脉注射将重组表达质粒导入体内,并于第10天加强注射1次,而STZ则采用小剂量、多次给药的方式,分别于第7、8、9、10、11天将STZ腹腔注射入大鼠体内,给予hGLP-1类似物基因治疗后,研究发现,在肌肉、肝脏及肾脏组织中观察到了绿色荧光蛋白GFP的表达,说明载体已成功转移至大鼠体内。研究结果提示,hGLP-1类似物基因治疗对STZ诱导大鼠糖尿病形成有拮抗作用,糖尿病发病率降低,大鼠血糖水平下降,血清胰岛素水平升高,同时血清胆固醇水平也得以改善。也有研究显示,hGLP-1可促进胰岛β细胞的增殖、减少β细胞的凋亡,对β细胞的功能恢复有一定的作用。本研究结果也显示,基因治疗拮抗组大鼠胰岛中胰岛素分泌颗粒明显增加,胰岛β细胞的功能改善。
本实验采用pIRES2-EGFP真核载体,可使表达的hGLP-1类似物不与GFP融合,保证了其构象与生理活性。借助荧光显微镜检测到GFP,初步证明hGLP-1类似物基因已成功转入糖尿病大鼠体内并得到表达。总之,本研究采用阳离子脂质体作为载体,将重组质粒导入大鼠体内取得了较好的糖尿病拮抗作用,有望成为糖尿病基因治疗的一种方法。
[1] 徐灵莉,刘晓玲,吴静,等.2型糖尿病患者健康教育方法的探讨[J].重庆医学,2008,37(8):865.
[2] Edholm T,Cejvan K,Abdel-Halim SM,et al.Theincretin hormones GIPand GLP-1 in diabetic rats:effects on insulin secretion and small bowel motility[J].Neurogastroenterol M otil,2009,21(3):313.
[3] Kumar M,Hunag Y,Glinka Y,et al.Gene therapy of diabetes using a novel GLP-1/IgG-Fc fusion construct normalizes glucose levels in db/db mice[J].Gene Ther,2007,14(2):162.
[4] 李晓丽,刘振,张志珍.人胰高血糖素样肽-1类似物基因克隆及真核表达载体构建[J].中国现代医学杂志,2009,19(3):259.
[5] 吴凤丽,藩兴瑜,马晓光.链尿佐菌素诱导1型糖尿病的发生机制[J].中国实验诊断学,2008,12(9):1096.
[6] 张志珍,毛积芳,杨生生.重组人胰高血糖素样肽-1对实验性糖尿病大鼠血糖的影响[J].中国生化药物杂志,2004,25(5):287.
[7] Salvatore T,Carbonara O,Cozzolino D,et al.Progress in the oral treatment of type 2 diabetes:update on DPP-Ⅵinhibitors[J].Curr Diabetes Rev,2009,5(2):92.
[8] Green BD,Lavery KS,Irwin N,et al.Novel glucagon-like peptide-1(GLP-1)analog(Val8)GLP-1 results in significant improvements of glucose tolerance and pancreaticβcell function after 3-week daily administration in obesediabetic(ob/ob)mice[J].J Pharmacol Exp Ther,2006,318(2):914.
[9] Lee YS,Shin S,Shigihara T,et al.Glucagon-likepeptide-1 gene therapy in obese diabetic mice results in long-term cure of diabetes by improving insulin sensitivity and reducing hepatic gluconeogenesis[J].Diabetes,2007,56:1671.
[10]Soltanil N,Kumar M,Gilinka Y,et al.In vivo expression of GLP-1/IgG-Fc fusion protein enhances beta-cell mass and protects against streptozotocin-induced diabetes[J].Gene Ther,2007,14:981.
[11]左云龙,吴丽娟,匡风梧,等.脂质体包裹mA 20及其突变体质粒转染对内毒素血症小鼠的治疗作用[J].重庆医学,2008,37(13):1434.
