双黄酮类化合物提取和合成的研究进展
2010-09-29屈凌波袁金伟
薛 颖,屈凌波,袁金伟
(河南工业大学化学化工学院,河南郑州 450001)
双黄酮类化合物提取和合成的研究进展
薛 颖,屈凌波*,袁金伟
(河南工业大学化学化工学院,河南郑州 450001)
双黄酮类化合物结合方式多样、结构复杂,具有抗肿瘤、抗病毒、抗炎、抗氧化等多种药理活性.根据双黄酮分子结构之间连接方式的差异,对双黄酮类化合物的提取、合成、生理活性的研究进行了综述,并对它的发展趋势、应用前景作了展望.
双黄酮类化合物;结构;合成;提取;生理活性
0 前言
双黄酮属于黄酮类化合物,是由 2分子黄酮或其衍生物聚合而成的二聚物,其组成单元可以是不同类型的黄酮单体化合物.黄酮单体化合物主要存在于蕨类植物和裸子植物中,尤其在松柏纲、银杏纲和凤尾纲等植物中含量较多.双黄酮大多具有广泛的药理活性,如抗炎[1]、抗氧化[2]、抗病毒[3]、扩张外周血管、抗 PGE、抑制 cG MP、cAMP以及抑制癌细胞[4-6]等;因此,黄酮类化合物的功用引起了人们的广泛重视,对该类化合物的研究已成为国内外的热门课题.另外,随着食品工业的发展与消费观念的改变,含天然活性成分的保健食品、功能性食品成为现代人追逐的目标,其中黄酮类化合物以纯天然、高活性、见效快、作用广泛等特点日益受到人们的关注.
目前双黄酮主要从植物中提取,其次是生物合成,化学合成的较少.笔者根据双黄酮分子结构之间连接方式的差异,综述了近几年双黄酮的提取、合成和生理活性的研究进展.
1 研究进展
从文献报道看,早期发现的双黄酮化合物片段多为典型黄酮单元,随着分离手段的不断进步,由其他类型黄酮聚合而成的双黄酮相继被发现[7].双黄酮分子之间连接方式多种多样,主要分为以下几种.
1.1 通过 C—C键连接的双黄酮化合物
此类化合物是指由 2个黄酮分子通过 C—C键直接相连的化合物,无论在天然和化学合成的双黄酮中,此种类型种类最多.按存在的普遍程度具体又可分为以下几种[8]:3′,8″-双芹菜素型;8,8″-双芹菜素型,如柏黄素[9];其他型,包括黄酮分子其他取代位置之间及其他类型黄酮分子之间通过 C—C键相连的双黄酮化合物[10].
1.1.1 3′,8″-双芹菜素型
这类化合物在双黄酮类化合物中比较常见,如从银杏叶中分离得到的银杏素 (ginkgetin)、异银杏素等双黄酮[1];Lee等[11]用溶剂萃取法从朝鲜粗榧 (Cephalotaxus koreana)中分离得到 6种穗花衫类双黄酮 (amentoflavone),并通过评价碱性磷酸酯酶、胶原合成等活性,证明了白果黄素、紫杉双黄酮、7,4′,7″,4‴-O-甲氧基 -穗花衫双黄酮能促进成骨细胞的分化.其中,穗花衫双黄酮在B环上的 4′、4‴位的甲氧基对成骨细胞的分化起决定作用.而 Yamaguchi等[12]用甲醇从巴拉那松(A raucaria angustifolia)的针状叶中萃取得到了通过 C3′—C8″连接的双黄酮,并通过穗花衫双黄酮与槲皮黄酮、芦丁、银杏黄素、α-维生素 E比较发现,该双黄酮有更高的猝灭速率.Hiroaki Sasaki等[13]用丙酮或氯仿从大量的植物中提取出穗花衫类双黄酮,并发现其对β-分泌酶具有抑制作用.
由化学方法合成的该类型的双黄酮数量较多,主要合成步骤包括:先合成黄酮,然后将 2分子黄酮偶联得到最终产物.如 Nakazawa Koichi等[14]采用活化铜粉催化使 3′-碘 -4″,7-二甲氧基黄酮和 8-碘 -5-苯甲酞氧基 -4′,7-二甲氧基黄酮反应,产物经水解得到了第一个天然双黄酮——银杏素.通过观察颜色反应和化学特征,推测该化合物为双黄酮.反应过程如图 1所示.
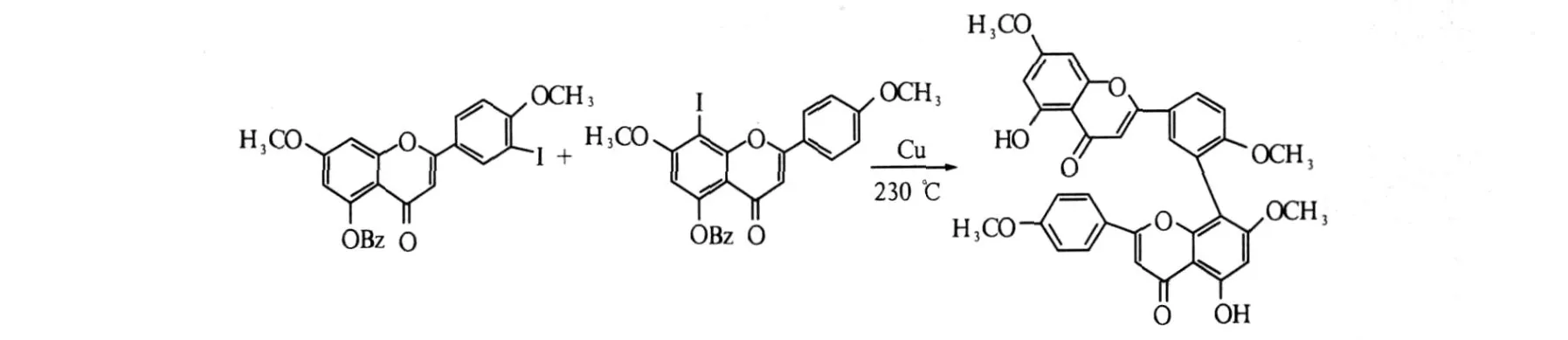
图1 通过 Suzuki偶联反应合成的双黄酮
有研究[15-16]采用碘代黄酮与含硼的黄酮进行偶联,合成了通过 C3′—C8″连接的异银杏双黄酮 (IGK),反应过程如图 2所示.潘苏华等[17]研究发现 IGK具有体内外抑制大鼠血栓形成的作用.
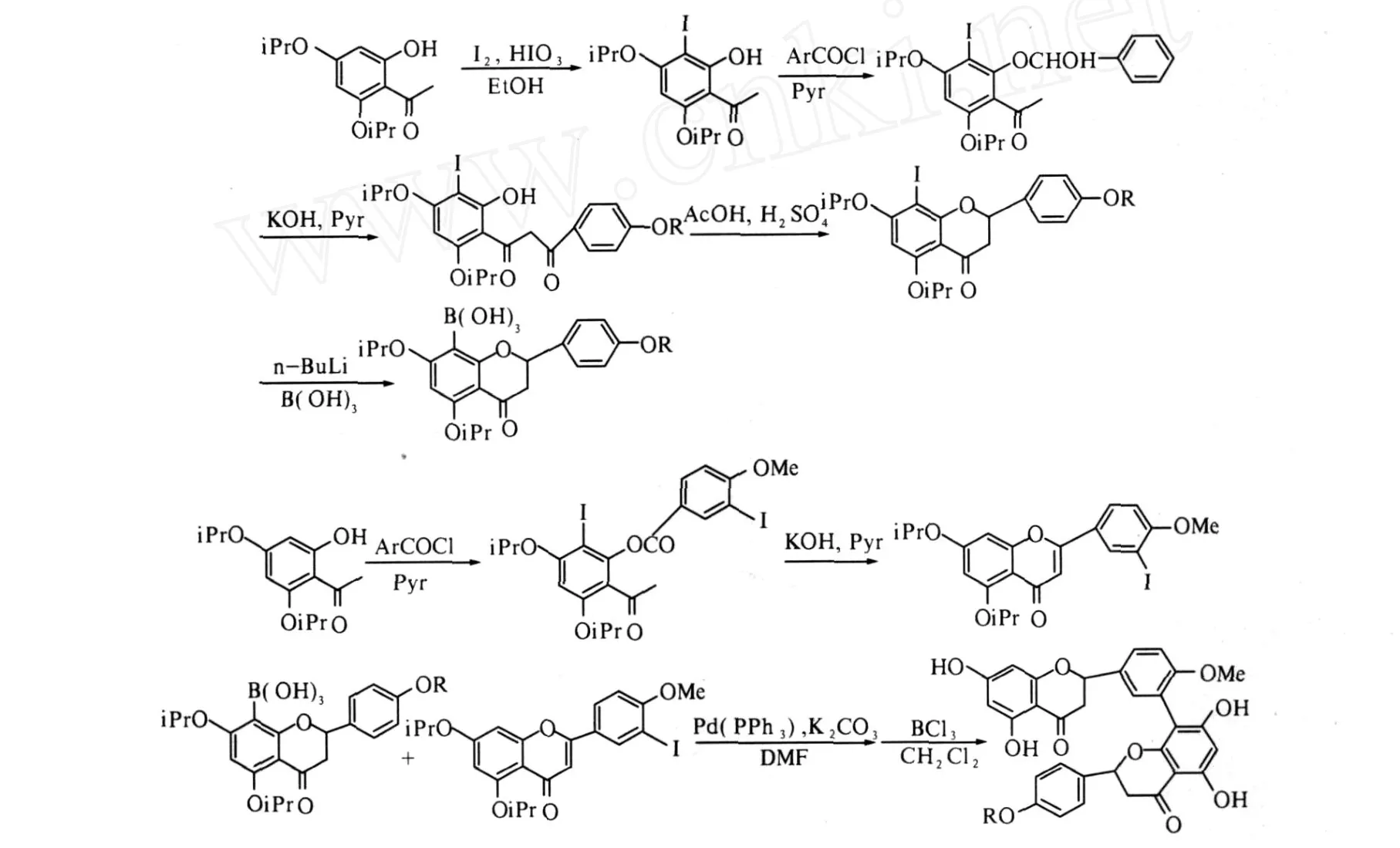
图2 通过碘代黄酮与含碘黄酮偶联合成的双黄酮
有研究[18-20]以碘代黄酮为原料,经铜粉催化偶联制得通过 C3′—C8″连接的银杏双黄酮,反应过程如图 3所示.该类型双黄酮对磷脂酶 A2和环氧化酶都有极强的抑制作用,并对环氧化酶的抑制具有一定的选择性.

图3 通过铜粉催化偶联合成的双黄酮
1.1.2 8,8″-双芹菜素型
黄酮类化合物的生物合成途径是复合的过程.一方面,由莽草酸经预苯酸、苯基丙酮酸到苯丙氨酸和桂皮酸,经辅酶 A活化,形成作为黄酮的B环的桂皮酸辅酶 A;另一方面,是由醋酸、丙酮酸到丙二酸,经辅酶 A活化,形成丙二酸辅酶 A.3分子丙二酸辅酶A与桂皮酸辅酶A结合即形成查耳酮,从而衍生出黄酮类化合物,进而得到 8,8″-双芹菜素型双黄酮[21],反应过程如图 4所示.

图4 双黄酮的生物合成路线
与生物合成比较,化学合成虽然步骤较多,但其选择性高、产率高.祝介平等[22]以丁二酞氯通过 Friedel-Cartfs反应连接 2个芳环,经过酯化、分子内 Baker-Veknataraman重排、环合制备了通过C8—C8″连接的双黄酮,反应过程如图 5所示.

图5 双黄酮的化学合成路线
1.1.3 其他取代位置通过 C—C键相连的双黄酮
Marcos B Machado等[23]从马兜铃属植物Aristolochia ridicula的叶中提取到一种通过 C3—C6″连接的双黄酮.Kamiya等[24]从岗松 (B aeckea frutescens)的树叶中提取了 8种双黄酮,采用乙酸乙酯萃取、重结晶、色谱纯化,最终得到新的双黄酮化合物,并发现该类双黄酮具有抗氧化活性.EloManga等[25]从赛金莲木属植物 Cam pylosperm um m annii中分离得到 3种双黄酮,利用紫外、红外、质谱、核磁谱图分析确定该化合物是通过C3—C3″连接的.
Zheng等[26]在不加强毒性试剂的温和条件下,在AgOAc/I2催化下用间苯三酚经过多步反应合成重要中间体 6-碘代黄酮,然后通过 Suzuki偶合反应与含氟黄酮合成了由 C3′—C6连接的双氟甲基双黄酮,反应过程如图 6所示.

图6 双黄酮的逆合成分析
Moon等[27]采用 PdCl2和 K2CO3为催化剂,使溴代黄酮与联硼酸频哪醇酯生成 4种 PB-黄酮.在 Pd(PPh3)4的催化下,将 PB-黄酮和溴代黄酮进行 Suzuki偶联反应,得到 6种双黄酮,收率为 40%~74%,并证实了该类型双黄酮对磷脂酶 A2有极强的抑制作用,反应过程如图 7所示.

图7 通过 Suzuki偶联反应合成以 C—C方式连接的双黄酮 a-f
Chen等[28]在 Pd(PPh3)4的催化下将碘代黄酮与六丁基锡反应生成三丁基锡黄酮,然后与溴代黄酮偶合生成了 4种不同连接方式的双黄酮.硼酸频哪醇酯与 4-溴代黄酮进行 Suzuki偶联得到 2种双黄酮,产率为 25%~50%.研究表明,该类双黄酮对磷脂酶A2和环氧化酶都有极强的抑制作用,并对环氧化酶的抑制作用具有一定的选择性.以 C4′—C4″方式连接的双黄酮具有与天然双黄酮类似的活性,金莲木黄酮比穗花衫双黄酮的活性高 7倍.
1.2 通过 C—O—C键连接的双黄酮化合物
这类化合物在一些天然产物的专著中被称为苯醚型,由 2个黄酮分子通过醚键相互连接而成.从文献报道来看,weniger等[29]从赛金莲木属植物Ouratea sulcata中萃取得到通过 C—O—C键连接的 4种穗花杉双黄酮,并证明该类化合物具有较强的抗疟疾活性.Xu等[30]用 95%乙醇粗提植物狭叶虎皮楠 (Daphniphyllum angustifolium Hutch),经分离得到 3种双黄酮.Lee等[31]用甲醇从卷柏 (Selaginella tam ariscina)中萃取得到异柳杉素黄酮.
Che等[32]通过分子间 Ullmann醚缩合反应,在 CuI、N,N-二甲基甘氨酸 、碳酸铯催化下将 6-溴代黄酮类似物和 7-羟基黄酮类似物缩合得到 17种以 C6—O—C7″方式连接的双黄酮衍生物,产率为 65%~75%.研究发现,该类双黄酮化合物对环氧化酶和诱导型氧化氮合酶具有抑制作用.在大鼠体内,以 C6—O—C7″方式连接的双黄酮分子主要通过抑制中间体 PGE2的生成来抑制环氧化酶和诱导型氧化氮合酶,对诱导型氧化氮合酶中间体NO的生成的抑制作用较弱,反应过程如图 8所示.

图8 通过分子间 Ullmann醚缩合反应合成以 C6—O—C7″方式连接的双黄酮
Koichi等[33]用碘代黄酮与黄酮为原料,合成通过 C4′—O—C8″连接的桧黄素,反应过程如图 9所示.
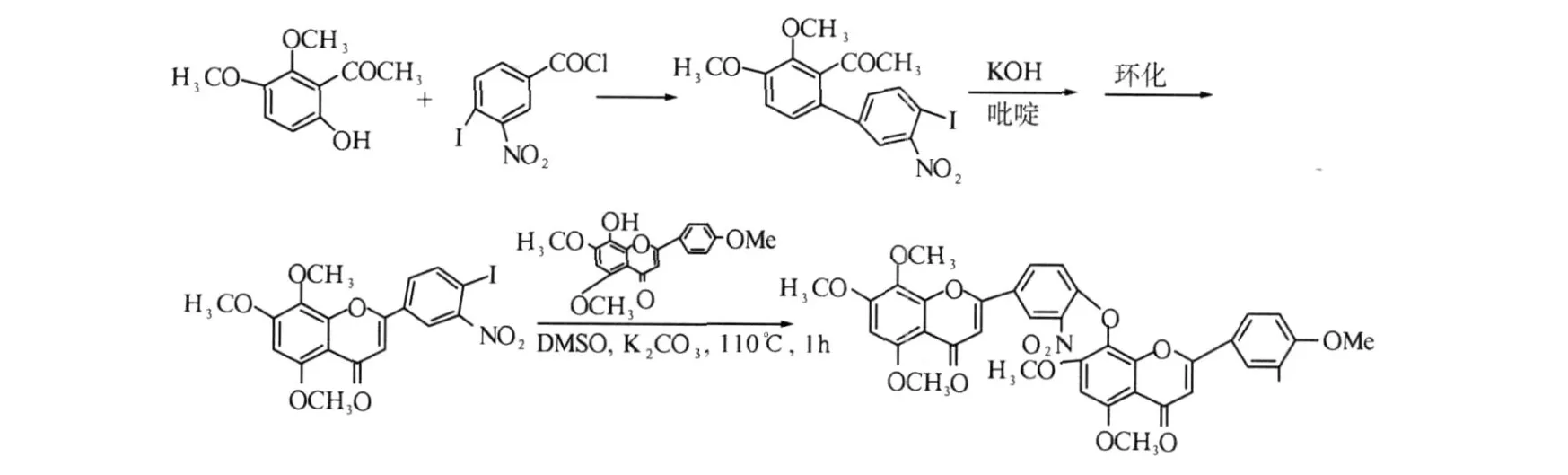
图9 通过 Suzuki偶联反应合成以 C4′—O—C8″方式连接的双黄酮
从文献报道来看,一般是先合成黄酮,然后将2分子黄酮偶联,合成双黄酮.主要是利用 Ullmann反应将 2个黄酮联接起来,或者先合成联苯或二苯醚,然后经酰化、缩合或 Baker-venkataraman重排来合成双黄酮类化合物.这些合成方法步骤较多,条件较苛刻 (低温,强碱),羟基需保护.
1.3 通过 C—C—C键相连接的双黄酮化合物
关于通过 C—C—C键连接的双黄酮化合物(即 2个黄酮分子通过亚甲基相连)的文献报道比较少,Gloria等[34]从 Pentagramm a Triagularis ssp.中分离得到 pentagrametin和 trianguletin,前者是通过亚甲基将黄酮醇和二氢黄酮醇化合物通过C8—C8连接,后者是一个黄酮醇和查耳酮通过C8—C8连接.另外 ,赵春超等[35],Roit man等[36]从蓬莱籽中分离得到一个新化合物 3,5,7,3′,4′,3″,5″,7″,3″′,4′″-十羟基 -[8-CH2-8]双黄酮.
通过 C—C—C键连接的双黄酮化合物用化学方法合成的更少.Al-Maharik等[37]通过 2-溴环丙烷 -7,4′-二甲氧基异黄酮和氰基乙酸乙酯或四乙基氰化胺反应得到 C—C连接的双异黄酮.研究表明,该双黄酮具有抑制癌细胞、扩张外周血管等药理活性.反应过程如图 10所示.
张尊听等[38]采用半合成的方法,分别以芒柄花素、白杨素、3′,5′-二异丙基 -7,4′-二羟基异黄酮和 7-羟基异黄酮为原料合成了一系列均由2个相同的黄酮分子通过亚甲基连接在一起的结构对称的双黄酮,产率为 76%~92%,并研究了它们与小牛胸腺 DNA(ct-DNA)的弱相互作用,结果表明此类双黄酮结构中如 C环上存在取代基,会增强双黄酮与 DNA的亲和力.初步推测,8-(5,7-二羟基黄酮 )-8′-(7′-羟基 -4″-甲氧基异黄酮)甲烷和 8,8-亚甲基 -双 (7-羟基 -4′-甲氧基异黄酮)可能以部分插入的方式与 DNA发生作用,且对 DNA-EB的荧光猝灭方式为静态猝灭.为将此类双黄酮开发成以 DNA为靶标的新药和提高此类双黄酮潜在的药物活性提供了试验依据,反应过程如图 11所示.

图11 双黄酮的半合成路线
1.4 通过 C—C或 C—O—C键 2个位置形成环状连接的双黄酮化合物
通过 2个键连接形成的双黄酮化合物主要是从植物中提取的,Seeger等[39-40]于 1991年从苔藓属植物梨蒴珠藓 (Bartram ia pom ifor m is)中发现了一种双黄酮 anhydrobartramiaflavone(见图 12),其连接方式为一个黄酮单元的 C8和 C2′位与另一个黄酮单元的 C8和 C2′位相连,而化学合成未见报道.

图12 anhydrobartramiaflavone结构
2 展望
综上所述,双黄酮类化合物主要从植物中提取,步骤一般是先用丙酮、乙酸乙酯、乙醇、甲醇、水或极性较大的混合溶剂粗提,回收溶剂、浓缩成浸膏后,再用溶剂萃取、碱提酸沉、炭粉吸附法等方法初步精制,其中常用的方法是溶剂萃取法.主要存在的问题是提取工艺效率低、资源浪费严重、产物分离困难.
双黄酮化学合成的较少,一般是先合成黄酮,然后将 2个黄酮分子偶联,合成双黄酮.化学方法目的性强,关键的偶联步骤多采用 Ullmann反应.不同的是,如先合成联苯则只能得到对称连接的双黄酮,采用碘代黄酮偶联则可合成不对称或对称的双黄酮.其缺点是合成路线较长、反应收率较低、产物不易分离.因此,探索合成不对称双黄酮的新方法是进一步深入研究的方向.
双黄酮化合物药理活性显著、具有广泛的应用前景.但该类化合物结合方式较多、结构复杂,所以探索新的合成方法以提高双黄酮产量具有深远的意义.
[1] Woo E R,Lee J Y,Cho I J.Amentoflavone inhibits the induction of nitric oxide synthese by inhibiting NF-κB activation in macrophages [J]. PharmacolRes,2005, 51:539-546.
[2] Kang S S,Lee J Y,Choi Y K,et al.Neuroprotective effects of naturally occuring biflavonids[J].Bioorg Med Chem Lett,2005,15:3588-3591.
[3] Lin YM,Anderson H,FlavinM T,et al.In vitro anti-H I V activity of biflavoniods isolated fromRhus succedaneaandGarcinia m ultiflora[J].J Nat Prod,1997,60:884-888.
[4] Pan X L,TanN H,Zeng G Z,et al.Amentoflavone and its derivatives as novel natural inhibitors of human cathepsin B[J].Bioorg Med Chem,2005,13:5819-5825.
[5] LiuW K,Cheung F W,Liu B P,et al.Involvement of p21 and FasL in induction of cell cycle arrest and apoptosis by neochamaejasmin A in human prostate LNCaP cancer cells[J].J Nat Prod,2008,71:842-846.[6] Campbell C T,Aich U,Weier C A,et al.Targeting pro-invasive oncogenes with short chain fatty acid-hexosamine analogues inhibits themobilityofmetastaticMDA-MB-231 breast cancer cells[J].J Med Chem,2008,51:8135-8147.
[7] Inatomi Y,Iida N,Murata H,et al.A pair of new atropisomeric cupressuflavone glucosides isolated fromJuniperus comm unisvar.depressa[J]. Tetrahedron Lett,2005,46(38):6533-6535.
[8] 张培成,黄酮化学[M].北京:化学工业出版社,2008:142-145.
[9] Itoigawam,Ito C.A new biflavonoid from Calophyllum panciflwith antitumor-promoting activity [J]. J NatProd, 1999, 62(12):1668.
[10]Sakasai M,Fukui H,Yamane H.et al.A new class of biflavonoids 2-hydroxygenistein dimmers from the roots ofwhite lupin[J].Z Naturforsch C:Biosci,2000,55:165.
[11]Lee M K,L im SW,Yang H,et al.Osteoblast differentiation st imulating activity of biflavonoids fromCephalotaxus koreana[J].Bioorg Med Chem Lett, 2006, 16:2850-2854.
[12]YamaguchiL F,Vasso D G,Kato M J.et al.Biflavonoids from Brazilian pineA raucaria angustifoliaas potentials protective agents against DNA damage and lipoperoxidation[J].Phytochem,2005,66:2238-2247.
[13]Sasaki H,Miki K,Kinoshita K.et al.β-Secretase(BACE-1)inhibitory effect of biflavonoids[J]. Bioorg Med Chem Lett,2010,20:4558-4560.
[14]Koichi N. Syntheses of nuclear-substituted flavonoids and allied compounds IX:Syntheses of tetramethyl ether and dimethyl ether of ginkgetin[J].Chem Pharn Bull,1962,10:1032-1038.
[15]Xue SM,Shi P X,Xiao TL.Total synthesis of bilobetin and isoginkgetin[J].Chin Chem Lett,1997,17(8):701-704.
[16]MullerD,Fleury J P.A new strategy for the synthesis of biflavonoids via arylboronic acids[J]. Tetrahedron Lett, 1991, 32:2229-2232.
[17]潘苏华,戴中林.异银杏双黄酮对血小板功能的影响[J].中药新药与临床药理,1992,3(2):42.
[18]Lian Y,Zhao P L.Total synthesis of several 8,8″-Biflavones[J]. Chin Chem Lett,1998,9(4):351-352.
[19]Yu L L,Fang J Z.Study on the synthesis of some new biflavonoids V III:A new synthesis of C3-linked biflavones,bithioflavones and bithiochromones[J]. Synthetic Conunun,1993,23(8):1075-1080.
[20]Koichi N,Manzo I.Synthesis of ginkgetin[J]. Tetrahedron Lett, 1962, 3(8):317-319.
[21]周荣汉.药用植物化学分类学 [M].上海:上海科技出版社,1998:76-78.
[22]祝介平,王茜,李裕林,等.双黄酮类化合物的合成研究 IV:3,3′-双黄酮的合成 [J].化学学报,1990,48(2):190-194.
[23]MachadoM B,Lopes L X.Chalcone-flavone tetramerand biflavones from A ristolochia ridicula [J]. Phytochem, 2005, 66:669-674.
[24]Kamiya K,Satake T.Chemical constituents ofB aeckea frutescensleaves inhibit copper-induced low-density lipoprotein oxidation[J].Fitoterapia,2010,81:185-189.
[25]EloManga S S,Tih A E,Ghogomu R T,et al.Biflavonoid constituents ofCam pylosperm um m annii[J].Biochem Syst Ecol,2009,37:402-404.
[26]Zheng X,MengW D,Qing F L.Synthesisof gem-difluoromethylenated biflavonoid via the Suzuki coupling reaction[J]. Tetrahedron Lett,2004,45(43):8083-8085.
[27]Moon T C,Quan ZL,Kim J S,et al.Inhibitory effect of synthetic C-C biflavones on various phospholipase A2s activity[J].Bioorg Med Chem Lett,2007,15:7138-7143.
[28]Chen J J,Chang H W,Kim H P,et al.Synthesis of phospholipase A2 inhibitory biflavonoids[J].BioorgMed Chem Lett,2006,16:2373-2375.
[29]WenigerB,Vonthron-Sénécheaua C,Arango G J.A bioactive biflavonoid fromCam pnosper m a panam ense[J]. Fitoterapia,2004,75:764-767.
[30]XuM F,Shen L Q,Wang KW.A new biflavonoid fromDaphniphyllum angustifolium Hutch [J]. Fitoterapia, 2009, 80:461-464.
[31]Lee J Y,Choi Y J,Woo E R.Isocryptomerin,a novel membrane-active antifungal compound fromSelaginella tam ariscina[J].Biochem Biophys Res Commun,2009,379:676-680.
[32]Che H Y,Park B K,Lim H,et al.Synthesis of biflavones having a 6-O-7″linkage and effects on cyclooxygenase-2 and inducible nitricoxide synthase[J].Bioorg Med Chem Lett,2009,19:74-76.
[33]Koichi N.Synthesis of hinokiflavone[J].Tetrahedron Lett,1967,8(51):5223-5225.
[34]Siliva G,Chai H,Gupta M P,et al.Cytotoxic biflavoniods fromSelaginella W iudenow ii[J].Phytochemistry,1995,46(1):129-134.
[35]赵春超,邵建华,李铣.蓬子菜中的一个新双黄酮 [J].中国药物化学杂志,2006,16:386.
[36]Roitman J N,Wong R Y,Wollenweber E.Methylene bisflavonoids from frond exudate of Pentagramm a triangularis ssp triangularis[J].Phytochem,1993,34:297-302.
[37]Al-MaharikN I,Kaltia SA,Mutikainen I,et al.Synthesis of C-C-bridged bis-isoflavones[J].J Org Chem,2000,65:2305-2308.
[38]张尊听,高润莉,庄素凯.双黄酮的合成及其与DNA的作用 [J].药学学报,2009,44(8):873-878.
[39]Seeger T,Geiger H,Zins meister H D.Bartramiaflavone,a macrocyclic biflavonoid from the mossB artram ia pom ifor m is[J].Phytochem,1991,30:1653-1656.
[40]Seeger T,Geiger H,Zinsmeister H D.Isolierung und Strukturaufklärung von Bartramia-Triluteolin,Bartramiasaure und einigen Biflavonoiden aus dem Laubmoos Bartramia pomiformis[J].ZNaturforsch C:J Biosci,1992,47c:525-530.
RESEARCH PROGRESS ON THE EXTRACTION AND SYNTHESIS OF B IFLAVONO ID COMPOUNDS
XUE Ying,QU Ling-Bo,YUAN Jin-Wei
(School of Chem istry and Chem ical Engineering,Henan University of Technology,Zhengzhou450001,China)
Biflavonoid compounds have diverse combination manners and complex structure,and also have multiple phar macological activities,such as anticancer,antivirus,anti-inflammatory and antioxidant activities.According to the different connection manners bet ween biflavonoid molecules,the paper reviewed the extraction,the synthesis and the biological activity of the biflavonoid compounds,and summarized the development tendency and the application prospect.
biflavonoid compound;structure;synthesis;extraction;biological activity
TS201.2
A
1673-2383(2010)06-0078-08
2010-10-08
薛颖(1983-),女,山东临沂人,硕士研究生,研究方向为生物质的开发与利用.
*通信作者
