铁棍山药水溶性多糖的超声波提取工艺及体外抗氧化活性的研究
2010-09-29何培新郑俊丽
魏 涛,何培新,郑俊丽
(郑州轻工业学院食品与生物工程学院,河南郑州 450002)
铁棍山药水溶性多糖的超声波提取工艺及体外抗氧化活性的研究
魏 涛,何培新,郑俊丽
(郑州轻工业学院食品与生物工程学院,河南郑州 450002)
研究超声波辅助提取铁棍山药水溶性多糖的最佳工艺条件,并对所提取的粗多糖进行了体外自由基抗氧化性活性研究.结果表明,超声波辅助法的最佳工艺条件为:超声波功率 800 W,提取温度 60℃,超声时间 30 min,料液比为 1︰30.在此最佳工艺条件下,粗多糖得率为 4.6%.体外抗氧化性试验表明,所提取粗多糖具有清除和OH自由基的能力,其中对清除率达到 93.75%.
铁棍山药;多糖;超声提取;抗氧化性
0 引言
山药 (D ioscorea oppositaThunb),又名白菩、土薯、大薯、薯药,为薯蓣科 (D ioscoreaceae)山药属(D ioscroreal),薯蓣科多年生草本植物,营养丰富,具有很高的药疗价值.《本草纲目》记载:山药性温、味甘平、无毒,健脾胃、益肺肾、涩精止泻;山药还具有抗衰老、抗氧化、提高应激力、增强免疫力、降血脂、抗肿瘤、抗突变等功效[1].近年来的研究表明,山药中起药效作用的主要成分是山药多糖[2-4].目前,山药多糖的提取主要采用水提法,该方法操作简便,但浸提周期长,多糖得率低.与传统水提法相比,超声波提取法可利用空化作用加速细胞壁破碎,促进多糖溶出,缩短提取时间.本研究采用超声波处理的方法,在单因素试验基础上采用正交试验得出提取铁棍山药多糖的最佳工艺,并研究了山药多糖在体外对·OH和自由基的清除作用,希望为铁棍山药的进一步研究和开发提供参考数据.
1 材料与方法
1.1 试验材料
新鲜铁棍山药购自河南省焦作市温县.其余试剂均为国产分析纯或生化试剂.
1.2 仪器与设备
JY96—Ⅱ超声波细胞粉碎机:宁波新芝生物科技股份有限公司;RE—52A型旋转蒸发器:上海亚荣生化仪器厂;722型紫外可见光分光光度计:上海分析仪器总厂.
1.3 试验方法
铁棍山药多糖提取工艺流程:山药片→70℃热风干燥→粉碎过 40目筛→石油醚脱脂→80%乙醇回流→超声波辅助水浸提→离心取上清液→Sevage法除蛋白质→浓缩→乙醇沉淀、离心 (醇析法)→乙醇洗涤 →低温干燥 →铁棍山药粗多糖.
干燥的铁棍山药粉碎,过 40目筛,称取 5 g山药粉置索氏提取器中,加入石油乙醚 (60~90℃)150 mL,90℃回流脱脂 5 h;脱脂之后加入80%乙醇,90℃回流 2次 (每次 2 h),除去单糖、多酚、低聚糖和皂苷等小分子物质;乙醇挥发后,按照不同的超声功率、浸提时间、浸提温度和料液比进行单因素提取.将多次重复提取的多糖,用旋转蒸发仪真空浓缩,加 95%乙醇析出多糖,沉淀物用蒸馏水复溶后再加 95%乙醇醇析,反复 3次,将沉淀用无水乙醇洗涤,真空干燥,得山药水溶性多糖.采用 Sevage法去除提取山药多糖中的蛋白质,少量蒸馏水溶解山药多糖,按粗多糖溶液与氯仿 -正丁醇 (体积比为 4︰1)混合液以体积比5︰1混合,充分振荡 30 min静置分层,4 200 r/min离心 15 min,可见凝胶状的蛋白质析出,吸出上清液,进行双缩脲试验,检测有无蛋白,至阴性为止.上清液用再加入 4倍体积的无水乙醇,4℃保持12 h,然后 5 000 r/min离心 15 min,收集沉淀 ,用无水乙醇洗涤 2次,即得脱蛋白山药多糖.
多糖得率的计算方法:
粗多糖得率 =粗多糖的质量 (g)/山药粉的质量(g).
多糖含量的测定采用苯酚 -硫酸法,以葡萄糖为标准样品.
1.4 单因素对山药多糖提取效果的影响
1.4.1 超声功率
在提取时间 30 min,料液温度 60℃,料液比1︰20的条件下,分别采用表1中各功率,提取山药多糖.
1.4.2 料液温度
在超声功率 600 W,提取时间 30 min,料液比1︰20的条件下,分别采用表1中温度,提取山药多糖.
1.4.3 提取时间
在超声功率 600 W,提取温度 60℃,料液比1︰20的条件下,分别采用表1中提取时间,提取山药多糖.
1.4.4 料液比
在超声功率 600 W,提取时间 30 min,提取温度 60℃,分别采用表1中料液比,提取山药多糖.

表1 _铁棍山药多糖提取工艺中各因素与水平_
1.5 多糖抗氧化性测定
1.5.1 山药多糖对·OH的清除作用
利用 Fenton反应产生·OH,采用 2-脱氧 -D-核糖法测定山药多糖对·OH的清除作用:试管中依次加入 0.6 mL KH2PO4-KOH缓冲液 (50 mmol/L,pH 7.4)、0.15 mL一定浓度的多糖溶液、0.15 mL EDTA溶液 (1 mmol/L)、0.15 mL FeCl3(1 mmol/L)、0.15 mL H2O2(12 mmol/L)、0.15 mL 2-脱氧 -D-核糖 (60 mmol/L)和 0.15 mL抗坏血酸(2 mmol/L).然后将试管置于 37℃水浴锅中水浴 1 h,取出后迅速加入 1.5 mL 25%HCl和 1.5 mL 1%硫代巴比妥酸 (TBA),在沸水中加热 20 min后取出,冷却,于 532 nm处测定吸光度值,对照组以蒸馏水代替待测样品.按照下式计算清除率:

采用核黄素 -光照法[6]:用磷酸盐缓冲液(0.05 mol/L,pH 7.8)分别配制 0.1 mmol/L NBT溶液,0.1 mmol/L核黄素溶液,0.1 mol/LL-蛋氨酸溶液.在试管中依次加入 0.075 mL提取多糖样品、0.3 mL NBT、0.15 mLL-蛋氨酸 ,0.15 mL核黄素和 4.4 mL磷酸盐缓冲液,混匀,对照组以蒸馏水代替待测样品.在暗箱光照 30 min之后在560 nm处测定吸光度值.按照下式计算清除率:

2 结果与分析
2.1 单因素试验结果
不同单因素条件下提取的山药多糖含量见图1.由图 1可见,温度的升高有利于山药多糖的提取,这是因为低温不利于植物多糖的溶解,温度达到 80℃,多糖提取率达到最大值;提取时间的延长有利于提取,当提取时间达到 90 min后,多糖提取率变化不明显.随着超声功率的增加,山药多糖提取率不断提高,达到 800 W后,多糖提取率趋于稳定.在料液比 1︰20以后,增加水量对提取效果的影响很小.

图1 单因素不同条件下的山药多糖含量
2.2 正交试验结果
在单因素试验基础上,以超声功率、提取温度、提取时间和料液比做 4因素 3水平 L9(34)的正交试验设计,对提取工艺进行优化筛选.

表2 正交试验结果

表3 正交试验结果方差分析
从极差结果得出影响多糖提取率的因素大小为 RA>RC>RD>RB,即提取温度 >超声功率 >料液比 >提取时间.方差分析结果表明,提取温度对山药多糖提取率影响显著;超声功率、提取时间和料液比对山药多糖提取率影响不显著.因此,最佳提取条件为 A2C2D3B1,即超声功率 800 W,提取温度为 60℃,提取时间为 30 min,料液比为1︰30.在此条件下提取山药多糖提取率为 4.6%.
2.3 山药多糖对·OH的清除作用
羟自由基的化学性质极为活泼,也是毒性最大的自由基,可以与多种有机物或无机物反应.铁棍山药多糖对·OH作用效果见图 2.随着多糖质量浓度的增加,·OH的清除率逐步提高,当多糖的质量浓度为 16 mg/mL时,·OH的清除率达到53.81%.

图2 山药多糖对羟基自由基清除效应
2.4山药多糖对的清除作用
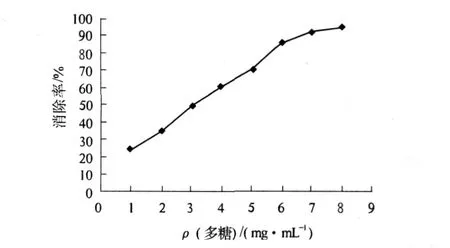
图3 山药多糖对超氧阴离子自由基清除效应
3 结论
本研究在超声波功率、超声波辅助时间、提取温度、料液比各单因素试验基础上,采用正交试验得出了超声波辅助提取山药多糖的最佳工艺条件,即超声波功率 800 W,提取温度 60℃,超声时间 30 min,料液比 1︰30.采用该工艺提取铁棍山药多糖,山药多糖得率为 4.6%,比文献报道的高出 3倍多[7-8],提取时间也缩短 20 min,这主要因为超声波的空化作用、热效应、机械作用可加速细胞壁破碎,促进胞内多糖溶出,缩短了提取时间.铁棍山药多糖具有较好的抗氧化活性,对·OH和自由基的清除率可分别达到53.81%和93.75%.因此,采用此工艺提取山药多糖对实际生产和山药多糖药用价值研究有一定的指导意义,但多糖的纯化有待进一步研究.
[1] 李时珍.本草纲目 (下册)[M].北京:人民卫生出版社,1982:1676-1679.
[2] 詹彤,陶靖,王淑如.水溶性山药多糖对小鼠的抗衰老作用 [J].药学进展,1999,23(6):356-360.
[3] 张忠泉,陈百泉,许启泰.山药多糖对大鼠血糖及胰岛素释放影响的研究[J].上海中医药杂志,2003,37(10):52-53.
[4] 赵国华,王赟,李志孝,等.山药多糖的免疫调节作用 [J].营养学报,2002,24(2):187-188.
[5] 舒媛,刘安军,王丽霞.山药多糖结合蛋白对抗氧化作用的影响[J].食品研究与开发,2006,27(11):39-42.
[6] 焦中高,刘杰超,王思新,等.黑莓红色素对活性氧自由基和亚硝基的清除作用[J].食品工业科技,2004,25(4):127-128.
[7] 李凤,程道梅,金虹,等.铁棍山药水溶性粗多糖的提取工艺研究 [J].安徽农业科学,2008(11):4556-4557.
[8] 聂凌鸿,宁正祥.广东淮山水溶性多糖的分离纯化及体外抗氧化活性的研究[J].食品科学,2003,24(11):129-133.
ULTRASON IC EXTRACTION TECHNOLOGY OFWATER-SOLUBLE POLYSACCHAR IDES FROMD IOSCOREA OPPOSI TATHUNB.CV.TIEGUN AND IN V ITRO ANTI-OXIDANT ACTIV ITY
WEI Tao,HE Pei-xin,ZHENG Jun-li
(School of Food and B ioengineering,Zhengzhou University of L ight Industry,Zhengzhou450002,China)
The paper studied the optimal conditions for ultrasonic-assisted extracting water-soluble crude polysaccharides fromD ioscorea oppositaThunb.CV.Tiegun,and studied the in vitro antioxidant activities of the crude polysaccharides.The results showed that the optimal conditions were as follows:ultrasonic power 800 W,extraction temperature 60 ℃,ultrasonic t ime 30 min,and solid-liquid ratio 1︰30;and the yield of the crude polysaccharides reached 4.6%.The in vitro antioxidant test showed that the crude polysaccharides could scavengeand·OH free radicals,and thescavenging rate reached 93.75%.
D ioscorea oppositaThunb.CV.Tiegun;polysaccharide;ultrasonic extraction;antioxidant activity
TS201.2
B
1673-2383(2010)06-0025-04
2010-09-04
河南省重点科技攻关项目 (102102210063);郑州轻工业学院博士科研基金(000544)
魏涛(1980-),男,河南焦作人,讲师,研究方向为食品生物技术.
