热应激对兔垂体和下丘脑CAT与SOD水平的影响*
2010-09-26李德喜杨淑华何剑斌
李德喜,杨淑华,何剑斌
(沈阳农业大学畜牧兽医学院,辽宁沈阳 110161)
热应激能在短时间内向高温转换所诱导出的一种固定的应激反应,以维持动物机体自身生理平衡,防止细胞受到应激环境的过度伤害,保护细胞免受应激环境变化而造成的损伤[1-2],从而诱发细胞中活性氧增加,超氧阴离子自由基(O-2)、过氧化氢(H2 O2)等具有较强的氧化能力,对生物体内大分子产生破坏。而超氧化物岐化酶(superoxide dismutase,SOD)、过氧化氢酶(caltalase,CAT)通过体内的协同作用,能有效的清除O-2·、H 2O2[3]。试验选用了能间接反映体内氧化水平的SOD与CAT进行分析,来研究热应激对家兔机体损害程度和体内自由基的清除能力[4]。
1 材料与方法
1.1 材料
1.1.1 主要仪器与试剂 722可见分光光度计,上海仪器分析总厂;考马斯亮兰蛋白质含量测定试剂盒,南京建成生物工程研究所;CAT活力测定试剂盒,南京建成生物工程研究所;SOD活力测定试剂盒,南京建成生物工程研究所。
1.1.2 实验动物与分组 选健康3月龄新西兰兔60只,随机为 3组,每组20只,预饲1周后,置于自制人工气候室内。高温组温度控制在39℃~41℃,低温组32℃~34℃,对照组采用室温,相对湿度控制在56%~60%。
1.2 方法
1.2.1 测定指标与样品处理 分别在热应激后15、30、45、60 d每组随机选取5只新西兰兔,心脏采血处死后,迅速取出垂体与下丘脑,冰浴下研磨组织并制成100 g/L组织匀浆液。采用比色法测定SOD。其中SOD的测定方法采用黄嘌呤氧化酶法,具体测定步骤及计算公式均按照试剂盒说明书进行。
1.2.2 数据处理 用SPSS13.0软件对试验数据进行一般线性模型(GLM)分析;统计结果以平均数±标准差表示。
2 结果
2.1 下丘脑与垂体中CAT的活性测定结果
2.1.1 下丘脑CAT的活性 如表1所示,随着时间的延长,常温对照组下丘脑CAT活性变化不明显;低热组15 d与 30 d对比不显著、与45 d和60 d对比差异显著(P <0.05);高热组15 d时与30 d、45 d和60 d对比差异显著(P<0.05)。随着应激温度的升高,下丘脑中CAT的活性呈降低趋势,且同一时间点CAT活性组间比较差异显著(P<0.05)。
2.1.2 垂体CAT活性 如表2所示,随着时间的延长,常温对照组与低热组垂体CAT活性变化不明显,组内各时间点CAT活性比较差异不显著(P>0.05);高热组在 15、30、45、60 d 比较CAT 活性差异显著(P<0.05);低热组和高热组CAT活性均呈降低趋势。随着温度的升高,垂体组织CAT浓度呈降低趋势。各时间点组间CAT活性比较差异显著(P<0.05)。
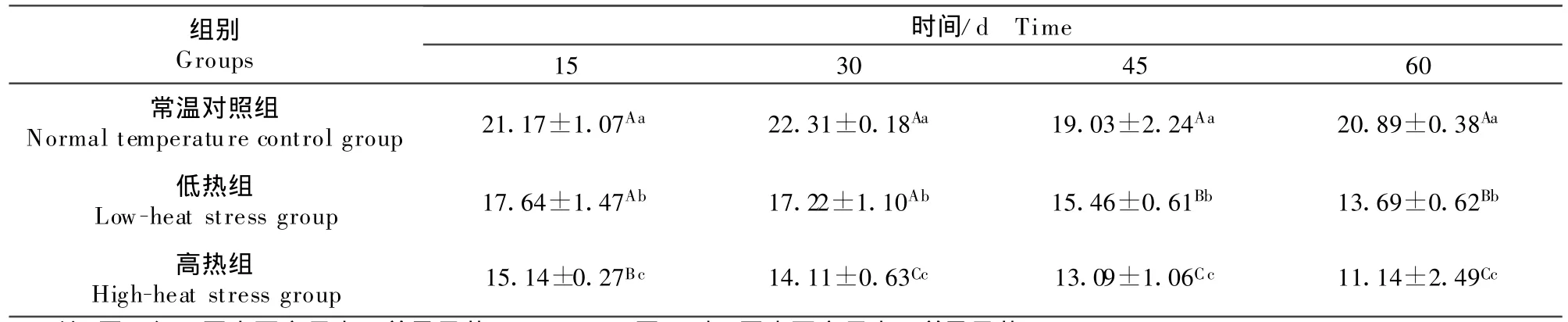
表1 热应激对兔下丘脑CAT活性的影响Table1 Effect of heat stress on CAT activity in hypothalam us U/m g
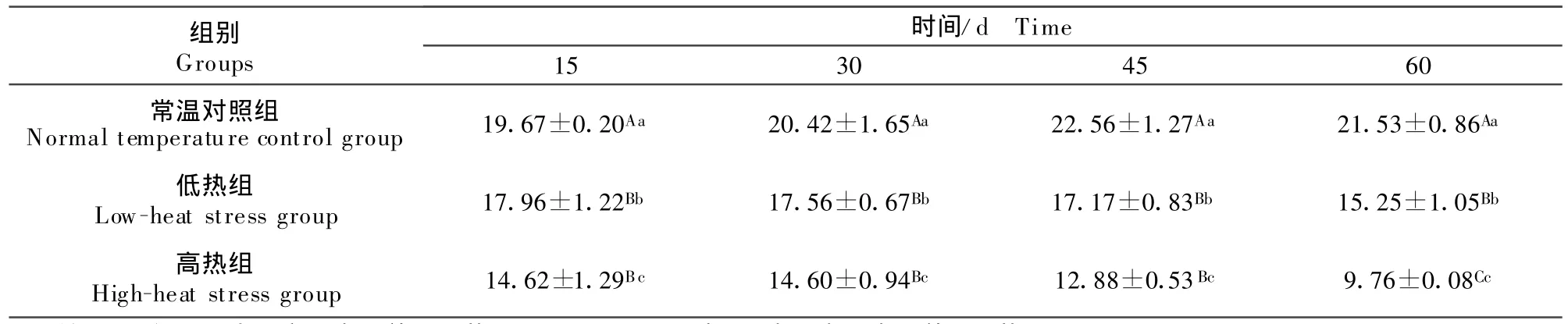
表2 热应激对兔垂体CAT活性的影响Table2 E ffect of heat stress on CAT activity in hypophysis U/m g
2.2 下丘脑与垂体中SOD的活力测定结果
2.2.1 下丘脑中SOD的活性 如表3所示,常温对照组SOD活性变化不明显;低热组与高热组随着应激时间的延长,SOD活性均呈降低趋势,低热组15 d与30 d的SOD活性比较差异不显著(P>0.05),与45 d和60 d比较差异显著(P<0.05);高热组在15 d与其他时间比较差异显著(P<0.05)。随着温度的升高,下丘脑中SOD浓度呈降低趋势,各时间点组间SOD活性比较差异显著(P<0.05)。

表3 热应激对兔下丘脑SOD活性的影响Table3 Effect of heat stress on SOD activity in hypothalamus U/m g
2.2.2 垂体中SOD的活性 如表4所示,随着时间的延长,垂体SOD的活性呈下降趋势。常温对照组在15 d时SOD的活性与30 d比较差异不显著(P>0.05),与45 d和60 d比较差异显著(P<0.05);低热组各时间点对比差异显著(P<0.05);高热组在15 d、30 d与45 d、60 d比较差异显著(P<0.05)。
随着温度的升高,垂体中SOD浓度呈降低趋势。15 d和30 d高热组SOD的活性与常热组和低热组比较差异显著(P<0.05);45 d和60 d常热组与高热组、低热组比较差异显著(P <0.05)。
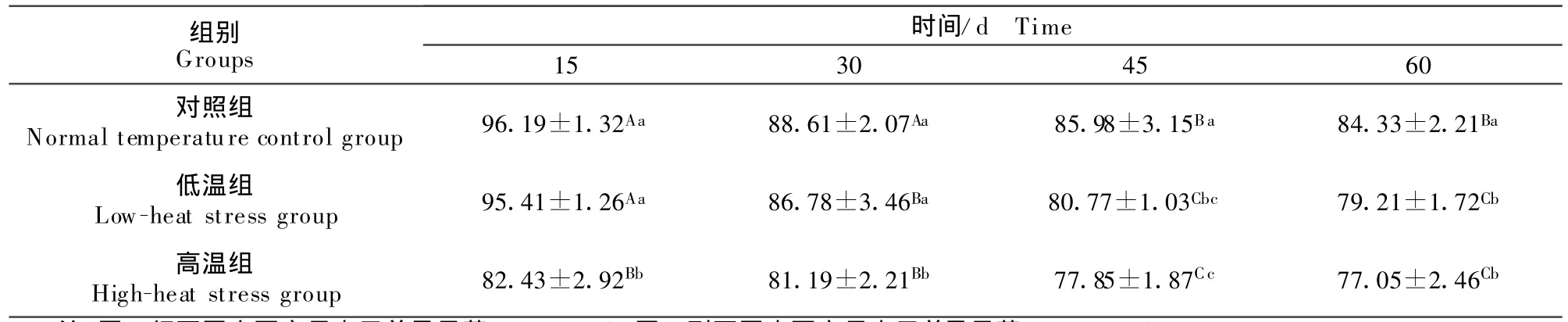
表4 热应激对兔垂体SOD活性的影响Table4 E ffect of heat stress on SOD activity in hypophysis U/m g
3 讨论
在热应激条件下,动物机体代谢过程紊乱,从多种代谢途径产生的氧自由基含量增加,机体由于代谢受阻不能及时清除而积累[5-7]。此外,热应激状态下,细胞能量分解大于合成,从而为氧自由基大量生成提供了条件,并且在缺血状态下,血液和组织中的SOD活性下降,细胞清除氧自由基的能力更显不足,造成氧自由基的堆积[8]。超氧阴离子自由基,是生物体多种生理反应中自然生成的中间产物,具有极强的氧化能力,是生物氧毒害的重要因素之一。超氧阴离子在SOD作用下和氢离子反应,生成过氧化氢;过氧化氢在过氧化氢酶的作用下最终生成水。SOD可以清除超氧阴离子(O-2)而保护动物机体细胞免受损伤,其活力的高低间接反映了机体清除氧自由基的能力[9-10]。抗氧化酶不但能清除组织中过多的活性氧,还维持相对稳定的氧化水平而使细胞免受过氧化损害。SOD、CA T在生物体内的水平高低,能准确地反映体内抗氧化能力。
本试验显示在热应激条件下,同一温度组随着时间的增加,垂体与下丘脑中SOD、CA T的活性呈下降趋势,说明随着热应激时间的延长,兔抗氧化能力有所减弱。此外,在同一时间内,家兔垂体与下丘脑内SOD、CAT的活性高温组显著低于低温组与对照组,SOD与CAT的活性随着温度的升高呈下降趋势。说明随着温度的升高,热应激时间的延长,垂体与下丘脑抗氧化能力降低。这些内分泌器官抗氧化能力的减弱同时影响到家兔的内分泌功能,使热应激的不良影响得以放大。
在本试验中,随着温度的升高,热应激时间的延长,热应激组新西兰兔的垂体与下丘脑中SOD活性和CAT活性与对照组相比显著降低。
[1]董淑丽,王占彬,雷雪芹,等.热应激对动物血液生化指标的影响[J].家畜生态,1998,25(2):54-56.
[2]尹 锋,陈光英,余丝莉,等.热应激对小鼠垂体前叶细胞构筑的影响[J].安徽农业科学,2009,37(9):4052-4053.
[3]W ilesM E,W agner T L,W egliekiW B.Dietary magnesium affects suscep tibility of lipoproteins and tissues to peroxidation inrats[J].Life-Sci,1997,60(3):221-236.
[4]王琤华,瞿明仁,蒋显仁,等.Poultrygrow 250TM对宁都三黄鸡消化酶活性、营养物质消化率、抗热应激、免疫机能及生产性能的影响研究[J].江西农业大学学报,2008,30(4):302-310.
[5]王 灿,王悦妮,李延龙,等.两种热暴露对大鼠脂质过氧化反应的影响[J].沈阳医学院学报,2003,5(4):225-228.
[6]李玉荣.热应激对蛋鸡的影响[J].畜牧兽医杂志,1999(4):17.
[7]赵洪进,郭定宗.硒和维生素E在热应激猪自由基代谢中的作用[J].中国兽医学报,2005,25(1):78-80,56.
[8]邓发清.热应激对泌乳奶牛抗氧化性能及微量元素代谢的影响[J].黑龙江动物繁殖,2008,44(5):61-62.
[9]刘扭湘.我国鸡热应激的研究进展[J].中国家禽,1998(6):41.
[10]Bogin E,Peh H C,Avidar Y,et al.Sex and genotype dependence on the effects of long term high environmental temperatu res on cellular enzyme actiyities from chicken organs[J].A-vian Pathol,1997,26:511-524.
