羟基磷灰石植入皮下组织不同阶段弹性模量的变化
2010-09-25徐莲云侯振德
徐莲云,侯振德,赵 巍,毕 平,王 泓
(1. 天津大学机械工程学院,天津 300072;2. 天津市现代工程力学重点实验室,天津 300072;3. 唐山学院基础部,唐山 063000;4. 天津医科大学生物医学工程系,天津 300070;5. 天津市人民医院骨科,天津 300121)
随着现代生物医学技术与材料科学的发展,人造的骨替代材料越来越多地应用于临床.羟基磷灰石(hydroxyapatite,HA)是人体骨组织的主要无机成分,是最常见的一种生物活性材料.羟基磷灰石是人体内骨和牙齿的主要无机成分,在人体骨骼中起主要的支撑作用[1-2].与骨相同,羟基磷灰石植入人体后也起到承载的作用,因此其力学性质是影响其植入骨后作用效果的重要因素之一.如果羟基磷灰石的弹性模量能与骨较好地匹配,可以避免高弹性模量植入体内引起的应力遮挡对骨吸收的影响[3-4].若弹性模量太小,则起不到承载作用.
为了研究羟基磷灰石植入体内后力学性质的改变规律,笔者将羟基磷灰石植入大白鼠的皮下(与骨组织和软组织接触),分别在 20、40、60和 80,d时取出,采用数字图像相关方法,研究纤维组织对人造羟基磷灰石弹性模量的影响,确定纤维组织在其上生长后的弹性模量变化情况.研究结果显示,植入20,d时羟基磷灰石的弹性模量比植入前增加了 28.83%,20,d之后,弹性模量变化幅度变小.分析认为,当纤维组织附着在羟基磷灰石表面并长入微孔隙后,相当于一层复合材料薄壳包裹在羟基磷灰石植入体表面,从而提高了整体的刚度,之后在软组织表层再生长的软组织的增强作用会逐渐减小.
1 实验原理和方法
实验采用多孔的羟基磷灰石材料(由北京意华健科贸有限公司采用水热交换法制成),孔隙度为 50%,试样尺寸为 2.8,mm×5,mm×12,mm.将试样植入Wistar大白鼠背部右侧肌肉内,每只植入 5个试样,共植入 4只大白鼠.分别在植入 20、40、60和 80,d时,从一只大白鼠体内取出 5个试样,然后用 2.5%戊二醛溶液进行固定,放在调温调湿箱内存放(温度4,℃,湿度85%以上),准备测试其弹性模量.
使用 Insrton3343电子万能实验机(量程为1000,N)对试样施加压力 F.由于试样尺寸太小,无法采用一般引伸计测量变形,本文采用非接触的图像相关方法测量变形[5],即在试样前后表面均需要制上随机细小散斑图作为表面变形信息的载体.用高分辨率 CCD(分辨率为 1,004×1,003像素,Basler A,202,k)采集图像.在试样中部采集图像,以保证图像范围内应变均匀分布.为减少偏心加载的影响,所有试样两端面打磨平整并保持平行,同时试样上端面粘贴一小块橡胶垫实现轴向压缩.实验装置示意见图 1(a).
对试样加初载并采集图像作为变形前的图像,然后对试样缓慢匀速加载(加载速率为 5,N/min).每隔一定的载荷增幅采集一幅图像作为变形后的图像,利用图像相关方法分别计算图像靠近上下边缘水平线的纵向位移 v1和 v2(见图1(b)),2条水平线间的距离为l(单位为像素),纵向线应变为 ε =(ν1−ν2) l.对应地计算出这 2条水平线间对应像素点间的多个纵向位移,然后取平均值,进而计算出纵向线应变ε.这样做不仅减少了随机误差,也消除了载荷 F沿水平方向(即 x 轴方向,见图 1(a))偏心引起的纵向线应变测量误差.为了消除载荷F沿y轴方向(见图1(a))偏心的影响,实际测量时分别对试样前后 2个表面采集图像,取前后 2个表面在相同载荷作用下的应变平均值作为该载荷下纵向线应变ε的最终测量值.由每次采集图像时的载荷 F除以试样横截面面积得到与各应变对应的正应力σ,应用最小二乘法对系列应力σ和应变ε进行线性拟合,其斜率即为弹性模量 E.如前所述,弹性模量 E是两侧结果的平均值.
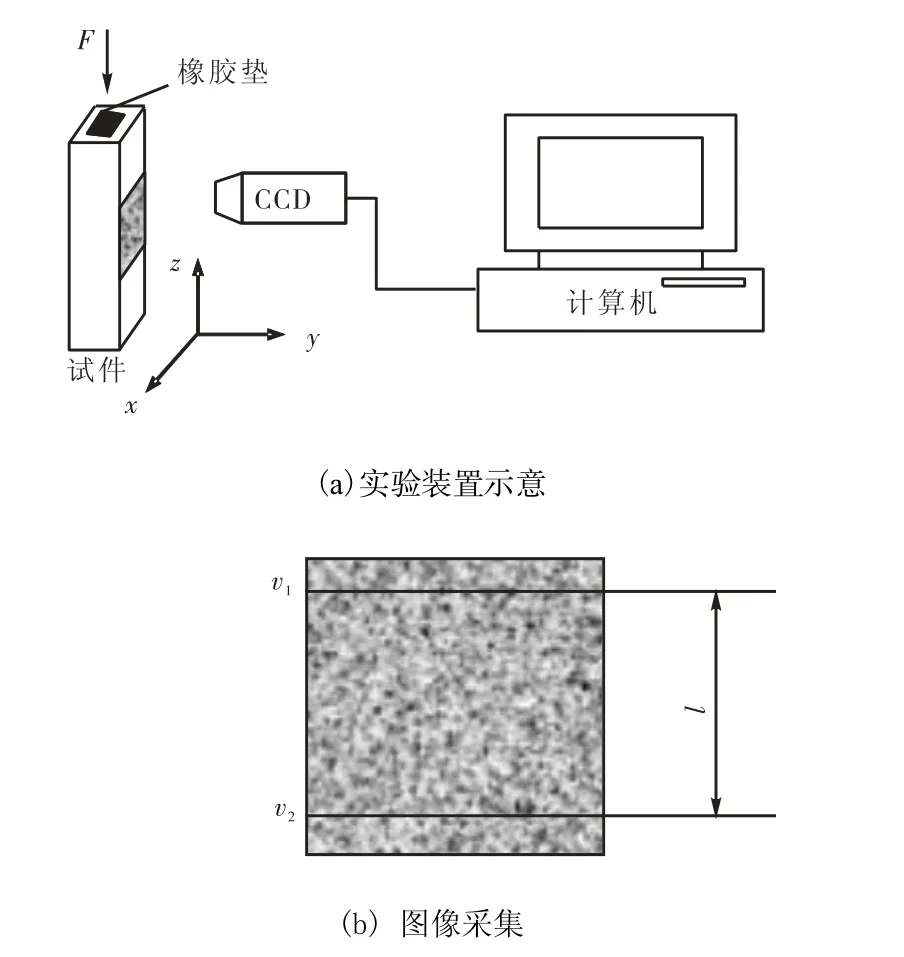
图1 测试系统示意Fig.1 Schematic of measurement system
2 测试结果
表 1分别是羟基磷灰石植入大白鼠皮下前和植入大白鼠皮下组织生长20、40、60和80,d时各阶段5个试样弹性模量,20,d的只成功测试了 4个试样.R是对应力-应变曲线进行线性拟合的相关系数.从表1可以看到,不同阶段各个试样线性拟合的相关系数R均超过了 0.98,说明羟基磷灰石材料的应力-应变曲线具有良好的线性.图 2~图 4分别为羟基磷灰石植入前、植入 20,d和 80,d时试样横断面的扫描电镜照片,可以看出 20,d时孔隙中的软织组相对较少,80,d时有些孔隙中甚至长满了软组织.

表1 试样植入不同阶段时的弹性模量Tab.1 Young′s modulus of samples in different stages after implantation

图2 植入前HA扫描电镜照片(100倍)Fig.2 SEM image of HA before implantation(×100)

图3 植入20,d断面局部扫描电镜照片(100倍)Fig.3 SEM image of HA after implantation for 20 days(×100)

图4 植入80,d断面局部扫描电镜照片(100倍)Fig.4 SEM image of HA after implantation for 80 days(×100)
为便于分析比较,表2为各阶段羟基磷灰石弹性模量的平均值和均方差.羟基磷灰石材料植入大白鼠体内20、40、60和80,d时弹性模量平均值比植入前分别增加了28.83%、28.38%、38.41%和35.99%,图 5为各阶段的平均弹性模量随着植入时间的变化曲线.总体上看,植入20,d的羟基磷灰石的弹性模量比植入前有明显的增加,植入 40,d之后弹性模量相对变化不大.从表 1和表 2还可以看到,植入前测得 5个试样的弹性模量值相对变化不大(方差很小),植入大白鼠后每个阶段试样弹性模量的最大值和最小值相差较大,导致均方差有增加的趋势.原因可能是试样在大白鼠体内的位置不同,导致纤维组织在每个羟基磷灰石的微孔内生长程度不同.
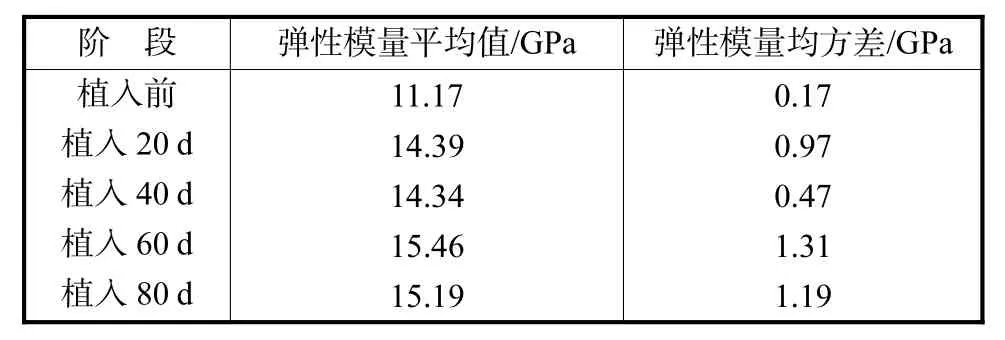
表2 试样植入不同阶段时弹性模量的平均值和均方差Tab.2 Averages and mean-square deviations of Young′s Tab.2 modulus in different stages after implantation
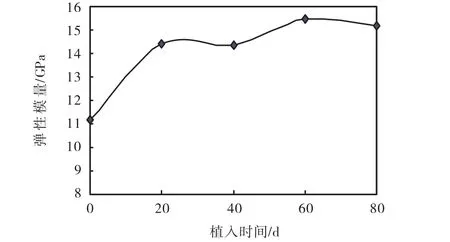
图5 试样植入不同时间弹性模量的变化曲线Fig.5 Variation of Young′s modulus of samples with time after implantation
为了确定试样弹性模量变化的原因,还进行了羟基磷灰石在体外的降解实验,以估计体内的降解程度.将羟基磷灰石放置在 pH=7.4的 PBS缓冲液浸泡,80,d时取出,用蒸馏水浸泡冲洗,真空干燥至恒重,测得其重量损耗率仅为 1.85%,说明此羟基磷灰石在 80,d内的降解速度很慢.文献[6]研究了羟基磷灰石成分与材料的弹性模量的关系,表明弹性模量与羟基磷灰石成分的重量成比例.据此推算,80,d内1.85%重量损耗使弹性模量的减小也应在这一数量范围左右,远小于测得的 28.83%~38.41%增加量.因此,羟基磷灰石弹性模量增加的主要原因应该是胶原纤维在其微空隙内生长导致.
3 结果讨论
图6~图8为羟基磷灰石断面扫描电镜照片.羟基磷灰石孔隙可以分 2个层次,一是宏观孔隙,就是通常意义上适于骨组织生长的孔隙,一般尺寸在50~300,μm甚至更大,如图6所示,另一层次的孔隙是羟基磷灰石微晶粒之间的微孔隙,这些孔隙的尺度在1~10,μm之间,见图7.一般意义上羟基磷灰石骨替代材料的孔隙度指的是宏观层次的孔.如果羟基磷灰石表面(包括宏观孔的表面)附着生长了软组织纤维,这些纤维会长入到羟基磷灰石微晶体周围的微孔隙的内部(见图 8),形成一种复合材料,一定程度上起到了纤维增强的作用.根据图 7,这些微孔是不连通的,纤维长入的长度不会超过 10,μm,可以将长入纤维的羟基磷灰石看作随机分布的短纤维复合材料.
采用横纵纤维相结合的混合律模型[7-8],分析材料增强后的有效弹性模量为
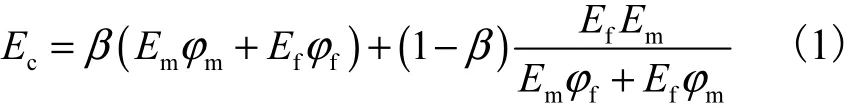

图6 植入前羟基磷灰石宏观孔隙结构(50倍)Fig.6 Macropore structure of HA before implantation(×50)

图7 植入前羟基磷灰石微观孔隙结构(3,000倍)Fig.7 Micropore structure of HA before implantation(×3,000)

图8 纤维组织在羟基磷灰石上附着的结构(1,000倍)Fig.8 Fibrous tissue attached to pore surface of HA(×1,000)
式中:mE和fE分别为基体羟基磷灰石(孔隙度为零时的弹性模量)和纤维的弹性模量;mϕ和fϕ分别为基体和纤维的体积分数;β为应力传递效率系数,反映了纤维方向和应力传递的影响.此处的体积分数mϕ和fϕ都是指微孔隙,它只是标称孔隙度(50%)中的很小一部分.文献[9]确定所研制的羟基磷灰石材料的微孔隙的孔隙率(1~10,μm)约为0.2%.
由文献[10]依据羟基磷灰石的孔隙度(50%)和在此孔隙度的弹性模量测量值为 11.17,GPa(见表 2),可以得Em=44.7,GPa.
假设认为这些微空间中长满了组织纤维,对照骨内胶原纤维的弹性模量 1~2,GPa[11]或 5,GPa[12].若取fE=2,GPa,式(1)是β的线性函数.图9给出当β由0增至0.5,微孔隙率p分别等于 0.2%、0.3%、0.5%和 1.0%时的有效弹性模量的变化.可以看出,相对于零孔隙度时的弹性模量(Em=44.7,GPa),有效弹性模量均有了明显的提高.若微孔隙率为 0.2%,弹性模量(对应β由0~0.5)增加1.96~1.48倍;若微孔隙率为0.3%,弹性模量增加 1.94~1.47倍;0.5%时为 1.90~1.45倍;1.0%时1.81~1.40倍.
可以说当软组织纤维附着到羟基磷灰石表面后或填满微孔隙后,会明显增加其表层的弹性模量.这种增强后的复合材料相当于一层薄壳包裹在羟基磷灰石的表面,从而提高了总体材料的刚度.而当软组织的自身继续生长增加时,新的组织纤维在原组织纤维的表层生长就不会再向羟基磷灰石内部继续生长,即当软组织纤维长入到羟基磷灰石表面的微孔隙中时会对材料起到增强作用,而纤维在软组织表层再生长时增强作用就会减弱.所以,尽管80,d时有些孔隙中几乎充满了软组织,但是弹性模量增加的程度仍低于20,d的数值.
还应指出,植入骨缺损部位的羟基磷灰石与骨接触的部位会长入骨组织,而与软组织接触的部位会长入软组织.所以,植入的羟基磷灰石最终的力学性质既受骨组织的影响也受软组织的影响.
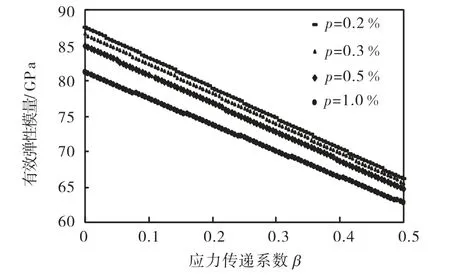
图9 不同微孔隙时试样表面薄层有效弹性模量随应力传递系数变化曲线Fig.9 Variation of effective Young′s modulus of thin layer on specimen surface versus stress transfer coefficient with different porosities
4 结 论
(1)羟基磷灰石植入大白鼠皮下 20,d时的弹性模量有明显增加,增加幅度为 28.83%,之后弹性模量变化幅度不大.
(2)羟基磷灰石弹性模量增加的主要原因是胶原纤维在其微空隙内生长导致的.最初的组织纤维附着在羟基磷灰石的微孔中,形成一种复合材料起到了纤维增强的作用,之后软组织表面再生长的软组织增强作用会逐渐减弱,因此植入 20,d的羟基磷灰石的弹性模量比植入前有明显的增加,植入 40,d之后弹性模量相对变化不大.
[1] 朱 武,朱东波,周柯朝,等. 羟基磷灰石复合骨替代材料的研究现状与发展趋势[J]. 材料导报,2005,19(11):344-347.
Zhu Wu,Zhu Dongbo,Zhou Kechao,et al. Hydroxyapatite bone replacement composites:Current status and future directions[J]. Materials Review,2005,19(11):344-347(in Chinese).
[2] Heise U,Osborn J F,Duwe F. Hydroxyapatite ceramic as a bone substitute[J]. International Orthopaedics,1990,14(3):329-338.
[3] 赵俊亮,付 涛,憨 勇,等. 碳纤维增强羟基磷灰石/环氧树脂复合材料的制备与力学性能[J]. 材料科学与工程学报,2003,21(5):640-643.
Zhao Junliang,Fu Tao,Han Yong,et al. Preparation and mechanical properties of carbon fiber reinforced HA/epoxy composites[J]. Journal of Materials Science&Engineering,2003,21(5):640-643(in Chinese).
[4] 黄福龙,戴红莲,单学智,等. HA/PDLLA 复合材料的体内成骨过程研究[J]. 中国生物医学工程学报,2007,26(2):282-288.
Huang Fulong,Dai Honglian,Shan Xuezhi,et al.Study on bone formation process of HA/PDLLA composites in vivo[J]. Chinese Journal of Biomedical Engineering,2007,26(2):282-288(in Chinese).
[5] 赵 巍,侯振德,任朝峰,等. 皮下组织对羟基磷灰石力学性质的影响[J]. 力学与实践,2008,30(6):77-80.
Zhao Wei,Hou Zhende,Ren Chaofeng,et al. Influence of subcutaneous tissue on mechanical properties of hydroxyapatite[J]. Mechanics and Engineering,2008,30(6):77-80(in Chinese).
[6] Ang K C,Leong K F,Chua C K,et al. Compressive properties and degradability of poly(E-caprolatone)/hydroxyapatite composites under accelerated hydrolytic degradation[J]. Journal of Biomedical Materials Research-Part A,2007,80(3):655-660.
[7] Doan T-T-Ln,Gao S-L,Mader E. Jute/polypropylene composites I. Effect of matrix modification[J]. Composites Science and Technology,2006,66(7/8):952-963.
[8] Joseph P V,Mathew G,Joseph K,et al. Mechanical properties of short sisal fiber-reinforced polypropylene composites:Comparison of experimental data with theoretical predictions[J]. Journal of Applied Polymer Science,2003,88(3):602-611.
[9] Hornez J-C,Chai F,Monchau F,et al. Biological and physico-chemical assessment of hydroxyapatite (HA)with different porosity[J]. Biomolecular Engineering,2007,24(5):505-509.
[10] Ren Chaofeng,Hou Zhende,Zhao Wei. Stiffness compatibility of coralline hydroxyapatite bone substitute under dynamic loading[J]. Science in China Series E:Technological Sciences,2009,52(5):1331-1336.
[11] Gupta H S,Seto J,Wagermaier W,et al. Cooperative deformation of mineral and collagen in bone at the nanoscale[J]. PNAS,2006,103(47):17741-17746.
[12] Siegmund T,Allen Ma R,Burr D B. Failure of mineralized collagen fibrils:Modeling the role of collagen cross-linking[J]. Journal of Biomechanics,2008,41(7):1427-1435.
