甲基叔丁基醚高效降解菌的分离鉴定及其生物强化技术
2010-09-25刘涉江李鑫钢纪志永苏晓叶
刘涉江,李鑫钢,纪志永,苏晓叶
(1. 天津大学环境科学与工程学院,天津300072;2. 天津大学化工学院,天津300072)
甲基叔丁基醚(methyl tert-butyl ether,MTBE)在生产、运输、储存过程中由于泄露等原因,进入汽车发动机的MTBE有3%~10%最终转移到地下环境中,严重威胁土壤和地下水的公共安全.据美国地质勘探局报告指出,MTBE已是城市用水井中第2种常被检出的物质[1].基于MTBE的污染及其对人体潜在的致癌可能性,欧美等发达国家从2000年开始,逐渐限制和停止MTBE的使用,并对其造成的环境污染开展了大量的治理研究工作.目前MTBE的降解处理主要有3种方法:高级氧化技术、植物修复和微生物降解.高级氧化技术[2]由于需消耗大量化学氧化剂和对反应器设计要求高等特点,在用于被MTBE大面积污染的水环境治理时并不理想;植物培养周期长、培养条件苛刻以及植物根须触及的范围有限等缺点,限制了植物修复技术的应用前景[3];近年来随着MTBE降解菌株的发现,MTBE的微生物降解技术备受关注[4-5].然而由于 MTBE的碳链较短且存在一个叔丁基碳,同时存在一个烷基醚键,位阻较大,使得迄今发现的可利用 MTBE为唯一碳源的微生物生长缓慢,其生长速率一般在0.03 mg cells/d以下;同时降解菌的细胞得率也很低,多小于0.43 mg cells/mg MTBE[6],从而造成 MTBE的生物降解速率比一般有机物的降解要慢很多,降解周期几十天甚至上百天的都有过报道[7-8];且根据环境条件的不同,MTBE的最终降解率差别很大[9-10].研究发现,有 MTBE污染的地方常伴随有其他污染物存在(称为共存基质),某种程度上共存基质的存在可能会促进或抑制微生物对目标污染物的降解.Liu等[11]用丁烷氧化菌 Arthrobacter对MTBE污染进行治理时发现,丁烷和乙炔的存在会对该菌降解 MTBE产生负面影响;Hanson等[12]的研究表明,单菌Hydrogenophaga flava ENV735在有少量酵母膏加入时,可显著促进 MTBE的降解,而氢气、氨基酸、维他命、甲醛、CO、烯炳基硫脲或乙炔等对其降解MTBE则不存在任何影响.
在 MTBE污染环境的修复治理时,现场环境中好氧微生物的多少对 MTBE生物降解效果具有重要作用.若土著微生物不适宜污染物的生物降解,或活性不高,则需要通过接种外来优势菌的方法达到修复治理目的.优势菌一方面要经受当地环境的考验,另一方面与土著微生物还存在竞争,因此研究优势菌降解目标污染物的最适宜条件,以便通过工程措施迅速启动生物降解过程,强化生物修复效果显得尤为重要.笔者从长期受石油污染的土著微生物中分离筛选出降解 MTBE的优势菌株,并通过其形态特征和16S rDNA测序的方法进行鉴定;同时考察MTBE降解过程中溶解氧(dissolved oxygen,DO)变化和优势菌株的生长情况,以及通过提高系统的初始溶解氧含量,尤其通过添加常与 MTBE同时出现的其它含碳基质等方法,研究生物强化技术对优势菌株降解MTBE的影响,以期为遭受 MTBE污染环境的修复提供一定的理论依据和应用参考.
1 材料与方法
1.1 菌种富集驯化、分离纯化及鉴定
实验中所用微生物取自天津大港油田长期被石油污染的土壤.将 200,g土壤置于 MTBE初始质量浓度约为 50,mg/L的 2 L无机盐培养基中[13],于30,℃条件下曝气富集驯化培养,每天换一次培养基并补充MTBE;15,d后加大MTBE质量浓度,每天递增 10,mg/L,30,d后经驯化的土著微生物则以 MTBE为唯一碳源;再经 30,d的稳定培养,取菌液接到无机盐固体培养基的平板上,72,h后所得菌落可用于优势菌株的分离纯化.
16S,rDNA扩增及序列测定:从长有优势菌株菌落的斜面上用灭菌牙签挑取部分置于装有 10,µL无菌水(16S-free H2O)的离心管中,99,℃热变性 10,min后进行离心分离,然后取 5~10,µL上清液作模板进行PCR反应.PCR反应体系的试剂及用量如表1所示.正向引物(Seq Forward)为:5’-GAGCGGATAACAATTTCACACAGG-3’;反向引物(Seq Reverse)为:5’-CGCCAGGGTTTTCCCAGTCACGAC-3’.PCR 反应条件为:94,℃预变性 5,min,94,℃变性 1,min,50~55,℃退火 1,min,72,℃延伸 1.5,min,30 个循环,72,℃保温 5,min.使用切胶回收试剂盒(TaKaRa Agarose Gel DNA Purification Kit Ver.2.0,Code No.DV805A)回收纯化 PCR扩增产物,从其上取 1.5,kbp左右的PCR扩增片断,并委托宝生物工程(大连)有限公司进行 DNA测序,测序结果用 BLAST软件与 GenBank中的16S,rDNA序列进行同源性比较.
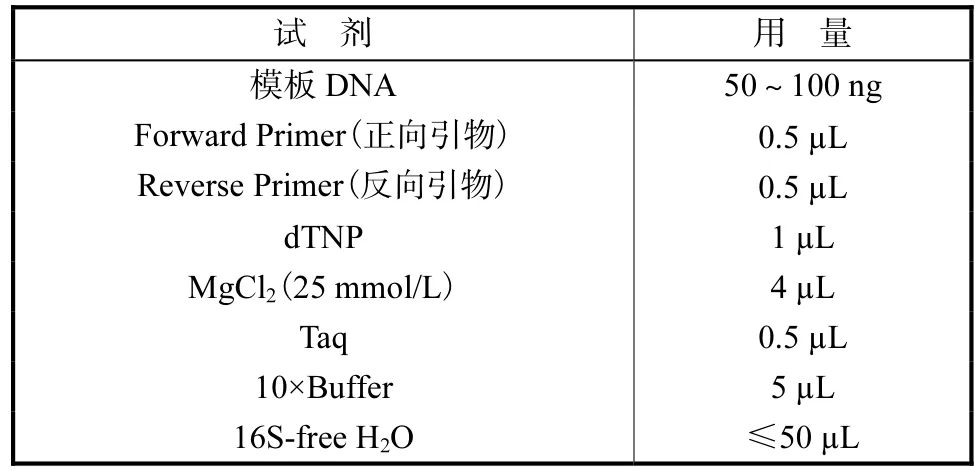
表1 PCR试剂用量Tab.1 Mass of PCR reagent
1.2 生物强化对MTBE降解的影响
(1) MTBE降解过程中DO和菌的浓度(OD600)的变化.在250,mL可密闭的血浆瓶中加入MTBE初始质量浓度约为60,mg/L的无机盐液体培养基(pH=7.0),按 20%的接种量接入优势菌株(OD600为 0.65),液相总体积控制为 100,mL.在温度为 30,℃,转速为150,r/min的摇床内进行培养[14].平行样共9个,从第2,天每隔1,d取一试样按序分析DO和OD600值.
(2) DO对MTBE的强化降解影响.接种20%的优势菌株于无机盐液体培养基(pH=7.0)中,通过向液体注入氮气、空气或氧气以控制不同的初始 DO值,再加入定量的 MTBE,使其初始质量浓度约为60,mg/L,并保持液相总体积为 100,mL.然后在恒温恒转速的摇床中进行培养(30,℃,150,r/min),期间分别测定 MTBE随时间的变化,14,d后对比各自的降解情况.
(3) 共存基质对 MTBE降解的影响.接种 20%的优势菌株于MTBE初始质量浓度约为60,mg/L的无机盐液体培养基(pH=7.0)中,同时在平行样中分别加入苯、甲苯和乙醇,使其初始质量浓度均为50,mg/L左右,并控制液相总体积为 100,mL.在温度为 30,℃,转速为 150,r/min的摇床内进行培养,之后每隔 1,d取样分析,14,d后对比各自的降解情况.其中,各个反应体系的初始DO值约为7.10.
1.3 分析方法
MTBE、苯、甲苯和乙醇浓度的测定采用气相色谱峰面积外标法定量,色谱仪为美国 PE公司AutoSystem XL型.色谱条件:FFAP毛细柱(15,m×0.32,mm×,0.25µm),柱温 105,℃;FID 检测器,温度 300,℃;进样口温度 200,℃,进样量 1,µL.载气流量(N2)0.50,mL/min;氢气流量 45,mL/min;空气流量 300,mL/min;分流比 10∶1;衰减 l.
溶液 DO含量采用美国哈希公司的 sensIONTM6型便携式溶解氧测定仪进行测定.
2 结果与讨论
2.1 优势菌株的形态特征及16S,rDNA分析结果
经过分离纯化后筛选得到一株能以 MTBE为唯一碳源和能源的优势菌株.菌株在无机盐固体培养基平板上生长时,菌落直径为 3~4,mm,圆形,低突起,边缘整齐,表面光滑,有光泽,呈灰白色,见图l(a);细胞粗短杆状,(0.6~0.8)µm ×(1.2~1.6)µm,单独、成双或短链状排列,革兰氏阴性,见图 l(b);氧化酶为阴性.经过测定,获得菌株的 16S,rDNA序列与 GenBank中已登录产酸克雷伯菌(Klebsiella oxytoca,AJ871856)的同源性高达 99%,结合菌株的形态和部分生理生化特征,初步鉴定为 Klebsiella oxytoca.
2.2 生物强化对MTBE降解的影响
2.2.1 MTBE降解过程中DO和OD600的变化

图1 优势菌株的形态Fig.1 Optical microscope of strain
对于好氧生物降解,溶解氧和菌体浓度的变化能够在一定程度上反映有机污染物的去除效果和进程.由图 2可以看出,本文筛选出的优势菌株在降解MTBE过程中,菌的浓度是先增大而后下降直至 8,d后趋于缓慢增长,同时DO伴随OD600的增大呈明显下降趋势;当OD600趋于缓慢增长时,DO的下降也趋于平缓.分析认为,开始阶段实验体系中 DO充足,优势菌株处在对数生长期,具有较快的生长速度;同时由于MTBE发生了好氧生物降解,DO因被大量消耗而迅速下降,使得优势菌株对基质和DO的利用产生竞争,造成部分菌体死亡,OD600下降;当存活菌株对基质和DO的竞争利用程度逐渐趋于平衡时,系统处于正常的代谢和降解状态,表现为 OD600缓慢增长,DO缓慢下降.因此可以设想,若能通过某些工程技术措施保证系统初始DO值较大,且始终维持在一个较高状态时,就能消除溶解氧对优势菌株的限制,从而促进MTBE的生物去除效果.

图2 MTBE降解过程中DO和OD600的变化Fig.2 Variation of DO and OD600 during MTBE degradation
2.2.2 DO对MTBE的强化降解影响
研究表明,微生物在 MTBE污染环境的生长和代谢过程中,氧的作用都是积极的,甚至是必不可少的,而且 DO的大小会直接影响生物修复的效果[15-16].不同初始DO值下,溶解氧对MTBE的强化生物降解情况如图 3所示.结果表明,优势菌株对MTBE的生物去除率随初始 DO值的升高而增大.当初始DO值低于3.2时,菌株对MTBE的降解去除率低于 20%;而当初始 DO值高于 7.4时,去除率就可以达到 50%以上.因此可以断定,在对遭受MTBE污染的环境进行生物修复,尤其是对污染地下水进行原位修复时,考虑到地下水环境中的有限氧含量,更应通过技术手段[17]来提高地下水系统中的 DO含量或控制DO不低于某个值,才能对本文筛选出的优势菌株降解MTBE起到一定的强化作用.

图3 初始DO对MTBE降解的影响Fig.3 Effect of initial dissolved oxygen concentration on,MTBE degradation
2.2.3 共存基质对MTBE降解的影响
一般污染环境中的污染物组分比较复杂,与MTBE相伴的常见有芳香烃或醇类等物质.这些物质的存在可能会对 MTBE的生物降解产生促进或抑制作用.因此可以考虑对 MTBE污染的环境进行共存基质的调整,以达到强化微生物的降解效果.文中以苯、甲苯和乙醇为例,对优势菌株在上述有机物共存时降解 MTBE的情况进行了研究,其影响结果如图4所示.当MTBE与苯或甲苯共存时,优势菌株对MTBE的降解相对于 MTBE单独存在时(MTBE去除率为 50.0%)明显减慢,14,d后的去除率仅分别为37.1%和43.1%,苯对MTBE的抑制作用要强于甲苯;而当 MTBE与乙醇共存时,菌株对 MTBE的生物去除效果增强,14,d后的去除率可达63.3%.分析认为,苯、甲苯和乙醇的存在都会对优势菌株去除 MTBE产生竞争,其代谢机理可能是微生物通过降解易降解的乙醇,产生大量生物所需的能量,增强了关键酶活性,提高了生物氧化率,使得微生物的活性得到增强;而对于苯和甲苯,微生物虽然能降解一定量的该化合物,但其本身或是其降解中间产物可能对菌株的毒性更大,或是产生竞争性抑制[8],限制了微生物对MTBE的生物降解.
针对乙醇对优势菌株降解 MTBE具有一定的促进作用,通过改变共存乙醇的初始浓度,在与上述实验条件相同情况下,进一步考察了乙醇对降解MTBE的影响,其结果如图 5所示.结果表明,当与 MTBE共存的乙醇质量浓度不高于 200,mg/L时,就会对菌株降解 MTBE产生促进作用;但随乙醇浓度的进一步增大,促进作用逐渐减弱.造成此现象的原因可能是乙醇浓度较高时,菌株会优先以乙醇作为生长和代谢的底物,造成电子受体的过多消耗,进而在一定程度上抑制了微生物对MTBE的利用.

图4 共存基质对MTBE降解的影响Fig.4 Effect of coexisting organic compounds on MTBE,degradation
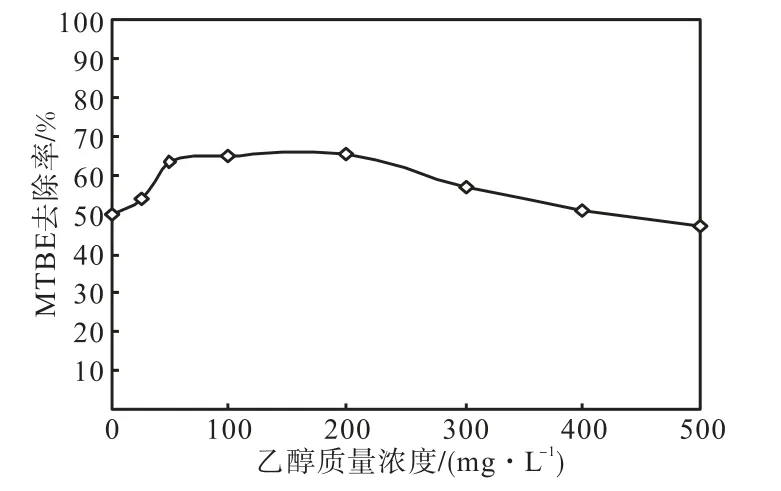
图5 乙醇初始质量浓度对MTBE强化降解的影响Fig.5 Effect of initial ethanol concentration on MTBE bioaugmented degradation
3 结 语
通过对取自天津大港油田的土著菌培养驯化,分离筛选得到的优势菌株经形态学特征和 16S,rDNA测序鉴定,结果为产酸克雷伯菌(Klebsiella oxytoca).采用生物强化措施,提高降解体系中的溶解氧含量可明显改善 MTBE的去除效果;苯和甲苯的存在对Klebsiella oxytoca生物降解MTBE均产生负面影响,苯对 MTBE的抑制作用要强于甲苯;适量的乙醇共存可在一定程度上强化优势菌株对 MTBE的生物降解,实验期间内 MTBE的去除率达到63.3%,上述结果可为遭受 MTBE污染环境的生物强化修复技术应用提供一定的参考.
[1] Anonymous. Health advisory set for fuel oxygenate MTBE [J]. Environ Sci Technol,1998,32(3):83-88.
[2] Li K,Hokanson D R,Crittenden J C,et a1. Evaluating UV/H2O2processes for methyl tert-butyl ether and tertiary butyl alcohol removal:Effect of pretreatment options and light sources [J]. Water Research,2008,42(20):5045-5053.
[3] Ellen R B,Ramaswami A. The potential for phytoremediation of MTBE [J]. Water Research,2001,35(5):1348-1353.
[4] Waul C,Arvin E,Schmidt J E. Long term studies on the anaerobic biodegradability of MTBE and other gasoline ethers [J]. J Hazard Mater,2009,163(1):427-432.
[5] Volpe A,Moro G D,Rossetti S,et a1. Enhanced bioremediation of methyl tert-butyl ether(MTBE)by microbial consortia obtained from contaminated aquifer material [J]. Chemosphere,2009,75(2):149-155.
[6] Stocking A J,Deeb R A,Flores A E,et a1. Bioremediation of MTBE:A review from a practical perspective [J].Biodegradation,2000,11(2/3):187-201.
[7] Fayolle F,Vandecasteele J P,Monot F. Microbial degradation and fate in the environment of methyl tert-butyl ether and related fuel oxygenates [J]. Appl Microbiol Biotechnol,2001,56(3):339-349.
[8] Schirmer M,Butler B J,Church C D,et a1. Laboratory evidence of MTBE biodegradation in Borden aquifer materia1 [J]. J Contam Hydrol,2003,60(3/4):229-249.
[9] Bradley P M,Landmeyer J E,Chapelle F H. Widespread potential for microbial MTBE degradation in surface water sediments [J]. Environ Sci Technol,2001,35(4):658-662.
[10] Schmidt T C,Schirmer M,Weib H,et a1. Microbial degradation of methyl tert-butyl ether and tert-butyl alcohol in the subsurface [J]. J Contam Hydrol,2004,70(3/4):173-203.
[11] Liu C Y,Speitel G E,Georgiou G. Kinetics of methyl t-butyl ether cometabolism at low concentrations by pure cultures of butane-degrading bacteria [J]. Applied and Environmental Microbiology,2001,67(5):2197-2201.
[12] Hanson J R,Ackerman C E,Scow K M. Biodegradation of methyl tert-butyl ether by a bacterial pure culture[J]. Applied and Environmental Microbiology,1999,65(11):4788-4792.
[13] 纪志永,李鑫钢,姜 斌,等. 强化菌株 NERC0401去除水体中的甲基叔丁基醚[J]. 化工进展,2009,28(3):518-521.
Ji Zhiyong,Li Xingang,Jiang Bin,et al. Study on applying intensified technique to remove methyl tert-butyl ether from waters by strain NERC0401 [J]. Chemical Industry and Engineering Progress,2009,28(3):518-521(in Chinese).
[14] 纪志永,李鑫钢,苏晓叶,等. 甲基叔丁基醚降解菌株的分离鉴定及其降解特性[J]. 石油化工高等学校学报,2006,19(4):40-43.
Ji Zhiyong,Li Xingang,Su Xiaoye,et al. Isolation,identification and degradation characteristics of methyl tert-butyl ether(MTBE)degradation strain [J]. J Petrochemical Universities,2006,19(4):40-43(in Chinese).
[15] Francois A,Mathis H,Godefroy D,et al. Biodegradation of methyl tert-butyl ether and other fuel oxygenates by a new strain,Mycobacterium austroafricanum IFP 2012 [J]. Applied and Environmental Microbiology,2002,68(6):2754-2762.
[16] Magar V S,Kristen H,Christy B,et al. Aerobic and cometabolic MTBE biodegradation at Navato and Port Hueneme [J]. J Environ Eng,2002,128(9):883-890.
[17] Liu S J,Jiang B,Huang G Q,et al. Laboratory column study for remediation of MTBE-contaminated groundwater using a biological two-layer permeable barrier [J]. Water Research,2006,40(18):3401-3408.
