六六六在海河沉积物中的自然生物降解
2010-09-25鲁逸人
迟 杰,鲁逸人
(天津大学环境科学与工程学院,天津 300072)
有机氯农药是一类含有氯原子的有机化合物,多为持久性有机污染物,能够通过大气输送的方式进行全球输送,并通过食物链富集的方式对生态环境产生影响.目前有机氯农药污染己经成为一个倍受关注的全球性环境问题.我国于1983年开始禁止生产六六六(HCHs)和滴滴涕(DDT)等有机氯农药,虽然有机氯农药已禁止使用20多年,但环境中仍然能检出有机氯农药残留[1-2].如何有效地减轻或避免农药残留对环境及人类健康的损害已成为亟待解决的问题.
生物降解是多数有机污染物从环境中去除的主要过程.自然环境具有自修复功能,是污染区域长期普遍存在的过程[3],进行这方面的研究有助于了解污染物在环境中的归趋以及增加原位修复的背景知识.目前,大量文献报道多是关于有机氯农药在人为调控下的研究,如不同碳源对降解的影响、降解菌株的分离筛选、降解酶的基因构建等方面[4].
海河是我国华北地区的一条大河,由于水资源严重短缺,加之汛期市政污水排入海河,造成了海河水质污染日益严重,海河水环境中已检测出六六六的存在[2].本文选择 HCHs(α-HCH、β-HCH、γ-HCH、δ-HCH),研究了它们在海河沉积物中自然生物降解,其中包括温度、溶解氧和界面层影响.
1 实 验
1.1 实验方法
取采自海河干流的表层沉积物 230,g(湿重,过2,mm 筛),放到 250,mL锥形瓶中,于 25,℃下避光振荡 1周,沉积物由黑色变成褐色,成为好氧泥.称取好氧泥 200,g(湿重),加到 250,mL锥形瓶中,再加入1,mL的HCHs混合储备液(4种HCH储备液浓度分别为 5,mg/L)和 10,mL灭菌水,用纱布封口,避光振荡培养(140,r/min).
取海河干流的厌氧表层沉积物 200,g(湿重),放入到 250,mL锥形瓶中,加入 1,mL的 HCHs混合储备液和 10,mL灭菌水,通入氮气 10,min,然后密封,避光振荡培养(140,r/min).
上述实验均进行 21,d,按照一定时间间隔取样.另外,在 121,℃下将沉积物高压灭菌 30,min,连续灭菌3,d,设置为无菌对照组.
水/沉积物界面层为取自表层沉积物上的一层稀薄的淤泥[5],实验方法同表层沉积物.
实验结束时测定沉积物中细菌数量[6].
1.2 分析方法
沉积物样品经冷冻干燥后,研碎过 80目筛.取1,g样品,放入离心管中.在离心管中分 2次加入体积比为 1∶1的二氯甲烷和正己烷 5,mL,超声萃取15,min,4,000,r/min离心 5,min.上清液合并移入250,mL具塞锥形瓶中.在锥形瓶中加入活化铜片(经体积比为 1∶1的盐酸、蒸馏水和甲醇处理),振荡14,h脱硫.经脱硫的萃取液,K-D浓缩至 0.5,mL左右,移入硅胶柱净化,然后用体积比为1∶3的二氯甲烷和正己烷 50,mL洗脱,洗脱液用柔和的氮气流吹脱,定容至 1,mL,气相色谱分析测定.每个样品做 3个平行样.
分析仪器为 Agilent6890N 型气相色谱仪,μ-ECD;色谱柱为 Agilent,DB-35,ms气相毛细管柱(30.0,m×0.32,mm×0.25,μm);进样口温度 250,℃;检测器温度 300,℃;N2流量 1.5,mL/min,不分流;进样量 1,μL.采用程序升温,即 160,℃(0.5,min)→15,℃/min→230,℃→10,℃/min→275,℃(3,min).沉积物中 HCHs的平均回收率为 87%~111%,标准偏差为4%~9%.
2 结果与讨论
2.1 六六六在海河表层沉积物中的生物降解特性
温度和溶解氧对六六六在海河表层沉积物中生物降解的影响见图 1~图 4.可以看出,α-HCH、β-HCH、γ-HCH和δ-HCH在培养21 d后的降解率分别为 29.8%~70.9%、19.8%~64.5%、34.6%~78.5%和30.4%~69.8%.对照实验中,21,d后非生物因素引起的 HCHs的衰减率为 1.1%~5.1%,因此,沉积物中HCHs浓度的减少主要是生物降解作用的结果.

图1 α-HCH在表层沉积物中降解曲线Fig.1 Biodegradation curves of α-HCH in surface sediments

图2 β-HCH在表层沉积物中降解曲线Fig.2 Biodegradation curves of β-HCH in surface sediments
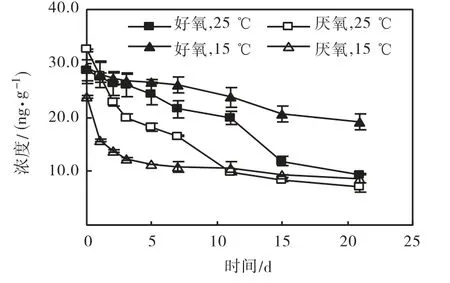
图3 γ-HCH在表层沉积物中降解曲线Fig.3 Biodegradation curves of γ-HCH in surface sediments
经拟合,HCHs的生物降解均符合一级动力学方程(R2>0.795,见表 1).可以看出,相同实验条件下这4种 HCHs降解快慢的顺序为 γ-HCH>α-HCH>δ -HCH> β-HCH.研究表明,HCHs 生物降解过程的第1步通常是脱氯,脱氯的速度与各异构体的分子结构有关,轴线上 Cl 原子越多,降解越快(γ-、α-、δ-、β-HCH 轴线 Cl原子数分别为 3、2、1、0)[7].
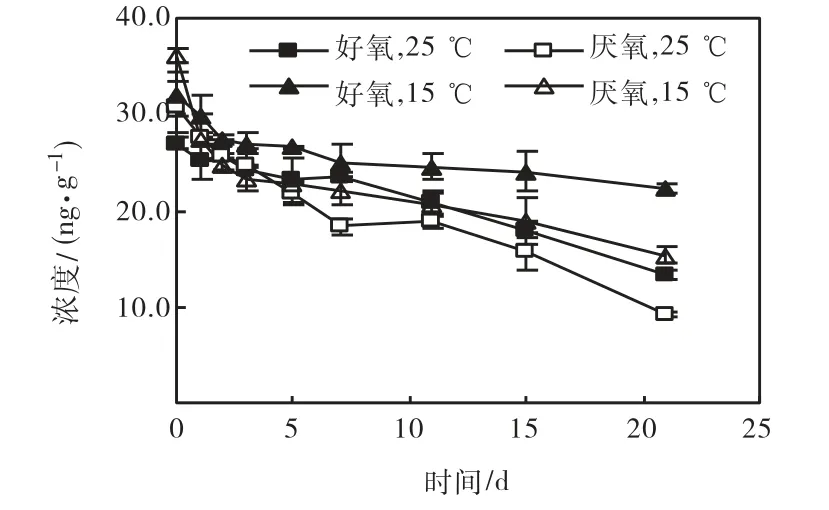
图4 δ-HCH在表层沉积物中降解曲线Fig.4 Biodegradation curves of δ-HCH in surface sediments

表1 HCHs在海河沉积物中的降解动力学常数Tab.1 Biodegradation rate constants of HCHs in sediments from Haihe River
厌氧条件下 HCHs在海河表层沉积物中的降解速率比好氧条件下高,这与HCHs的生物降解机理有关.HCH分子中氯原子强烈的吸电子性使苯环上电子云密度降低,在好氧条件下氧化酶很难从苯环上获取电子,苯环上的电子云密度越低,氧化越困难,表现出的生物降解性就越低.相反,在厌氧或缺氧条件下,环境的氧化还原电位较低,电子云密度较低的苯环在酶作用下很容易受到还原剂的亲核攻击,氯原子就很容易被亲核取代,显示出较高的厌氧生物降解性[8].
25,℃时 HCHs在海河表层沉积物中生物降解速率高于 15,℃时的生物降解速率.这是因为在可降解HCHs的微生物的最高和最低生长温度范围内,升高温度可降低使化学键断裂的活化能,活化能愈小反应速率愈大,因此升高温度有利于有机氯农药的微生物降解[9].
关于HCHs在沉积物中生物降解的报道很少.赵旭等[10]研究了沉积物中有机质及金属水合氧化物对γ-HCH厌氧生物降解的影响, 测得γ -HCH的一级降解速率常数在 2.0×10-2~7.1×10-2d-1之间.辽河沉积物中γ-HCH的厌氧生物降解速率常数为 4.54×10-2d-1[11].相比而言,海河沉积物中 HCHs的生物降解速率相对较高.然而,需要注意的是,HCHs在沉积物中的降解除了受温度和溶解氧的影响外,还受到多种因素的影响,如沉积物中有机碳的含量等[10].此外,锁定对沉积物中HCHs的生物降解影响比较显著,尤其是长期受污染的沉积物,因锁定作用使得沉积物中污染物的生物可利用性降低,降解速率减小.
2.2 六六六在海河水/沉积物界面层中的生物降解特性
水/沉积物界面层为沉积物和上覆水二相间存在一个大约2,mm厚度的薄膜层.这一界面层包括有机相、无机相和复杂的生物相,其中生物相包括低栖动物、着生生物、微生物、水生维管束植物以及一些由死亡生物组成的有机碎屑.水体中多数污染物的迁移转化多发生在这一层.有机污染物在水/沉积物界面层中的地球化学行为对河流,尤其是对浅水河流的水环境与生态系统有着极为重要的影响.
图5和图6为HCHs在海河水/沉积物界面层中的生物降解曲线.可以看出,α-HCH、γ-HCH、β-HCH和δ-HCH培养21,d后,在好氧条件下的降解率分别为 42.8%、49.0%、68.3%和 56.3%,在厌氧条件下分别为 76.4%、56.7%、80.3%和 69.2%.而对照实验中,21,d后HCHs的衰减率为3.1%~6.0%,这表明水/沉积物界面层中HCHs浓度的减少主要是生物降解造成的.

图5 HCHs在水/沉积物界面层中好氧降解曲线Fig.5 Biodegradation curves of HCHs in water-sediment interface under aerobic condition
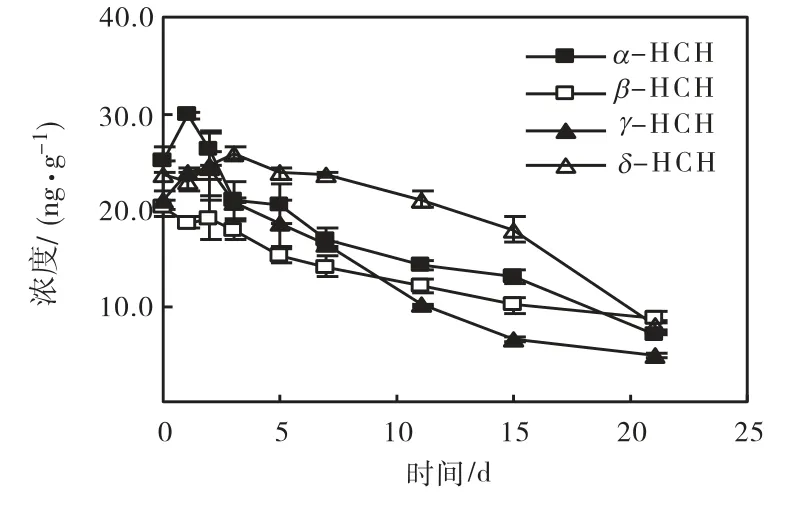
图6 HCHs在水/沉积物界面层中厌氧降解曲线Fig.6 Biodegradation curves of HCHs in water-sediment interface under anaerobic condition
HCHs在海河水/沉积物界面层中的生物降解均符合一级动力学方程(R2>0.823,见表1).比较降解速率常数可以发现,这 4种 HCHs降解快慢的顺序为γ-HCH>α-HCH>δ-HCH>β-HCH,同一种 HCH 异构体厌氧条件下的降解快于好氧,与表层沉积物相同.
将 HCHs在海河水/沉积物界面层中的生物降解速率与表层沉积物中的相比可以发现,除好氧条件下α-HCH 和γ-HCH,水/沉积物界面层中 HCHs的生物降解速率均高于表层沉积物的生物降解速率.经测定海河水/沉积物界面层中细菌数量为 5.76×105CFU/g,高于表层沉积物中细菌数量(4.28×105CFU/g).研究表明[12],微生物的活动可以明显提高酶的活性,微生物及酶的共同作用是导致水体中HCH消解的主要原因.微生物数量越多,酶的活性越高,HCH的消解率越高.除微生物数量对 HCHs的生物降解速率有影响外,沉积物的组成等因素也会对降解速率产生影响,由此可能会出现好氧条件下α-HCH和γ-HCH在水/沉积物界面层中降解速率常数降低的现象.
3 结 语
HCHs在海河表层沉积物及水/沉积物界面层中的生物降解均符合一级动力学方程.4种HCHs异构体的降解顺序为γ-HCH>α-HCH>δ-HCH>β-HCH;厌氧条件下 HCHs在海河沉积物中的降解速率高于好氧条件,温度升高降解速率增大;水/沉积物界面层中HCHs的生物降解速率,除好氧条件下α-HCH 和γ-HCH外,均高于表层沉积物.
[1] Wurl O ,Obbard J P. Organochlorine pesticides,polychlorinated biphenyls and polybrominated diphenyl ethers in Singapore's coastal marine sediments [J].Chemosphere,2005,58(7):925-933.
[2] Yang R Q,Lv A H,Shi J B,et a1. The levels and distribution of organochlorine pesticides(OCPs) in sediments from the Haihe River,China [J]. Chemosphere,2005,61(3):347-354.
[3] Snape I,Harvey P M A,Ferguson S H,et al. Investigation of evaporation and biodegradation of fuel spills in Antarctica (I):A chemical approach using GC-FID [J].Chemosphere,2005,61(10):1485-1494.
[4] 郭子武,陈双林,萧江华. 有机氯农药微生物降解研究进展[J]. 西南林学院学报,2007,27(4):70-75.
Guo Ziwu,Chen Shuanglin,Xiao Jianghua. Advances in study on biodegradation of organochlorine pesticides[J]. Journal of Southwest Forestry College,2007,27(4):70-75(in Chinese).
[5] Boyle J D,Scott J A. The role of benthic films in the oxygen balance in an east Devon River [J]. Water Research,1984,18(9):1089-1099.
[6] 赵 斌,何少江. 微生物学实验[M]. 北京:科学出版社,2002:69-72.
Zhao Bin,He Shaojiang. Microbiology Experiment [M].Beijing:Science Press,2002:69-72(in Chinese).
[7] 朱优峰,徐晓白,习志群. 有机氯农药在多介质环境中迁移转化的研究进展[J]. 自然科学进展,2003,13(9):910-914.
Zhu Youfeng,Xu Xiaobai,Xi Zhiqun. Advances in transport and transformation of organochlorine pesticides in multimedia environment [J]. Progress in Natural Science,2003,13(9):910-914(in Chinese).
[8] 孙福来. 微生物降解土壤有机污染物的研究进展[J].农业环境与发展,2002,19(5):421-428.
Sun Fulai. Advance in microorganism degradation of organic pollutants in sediment [J]. Agro-Environment and Development,2002,19(5):421-428(in Chinese).
[9] Troester S J,Ress F A,Felsot A S,et al. Modeling of the persistence of pesticides applied to the soil [J]. Agriculture,Ecosystems & Environment,1985,14(3/4):304-305.
[10] 赵 旭,赵慧敏,陈 硕,等. 沉积物中有机质及金属水合氧化物对γ-HCH、p,p′-DDT缺氧生物降解性影响[J]. 环境科学,2002,23(3):115-117.
Zhao Xu,Zhao Huimin,Chen Shuo,et al. The effects of organic matter and hydrous metal oxides on the anaero-biodegradation of γ-666,p,p′-DDT in Liaohe River sediments [J]. Environmental Science,2002,23(3):115-117(in Chinese).
[11] 贾青竹,王 昶,李桂菊,等. HCB与γ-HCH在辽河沉积物中的缺氧降解动力学[J]. 中国环境科学,2005,25(1):52-55.
Jia Qingzhu,Wang Chang,Li Guiju,et al. Kinetics of the anaerobic degradation of HCB and γ-HCH in Liaohe River sediment [J]. China Environmental Science,2005,25(1):52-55(in Chinese).
[12] 张超兰,汪小勇,姜 文,等. 有机氯农药六六六污染土壤的植物修复研究[J]. 生态环境,2007,16(5):1436-1440.
Zhang Chaolan,Wang Xiaoyong,Jiang Wen,et al.Phytoremediation of HCH-contaminated soils [J]. Ecology and Environment,2007,16(5):1436-1440(in Chinese).
