凡纳滨对虾C-型凝集素LvLec2对不同刺激的免疫应答
2010-09-24张继泉李富花柳承璋相建海
罗 展, 张继泉, 李富花, 柳承璋, 相建海
(1. 中国科学院 海洋研究所 实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国科学院 研究生院, 北京 100049)
凡纳滨对虾C-型凝集素LvLec2对不同刺激的免疫应答
罗 展1,2, 张继泉1, 李富花1, 柳承璋1,2, 相建海1
(1. 中国科学院 海洋研究所 实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国科学院 研究生院, 北京 100049)
克隆获得了与中国明对虾(Fenneropenaeus chinensis)C-type lectin 3同源的C-型凝集素LvLec2基因序列, 并通过 Real-time PCR研究了其在脂多糖(lipopolysaccharide, 简称 LPS)、灭活溶壁微球菌(Micrococcus lysodeikticus)和白斑综合症病毒(white spot syndrome virus, 简称WSSV)刺激后的转录表达变化。结果表明, LvLec2编码157个氨基酸, 含有1个糖识别结构域(carbohydrate recognition domain,简称CRD), 其CRD结构域中具有决定糖结合特异性的基序“EPS”(Glu118-Pro119-Ser120)序列。系统进化树分析表明LvLec2与已发表的凡纳滨对虾(Litopenaeus vannamei)C-型凝集素亲缘较远。LPS、灭活溶壁微球菌和WSSV刺激后, LvLec2基因在肝胰脏中的转录表达有明显的变化但表达模式不同。LvLec2可能作为模式识别受体参与了对虾对病原的识别或防御。
凡纳滨对虾(Litopenaeus vannamei); C-型凝集素; 基因克隆; 不同刺激; 免疫应答
同其他无脊椎动物一样, 甲壳动物以先天性免疫的方式来识别入侵的“异己”物, 抵御外界病原体的侵袭。甲壳动物对病原的识别是通过其模式识别受体或模式识别蛋白辨别各类病原体所共有的、固定的病原相关分子模式来完成的[1]。甲壳动物模式识别受体主要包括肽聚糖识别蛋白、革兰氏阴性菌结合蛋白、含硫酯键蛋白、清道夫受体、硫依赖型凝集素、血素、Toll样受体和C-型凝集素等[2], 能够识别微生物细胞壁的多糖成分, 例如革兰氏阴性菌的细菌 LPS、革兰氏阳性菌的肽聚糖、真菌的 β-1,3-葡聚糖、脂磷壁酸、甘露聚糖等[3,4]。当模式识别受体识别这些病原相关分子模式后, 会激活存在于甲壳动物体液中的蛋白酶或细胞内的信号途径从而引起细胞或体液免疫反应[5]。
C-型凝集素几乎存在于所有动植物体内, 其凝集活性具有钙离子依赖性。C-型凝集素的主要特征是在蛋白质分子的C末端含有糖识别结构域CRD。作为一种模式识别受体, C-型凝集素参与“非己”识别和对入侵病原的清除过程[6,7]。据报道, 无脊椎动物 C-型凝集素可参与多种免疫反应: 激活前酚氧化酶原、抗菌、吞噬、包囊、黑化作用以及结节的形成等, 在先天性免疫防御中具有重要作用[8~12]。近几年, 对虾 C-型凝集素的研究也逐渐开展起来, 目前已在中国明对虾(Fenneropenaeus chinensis)、凡纳滨对虾(Litopenaeus vannamei)、日本囊对虾(Marsupen-aeus japonicus)、墨吉明对虾(Fenneropenaeus merguiensis)等多种对虾中发现C-型凝集素的存在[13~18]。
尽管在凡纳滨对虾中已报道了 LvLT[14]、LvCTL1[16]、LvLec[17]、LVL[19]等 C-型凝集素, 但本研究所克隆获得的凡纳滨对虾 C-型凝集素基因LvLec2与已报道的凡纳滨对虾C-型凝集素相似性较低, 进化亲缘较远。LPS是革兰氏阴性菌的细胞壁成分, 作者将 LPS、灭活溶壁微球菌和 WSSV作为革兰氏阴性菌、革兰氏阳性菌和病毒的代表, 对凡纳滨对虾进行免疫刺激。通过研究LvLec2基因在LPS、灭活溶壁微球菌和 WSSV刺激后的表达特征, 期望能发现 C-型凝集素在对虾防御病原感染中的作用,为对虾免疫防御机制的研究做出有益补充, 并为对虾疾病的防治提供理论依据。
1 材料和方法
1.1 实验对虾
凡纳滨对虾(体长12.5 cm ± 0.5 cm, 体质量25.5 g ± 0.5 g) 购于青岛胶州对虾养殖场, 实验前在水族箱中充气暂养7 d, 使其适应实验室内养殖环境。取健康对虾血细胞, 并分离不同组织, 提取总 RNA用于cDNA合成。
1.2 免疫刺激实验
采用腹节注射法分别进行 LPS、灭活溶壁微球菌和 WSSV的免疫刺激实验, 并设 PBS(phosphate buffer saline, 简称PBS)对照组, 每组各注射30尾对虾。LPS组, 每尾对虾注射10 μL溶于无菌PBS的LPS溶液(5 mg/mL); 灭活溶壁微球菌组, 每尾对虾注射10 μL经高压灭菌的溶于无菌PBS的质量浓度为0.2 g/L的溶壁微球菌溶液; WSSV 感染组, 每尾对虾注射 10 μL WSSV组织提取液[20]; 感染实验的对照组, 每尾对虾注射10 μL无菌PBS溶液。免疫刺激后第0、6、12、24小时分别取虾5尾, 解剖取其肝胰脏组织, 冻存于液氮中, 用于总RNA的提取。注射感染后的第3天, 从WSSV 感染组和对照组分别随机取 5尾虾, 取部分鳃组织提取 DNA, 用WSSV特异性引物进行扩增, 结果在 WSSV注射组均扩增出特异性条带, 而在对照组中未检测到, 证明感染实验是有效的。
1.3 cDNA片段的克隆
将NCBI中公布的161075条凡纳滨对虾EST序列进行拼接、注释和聚类分析(数据未发表), 重点对其中注释为lectin的序列进行了分析, 发现有 39个contigs或 singletons被注释为 C-型凝集素片段。选取其中与中国明对虾C-type lectin 3同源的contig(命名为LvLec2)进行深入研究。利用Primer premier 5.0设计引物 LvLec2-F1和 LvLec2-R1(表 1), 以头胸部cDNA为模板, PCR扩增凡纳滨对虾LvLec2基因片段。扩增LvLec2基因片段所用PCR反应程序: 94ºC变性4 min, 1个循环; 94ºC变性50 s, 55℃退火50 s,72ºC延伸1 min, 35个循环; 72ºC延伸10 min, 1个循环; 4ºC保温, PCR体系见表2。
1.4 生物信息学分析
将所测得序列利用 NCBI网站(http://www.ncbi.nlm.nih.gov)上的 BLAST工具进行数据库基因序列的相似性及同源性查找和比对, cDNA序列的开放阅读框(open reading frame, 简称ORF)分析等用Bioedit软件进行。选取部分在Genbank 中与LvLec2相似的其他物种的 C-型凝集素的 CRD 序列, 采用ClustalW 软件进行多序列比对分析。将根据 cDNA序列推导的氨基酸序列, 利用 http://www.expasy.ch网站提供的蛋白质组和序列分析工具进行分析: 用ProtParam软件进行蛋白质基本物理化学参数分析,SingalP程序分析信号肽, Smart软件预测功能域。利用MEGA 4.0软件, 采用邻接法在多序列比对的基础上构建系统进化树。

表1 实验中用到的引物及序列Tab. 1 Oligonucleotide primers used in this study

表2 PCR反应体系Tab. 2 Components and reagents for polymerase chain reaction
1.5 基因的组织分布
提取健康的凡纳滨对虾不同组织(肝胰脏、血细胞、胃、肠、表皮、心脏、鳃和肌肉)的RNA, 合成cDNA进行RT-PCR, 取不同组织cDNA各1 μL为模板, β-actin基因作为内参(表 1), 以 28个循环扩增LvLec2的基因片段, 以27个循环扩增β-actin的基因片段来检测对虾不同组织中LvLec2 mRNA的表达情况。反应结束后, 每管取10 μL PCR 产物用2% 琼脂糖凝胶进行电泳, 电泳后用Quantity one 4.4 软件分析电泳图片。
1.6 基因转录表达检测
利用六聚体随机引物反转录制备注射 LPS、灭活溶壁微球菌、WSSV和PBS后第0、6、12、24小时的肝胰脏组织cDNA, 作为Real-time PCR反应的模板, LvLec2-F2和 LvLec2-R2(表 1)为 LvLec2基因Real-time PCR反应的引物, 扩增产物长度为173 bp。根据 Wang[21]报道的基因芯片数据信息, β-actin 基因在 WSSV刺激下的表达会发生变化, 而磷酸丙糖异构酶基因TPI(triosephosphate isomerase, 简称TPI)的表达水平稳定, 因而适合作为 WSSV刺激下基因表达分析的内参基因。LvTPI-F和 LvTPI-R(表 1)为TPI基因的特异引物, 扩增产物长度为107 bp。LPS刺激组和 PBS对照组以 β-actin基因作为内参,β-actin-F和 β-actin-R为引物, 扩增产物长度为 240 bp。Real-time PCR 反应在 Eppendorf公司Mastercycler ep realplex 4S PCR仪上进行, 采用Blend Taq-Plus- PCR反应体系(表 3), 所用染料为SYBR Green。每个时间点的cDNA样品做两组PCR,一组为内参基因, 另一组为目的基因 LvLec2, 每组反应进行3次重复。LvLec2 基因的反应条件为: 94ºC变性2 min, 1个循环; 94ºC 变性20 s, 57 ºC 退火 20 s,72ºC 延伸20 s, 40 个循环。β-actin基因和 TPI基因的Real-time PCR反应程序同LvLec2基因, 退火温度分别为58℃和60ºC。
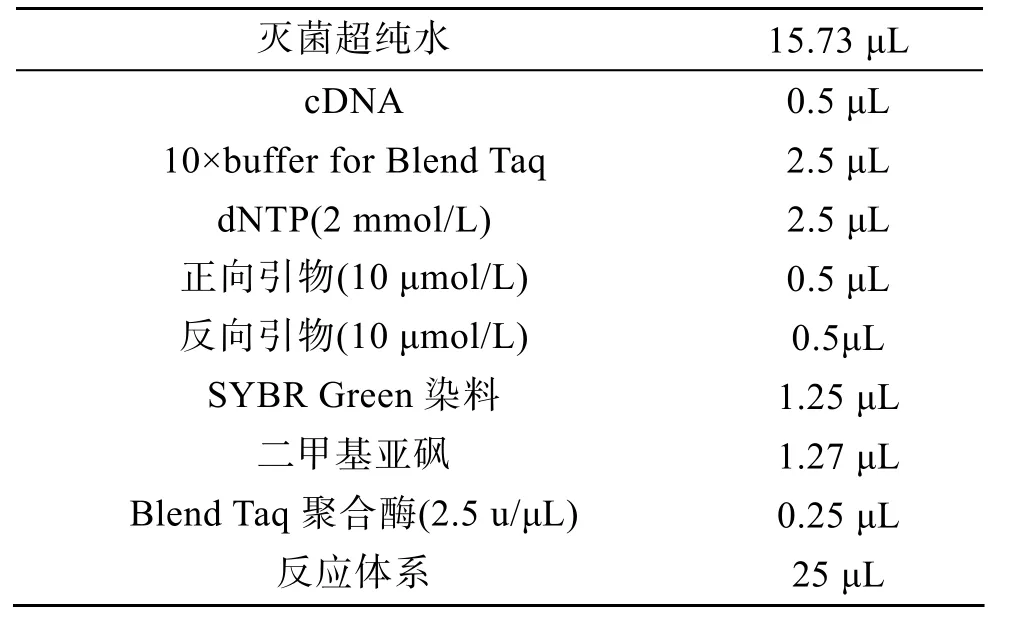
表3 Real-time PCR反应体系Tab. 3 Components and reagents for real-time polymerase chain reaction
数据处理采用 2-∆∆Ct方法[22], 数据间的显著性分析使用SPSS 11.5 软件进行。
2 结果
2.1 cDNA片段的克隆
LvLec2基因包含1个474 bp的开放阅读框ORF编码157个氨基酸。ORF核苷酸序列和推导的氨基酸序列信息见图1。其推测的蛋白质分子量为17.96 ku, 理论等电点为4.35。通过SMART软件推测, 该分子在N末端有1个17个氨基酸的信号肽, C末端有1个CRD结构域。BLAST同源性检索发现, LvLec2与无脊椎动物 C-型凝集素超家族成员具有较高的相似性。与LvLec2一致性最高的为中国明对虾FcLec3(ACJ06431.1), 高达 76%。与刀额新对虾(Metapenaeus ensis)MeLT(ABV58637.1)的一致性为47%, 同中华绒螯蟹(Eriocheir sinensis)EsLT(ADB10837.1)具有37%的一致性, 与凡纳滨对虾 C-型凝集素 LvLT(ABI97374.1)一致性为27%。
2.2 与其他甲壳动物 C-型凝集素 CRD多序列比对分析
通过 LvLec2与其他甲壳动物 C-型凝集素 CRD进行多序列比对发现, LvLec2含有该超家族保守的氨基酸位点。其CRD含有的参与二硫键形成的4个保守的半胱氨酸, 分别位于: Cys21, Cys32, Cys49和Cys149, 是典型的短型的C-型凝集素。LvLec2的CRD中决定糖结合特异性的基序为“EPS”(Glu118-Pro119-Ser120)序列(图 2)。

图1 凡纳滨对虾LvLec2基因的ORF核酸序列及推导的氨基酸序列Fig. 1 The ORF and deduced amino acid sequence of LvLec2 from L. vannamei
2.3 系统进化树分析
利用 MEGA4.0软件采用邻接法构建系统进化树, 研究了凡纳滨对虾C-型凝集素LvLec2的分类归属以及与其他甲壳动物C-型凝集素之间的进化关系。由图3可见, LvLec2与来自对虾的C-型凝集素聚在同一类群, 与中国明对虾 FcLec3聚在同一分支上, 在进化上亲缘关系最近, 同已报道的凡纳滨对虾 C-型凝集素LvLT、LvLec、LvCTL1未聚在同一个分支。

图2 LvLec2的CRD与其他C-型凝集素的CRD进行多序列比对Fig. 2 Alignment of the CRD sequence of the LvLec2 from L. vannamei with C-type lectin CRD sequences from other crustaceans
2.4 组织分布
采用半定量 RT-PCR的方法分析了 LvLec2 mRNA在健康凡纳滨对虾不同组织中的表达特征。LvLec2 基因在肝胰脏中表达量最高, 其次为胃, 在鳃、肠、心脏和肌肉组织中都有微弱表达(图4)。
2.5 免疫刺激后LvLec2基因在凡纳滨对虾肝胰腺中的转录表达
利用Real-time PCR方法分析了LPS、灭活溶壁微球菌和WSSV免疫刺激凡纳滨对虾后, LvLec2基因在对虾肝胰脏组织中的表达变化(图5)。
2.5.1 LPS注射组
注射LPS实验组中LvLec2 mRNA 的表达变化图谱如图 5-A 所示。结果显示, LvLec2基因的表达在注射 PBS的对照组中基本没有变化, 在注射 LPS第6小时时略有上调, 12 h恢复到接近对照的水平,而24 h时 LvLec2 mRNA 的表达量又显著上调, 且与对照组差异极显著(P<0.01)。
2.5.2 灭活溶壁微球菌注射组
如图5-B, 注射灭活溶壁微球菌组, LvLec2基因的表达量在注射后6、12 h与对照组相近, 24 h时略有上升, 与对照组出现了显著性差异(P<0.01)。

图3 不同甲壳动物C-型凝集素的系统进化树分析Fig. 3 Phylogenetic analysis of C-type lectins from crustacean
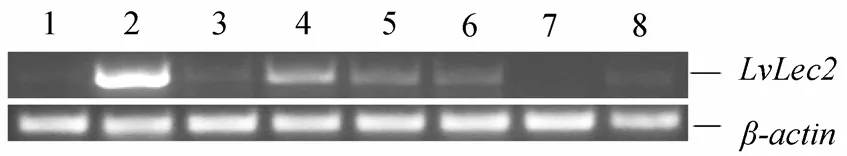
图4 RT-PCR检测凡纳滨对虾不同组织中LvLec2基因的表达情况Fig. 4 Detection of LvLec2 transcripts by RT-PCR
2.5.3 WSSV感染组
注射WSSV实验组中LvLec2 mRNA 的表达变化图谱如图5-C所示。LvLec2基因的表达在WSSV感染初期第 6小时便呈现显著性上调, 后逐渐降低,12 h时表达量接近对照组水平, 24 h时与对照组相比显著下调(P<0.05)。
3 讨论
C-型凝集素是一类具有凝集活性和钙离子依赖性的蛋白超家族, 其主要特征是在蛋白质分子的 C末端含有CRD。目前, 已报道的对虾C-型凝集素都有一个或两个CRD。如斑节对虾PmAV[23]、中国明对虾 FcLec1[24]都含有一个 CRD, 而中国明对虾Fclectin[13]、凡纳滨对虾LvLT[14]和斑节对虾PmLT[15]序列中都有2个串联的CRD。本研究中获得C-型凝集素LvLec2, C末端只有1个CRD结构域。
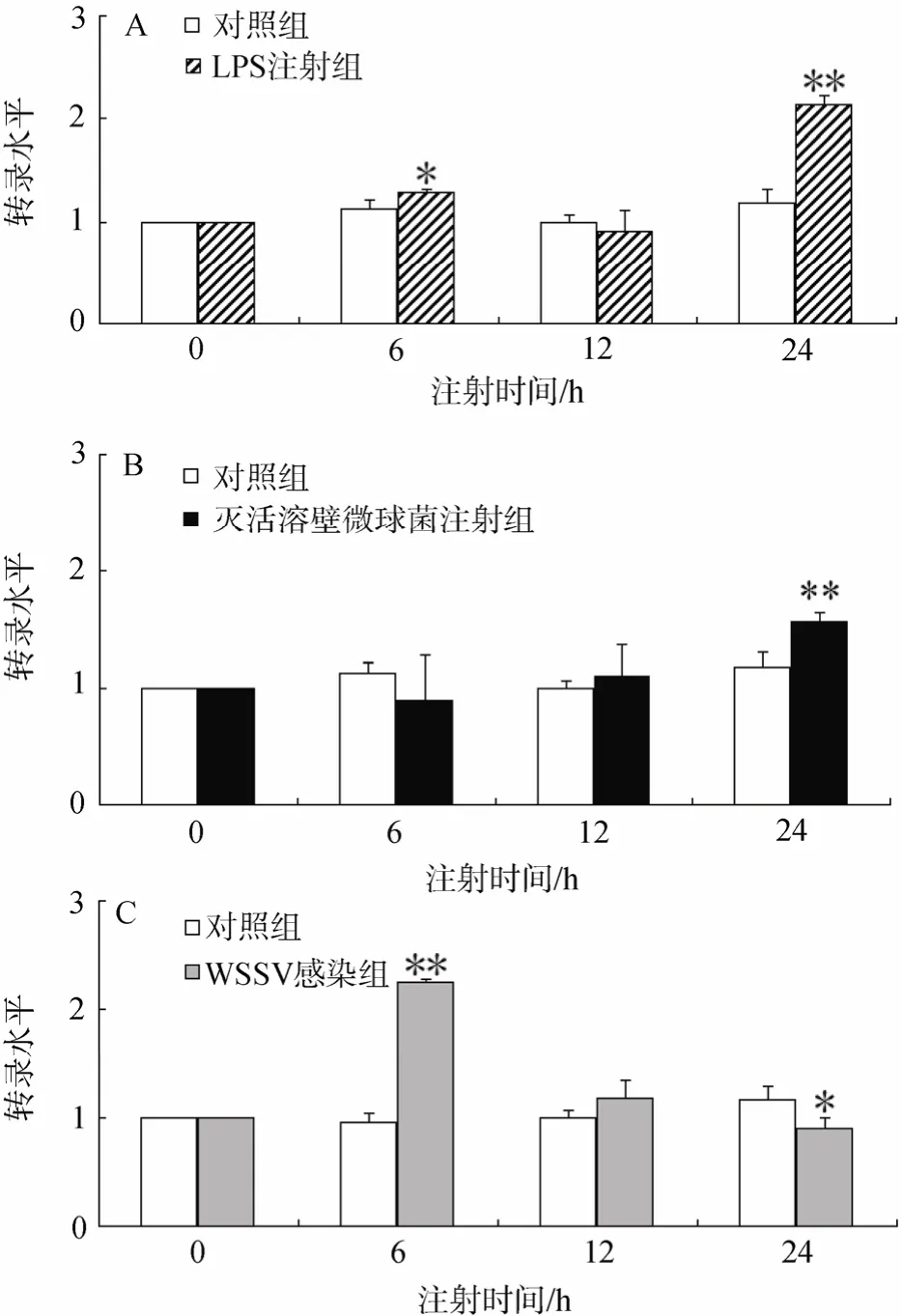
图5 LPS注射组(A)、灭活溶壁微球菌注射组(B)和WSSV感染组(C)的不同时间凡纳滨对虾肝胰脏组织 LvLec2 mRNA的表达变化Fig.5 Relative LvLec2 mRNA expression levels in hepatopancreas at different time intervals post LPS (A),M.lysodeikticus (B) and WSSV injection (C)
存在于血淋巴中的可溶性凝集素, 可以同病原分子等表面的糖基决定簇结合, 从而导致病原或异物的凝集; 存在于细胞膜表面的凝集素, 血细胞可以通过凝集素分子与异物分子表面结合, 以便对异物分子进行吞噬或包围[2]。根据结构和糖结合活性的不同, C-型凝集素大致可分为半乳糖结合型凝集素和甘露糖结合型凝集素。半乳糖结合型凝集素的糖结合位点有保守的“QPD”(Gln-Pro-Asp) 基序, 能与半乳糖和半乳糖的衍生物结合; 而甘露糖结合型凝集素的相应结构域为“EPN”(Glu-Pro-Asn), 能够结合甘露糖及甘露糖的衍生物。在许多无脊椎动物中, “EPN”也可能被“EPD”(Glu-Pro-Asp)、“EPS”(Glu-Pro-Ser)所替代, 如中国明对虾 FcLec3和来自栉孔扇贝(Chlamys farreri)的 CfLec-2[25]。LvLec2的CRD结构域中具有“EPS”(Glu118-Pro119-Ser120)序列,推测其可与甘露糖及甘露糖的衍生物相结合。
凡纳滨对虾中克隆获得的 C-型凝集素基因LvLT[14]在病毒注射后2 h表达下调, 4 h后表达量升高。 Zhao等[16]克隆的 LvCTL1具有“EPN”位点, 可与 WSSV 囊膜蛋白 VP95、VP28、VP26、VP24、VP19和VP14相互结合。重组rLvCTL1可阻断WSSV的感染, 延长对虾的存活时间。另外, Zhang等[17]克隆的LvLec具有“EPN”位点, 在Ca2+存在的情况下可凝集大肠杆菌JM109, 凝集活性可被甘露糖和EDTA抑制。通过SMART软件预测LvLec2的糖识别结构域含有C-型凝集素超家族参与二硫键形成的4个保守的半胱氨酸, 是典型的短型的 C-型凝集素。根据BLAST序列比对以及系统进化树分析结果, 虽然LvLec2与中国明对虾 C-型凝集素 FcLec3同源性较高, 但其与已知的凡纳滨对虾 C-型凝集素 LvLT、LvCTL1和 LvLec相似性很低, 在进化上距离较远,是凡纳滨对虾C-型凝集素家族的新成员。
肝胰脏是对虾重要的消化和免疫器官, 它参与消化、吸收、储存和代谢等生理活动, 对环境的变化和水媒性的污染物非常敏感, 并且在启动对虾免疫反应中起重要作用。目前发现的对虾 C-型凝集素大部分都在肝胰脏中表达。组织分布结果显示,LvLec2组织分布特点同与其亲缘最近的中国明对虾FcLec3[26]相一致, 主要在对虾肝胰脏中表达。FcLec3半定量 PCR和免疫组织化学分析结果显示, 其主要分布于与消化酶的合成与分泌相关的肝胰脏 F细胞中。
当受到免疫刺激时, 肝胰脏中LvLec2表达水平都呈现不同程度的上调趋势。与LvLec2同源性较高的中国明对虾 FcLec3[26], 注射鳗弧菌(Vibrio anguillarum)后第 2小时, 其表达量开始上升, 并于第12小时达到最高值; 在WSSV感染后2~6 h表达量增高, 并逐渐恢复到正常水平, 第 24小时再次出现表达上调, 推测可能存在二次免疫作用。相对于LPS和灭活溶壁微球菌,LvLec2对WSSV的感染更为敏感, 在WSSV注射后第6小时出现了明显的上调, 这与Fclec3在感染WSSV后2~6 h的表达趋势一致, 但6~24 hLvLec2表达量逐渐降低至正常水平, 未出现中国明对虾 FcLec3的二次免疫现象, 推测虽然LvLec2与FcLec3同源性较高, 但不同的C-型凝集素在抗病原感染时发挥不同的作用。另外, 体外重组的FcLec3已被证实可与重组的WSSV囊膜蛋白VP28相互结合, 这提示LvLec2也可能参与了对WSSV的识别。为了进一步证实LvLec2的模式识别功能, 我们将通过体外重组表达LvLec2, 检验其凝菌活性和糖结合活性, 并通过蛋白质互作技术验证其与WSSV囊膜蛋白的相互作用。
迄今, 已从中国明对虾中获得 7个 C-型凝集素基因, 凡纳滨对虾以及斑节对虾等对虾体内都已克隆或分离到多种 C-型凝集素。本实验室在分析凡纳滨对虾ESTs拼接数据库的contigs时也发现了39个C-型凝集素的基因片段。在与甲壳动物进化相近的模式动物果蝇基因组中发现了 32种 C-型凝集素[6],结合目前对虾 C-型凝集素的相关报道, 作者推测对虾中可能还有多种 C-型凝集素的存在, 也将陆续对凡纳滨对虾 ESTs拼接数据库中发现的 C-型凝集素进行克隆和功能验证。
[1] Johansson M W, Soderhall K. The prophenoloxidase activating system and associated proteins in invertebrates[J]. Prog Mol Subcell Biol, 1996, 15: 46-66.
[2] 王金星, 赵小凡. 无脊椎动物先天免疫模式识别受体研究进展[J]. 生物化学与生物物理进展, 2004, 31(2):112-117.
[3] Vargas-Albores F, Jimenez-Vega F, Soderhall K. A plasma protein isolated from brown shrimp (Penaeus californiensis) which enhances the activation of prophenoloxidase system by beta-1,3-glucan[J]. Dev Comp Immunol, 1996, 20(5): 299-306.
[4] Vargas-Albores F, Jiménez-Vega F, Yepiz-Plascencia G M. Purification and comparison of beta-1,3-glucan binding protein from white shrimp (Penaeus vannamei)[J]. Comp Biochem Physiol B Biochem Mol Biol,1997, 116(4): 453-458.
[5] De G E, Spellman P T, Rubin G M, et al. Genome-wideanalysis of the Drosophila immune response by using oligonucleotide microarrays[J]. Proc Natl Acad Sci U S A, 2001, 98(22): 12 590-12 595.
[6] Dodd R B, Drickamer K. Lectin-like proteins in model organisms: implications for evolution of carbohydrate-binding activity[J]. Glycobiology, 2001, 11(5):71-79.
[7] Vasta G R, Ahmed H, Du S , et al. Galectins in teleost fish: Zebrafish (Danio rerio) as a model species to address their biological roles in development and innate immunity[J]. Glycoconj J, 2004, 21(8-9): 503-521.
[8] Yu XQ, Gan H, Kanost MR. Immulectin, an inducible C-type lectin from an insect, Manduca sexta, stimulates activation of plasma prophenol oxidase[J]. Insect Biochem Mol Biol, 1999, 29(7): 585-597.
[9] Schröder H C, Ushijima H, Krasko A, et al. Emergence and disappearance of an immune molecule, an antimicrobial lectin, in basal metazoa. A tachylectin-related protein in the sponge Suberites domuncula[J]. J Biol Chem, 2003, 278(35): 32 810-32 817.
[10] Luo T, Yang H, Li F, et al. Purification, characterization and cDNA cloning of a novel lipopolysaccharide-binding lectin from the shrimp Penaeus monodon[J]. Dev Comp Immunol, 2006, 30(7): 607-617.
[11] Ling E, Yu X Q. Hemocytes from the tobacco hornworm Manduca sexta have distinct functions in phagocytosis of foreign particles and self dead cells[J].Dev Comp Immunol, 2006, 30(3): 301-309.
[12] Koizumi N, Imamura M, Kadotani T, et al. The lipopolysaccharide-binding protein participating in hemocyte nodule formation in the silkworm Bombyx mori is a novel member of the C-type lectin superfamily with two different tandem carbohydrate-recognition domains[J]. FEBS Lett, 1999, 443(2): 139-143.
[13] Liu Y C, Li F H, Dong B, et al. Molecular cloning,characterization and expression analysis of a putative C-type lectin (Fclectin) gene in Chinese shrimp Fenneropenaeus chinensis[J]. Mol Immunol, 2007, 44(4):598-607.
[14] Ma T H, Tiu S H, He J G, et al. Molecular cloning of a C-type lectin (LvLT) from the shrimp Litopenaeus vannamei: early gene down-regulation after WSSV infection[J]. Fish Shellfish Immunol, 2007, 23(2):430-437.
[15] Ma T H, Benzie J A, He J G, et al. PmLT, a C-type lectin specific to hepatopancreas is involved in the innate defense of the shrimp Penaeus monodon[J]. J Invertebr Pathol, 2008, 99(3): 332-341.
[16] Zhao Z Y, Yin Z X, Xu X P, et al. A novel C-type lectin from the shrimp Litopenaeus vannamei possesses anti-white spot syndrome virus activity[J]. J Virol,2009, 83(1): 347-356.
[17] Zhang Y, Qiu L, Song L, et al. Cloning and characterization of a novel C-type lectin gene from shrimp Litopenaeus vannamei[J]. Fish Shellfish Immunol, 2009,26(1): 183-192.
[18] Song K K, Li D F, Zhang M C, et al. Cloning and characterization of three novel WSSV recognizing lectins from shrimp Marsupenaeus japonicus[J]. Fish Shellfish Immunol, 2010, 28(4): 596-603.
[19] Sun J, Wang L, Wang B, et al. Purification and characterisation of a natural lectin from the serum of the shrimp Litopenaeus vannamei[J]. Fish Shellfish Immunol, 2007, 23(2): 292-299.
[20] 王兵. 中国对虾免疫相关基因和性别相关核酸片段研究[D]. 北京: 中国科学院研究生院, 2003.
[21] Wang B, Li F, Dong B, et al. Discovery of the genes in response to white spot syndrome virus (WSSV) infection in Fenneropenaeus chinensis through cDNA microarray[J]. Mar Biotechnol (NY), 2006, 8(5):491-500.
[22] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001,25(4): 402-408.
[23] Luo T, Li F, Lei K, et al. Genomic organization, promoter characterization and expression profiles of an antiviral gene PmAV from the shrimp Penaeus monodon[J]. Mol Immunol, 2007, 44(7): 1 516-1 523.
[24] Sun Y D, Fu L D, Jia Y P, et al. A hepatopancreas-specific C-type lectin from the Chinese shrimp Fenneropenaeus chinensis exhibits antimicrobial activity[J]. Mol Immunol, 2008, 45(2): 348-361.
[25] Zheng P, Wang H, Zhao J, et al. A lectin (CfLec-2)aggregating Staphylococcus haemolyticus from scallop Chlamys farreri[J]. Fish Shellfish Immunol, 2008,24(3): 286-293.
[26] Wang X W, Xu W T, Zhang X W, et al. A C-type lectin is involved in the innate immune response of Chinese white shrimp[J]. Fish Shellfish Immunol,2009, 27(4): 556-562.
Received: Jul, 29, 2010
Key words:Litopenaeus vannamei; C-type lectin; gene cloning; different challenge; immune response
Abstract:A novel C-type lectin gene LvLec2 was cloned from Litopenaeus vannamei. LvLec2 shared high identity with C-type lectin 3 from Fenneropenaeus chinensis. The deduced amino acid sequence of LvLec2 contained 157 amino acid residues and a carbohydrate recognition domain (CRD) at the C-terminal. There was a potential carbohydrate-bingding motif “EPS” (Glu118-Pro119-Ser120) in the CRD, and it might bind mannose-type sugars. BLAST search and phylogenetic analysis showed LvLec2 shared far evolutionary relationship with other C-type lectins from L. vannamei. In healthy shrimp L. vannamei, LvLec2 was mainly expressed in hepatopancreas. Real-time PCR analysis indicated that LvLec2 transcripts level showed significant change in hepatopancreas after the shrimp were artificially challenged with LPS, inactived Micrococcus lysodeikticus, and white spot syndrome virus (WSSV). The results suggested that LvLec2 might be involved in the immune response against WSSV infection, and might contribute to non-self recognition by functioning as a pattern recognition receptor in the innate immune system of shrimp L.vannamei.
(本文编辑:谭雪静)
Cloning of a novel C-type lectin LvLec2 from the shrimp Litopenaeus vannamei and its immune response to different challenges
LUO Zhan1,2, ZHANG Ji-quan1, LI Fu-hua1, LIU Cheng-zhang1,2, XIANG Jian-hai1
(1. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences,Qingdao 266071, China; 2. Graduate University, Chinese Academy of Sciences, Beijing 100049, China)
Q786
A
1000-3096(2010)11-0103-08
2010-07-29;
2010-08-15
国家重点基础研究发展规划项目(973计划)(2006CB101804); 农业科技成果转化资金项目(2010GB24910700)
罗展(1981-), 女, 博士研究生, 主要从事甲壳动物免疫相关基因及功能研究, 电话: 0532-82898571, E-mail: bluelz_2001@163.com; 相建海, 通信作者, 电话: 0532-82898568, E-mail: jhxiang@ms.qdio.ac.cn
