泥蚶凝集素的抑菌作用和免疫学研究
2010-09-24柯佳颖陈寅山戴聪杰
柯佳颖, 陈寅山, 戴聪杰
(1. 泉州师范学院 化学与生命科学学院, 福建 泉州 362000; 2. 福建师范大学 生命科学学院, 福建 福州 350007)
泥蚶凝集素的抑菌作用和免疫学研究
柯佳颖1, 陈寅山2, 戴聪杰1
(1. 泉州师范学院 化学与生命科学学院, 福建 泉州 362000; 2. 福建师范大学 生命科学学院, 福建 福州 350007)
分别从泥蚶血淋巴液和肌肉中提取出凝集素, 采用全血微量培养法进行淋巴细胞转化和抑菌实验。结果表明: 两种凝集素都具有促进小鼠淋巴细胞转化的免疫调节功能; 两种凝集素对供试的金黄色葡萄球菌(Staphylococcus aureus), 甘薯薯瘟病原细菌(Fasarium oxyssporam), 大肠杆菌(Escherichia coli), 普通变形杆菌(Proteas valgaris), 八叠球菌(Sarcina lutea)5种细菌和啤酒酵母(Saccharomyces carlsbergensis), 玉米大斑病菌(Helminthos porium turcicum), 稻瘟病菌(Piricularia oryzae)3种真菌都有不同程度的抑制作用, 且对真菌的抑制作用大于对细菌的抑制作用; 由二者分别制备的抗血清通过免疫双扩散法并不能与对方发生交叉沉淀反应, 说明它们不具有同源性。
泥蚶(Tegillarca granosa Linnaeus); 凝集素; 免疫活性; 抑菌作用
凝集素由于具有独特的生化性质[1,2], 通常被应用于分离和鉴定糖蛋白和糖脂、研究细胞组化、细胞分型、分离淋巴细胞和骨髓细胞、疾病患者的免疫状态评估等方面[3]。近年来国内外学者针对其分离纯化、结构和生物学功能等进行了大量的研究[4~6],但有关凝集素对病原菌的作用和免疫调节功能的研究尚未见报道[7~9]。
泥蚶(Tegillarca granosa Linnaeus), 俗称花蚶、血蚶等, 是栖息于沿海滩涂的广温性双壳类软体动物, 由于其营养丰富、味道鲜美, 深受大众喜爱[10],现为我国山东、江苏、浙江、福建和广东沿海等地的大宗养殖品种。本工作研究了泥蚶血清凝集素(TGL-h: The hemolymph lectin of T. granosa)和泥蚶肌肉凝集素(TGL-m: The muscle lectin of T. granosa)对作物病害的抑制作用和免疫调节功能, 旨在深入研究泥蚶的免疫学机制, 促进其养殖业的发展。
1 材料与方法
1.1 材料与试剂
实验用泥蚶购自福州市程埔市场; 兔和小鼠购自福建医科大学; 实验用菌均取自福建师范大学生命科学学院微生物学实验室。
层析用胶为Pharmacia产品; RPMI1640培养液为HyClone公司产品; 姬姆萨氏色素由Chroma公司进口分装; 福氏佐剂、福氏不完全佐剂为BBI产品; 琼脂为上海生物工程公司产品, 其他试剂为国产分析纯。
1.2 方法
1.2.1 泥蚶凝集素的制备
参照文献[11]、[12]制备泥蚶血清凝集素(TGL-h)和泥蚶肌肉凝集素(TGL-m)。为了提高纯度,用葡聚糖凝胶Sephadex G-100进行两次凝胶过滤。
1.2.2 淋巴细胞转化实验
按刘祖洞等[13]的全血微量培养法, 将15只健康昆明种小鼠随机分成2个实验组和1个对照组, 每组5只。在无菌条件下眼眶取血 0.3 mL, 加肝素(500单位/mL)抗凝, 放入 5 mL含 20%小牛血清 RPMI 1640培养液中, 其中 2个用药组培养液中另加质量浓度为0.25 mg/mL的TGL-h或TGL-m各200 µL, 每天摇动 2~3次, 于 37℃下培养 72 h后, 取出涂片,姬姆萨染色计数。淋巴细胞转化率平均转化率均用平均数±标准差表示, 并用t检验进行差异分析。
1.2.3 菌类生长抑制实验
1.2.3.1 抑菌实验
将TGL-h或TGL-m分别配置成浓度为100 mol/mL的溶液, 测定其抑菌活性。采用圆形纸片法[14],用接种环分别从 8种受试菌(5种细菌: 金黄色葡萄球菌(Staphylococcus aureus), 甘薯薯瘟病原细菌(Fasarium oxyssporam), 大肠杆菌(Escherichia coli);普通变形杆菌(Proteas valgaris), 八叠球菌(Sarcina lutea); 3种真菌: 啤酒酵母(Saccharomyces carlsbergensis), 玉米大斑病菌(Helminthos porium turcicum),稻瘟病菌(Piricularia oryzae))的斜面上刮取一环菌苔, 洗入5 mL无菌水中, 充分振荡摇匀, 得菌悬液。将细菌菌悬液倒入牛肉膏蛋白胨琼脂培养基中, 真菌菌悬液倒入马铃薯琼脂培养基中, 摇匀后分装到培养皿中。取消毒过的圆形滤纸片(直径约6 mm), 分别浸渍泥蚶血清或肌肉凝集素, 贴于琼脂平板上,共贴6枚纸片。培养后观测抑菌圈宽度的大小, 每一样品重复2次, 取平均值。
1.2.3.2 最小抑菌浓度的测定
采用同上的圆形纸片法, 将TGL-h或TGL-m进行梯度稀释, 以未见抑菌圈的最低浓度为最小抑菌浓度。
1.2.4 泥蚶凝集素血清学性质
1.2.4.1 抗血清的制备[15]
选用 2~3 kg新西兰雄性大白兔进行皮下免疫注射, TGL-h或TGL-m 0.5 mg/只; 20 d后再次加强TGL-h或TGL-m 0.35 mg/只; 最后间隔两周耳静脉注射0.1 mgTGL-h或TGL-m。7 d后取血得抗血清。1.2.4.2 双相免疫扩散实验
制备 1.2%琼脂凝胶扩散板, 按梅花形打孔, 将浓度约为1 mol/mL的TGL-h或TGL-m加入中央孔,外周各孔则按顺时针方向加入各抗血清, 并留一孔加入生理盐水作为对照。考马斯亮蓝染色, 以出现沉淀线的抗血清最高稀释度为其效价。
2 实验结果
2.1 淋巴细胞转化
图 1显示了小鼠淋巴细胞转化前后细胞形态上的变化。体积较小的细胞是未转化的小淋巴细胞, 其染色质呈深蓝色; 体积增大的淋巴细胞是转化后的原始型淋巴母细胞, 为小淋巴细胞的 3~4倍, 其核内染色质疏松呈细网状, 着色较浅, 核内可见明显的核仁0~4个。
经过对两种凝集素对小鼠淋巴细胞转化的结果比较分析(表 1), TGL-h的转化率和有丝分裂率分别比空白对照组提高了50.44%和20.15%; 而TGL-m的转化率和有丝分裂率则分别比空白对照组提高了73.59%和41.03%, 说明泥蚶凝集素均能明显促进小鼠淋巴细胞的转化。统计结果表明, TGL-h转化率与生理盐水对照组有极显著差异(P<0.01), 有丝分裂率则有显著差异(P<0.05); TGL-m转化率和有丝分裂率均明显高于生理盐水对照组(P<0.01), 说明 TGL-m比 TGL-h更有效增强细胞免疫功能, 促进小鼠淋巴细胞的转化。
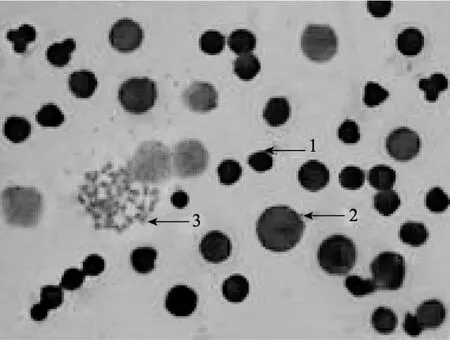
图1 小淋巴细胞转化为淋巴母细胞的照片(×400)Fig. 1 Murine lymphocyte transformation(×400)
2.2 菌类生长的抑制实验结果
2.2.1 抑菌活性
TGL-h和TGL-m对细菌和真菌都显示出了不同程度的抑制作用(表2)。在供试的5种细菌中, TGL-h对 4种菌都有抑制作用, 其中对大肠杆菌的抑制作用最大, 抑菌圈宽度达 6.8 mm, 其次为金黄色葡萄球菌, 抑菌圈宽度为 5.4 mm, 对甘薯薯瘟病原菌不敏感; TGL-m对3种细菌有抑制作用, 其中对普通变形杆菌抑制作用最强, 抑菌圈宽度为 6.7 mm, 其次为八叠球菌, 其抑菌圈宽度为 6.0 mm, 对金黄色葡萄球菌和大肠杆菌不敏感。两种凝集素对供试的 3种真菌均表现出了较强的抑制作用。TGL-h稻瘟病菌的抑制作用最强, 抑菌圈宽度达 6.3 mm; 而TGL-m对啤酒酵母的抑制作用最强, 抑菌圈宽度为7.0 mm。两种泥蚶凝集素对真菌的抑制作用大于对细菌的抑制作用。
2.2.2 最小抑菌浓度
TGL-h和TGL-m的最小抑菌浓度存在一定的差异(表 3)。TGL-h对大肠杆菌的最小抑菌浓度最低,仅6.25 mol/mL, 抑制强度随凝集素浓度的减小而减弱(图2); 同样条件下其抑制啤酒酵母的生长则需50 mol/mL的浓度。TGL-m浓度为6.25 mol/mL时, 也可观察到对普通变形杆菌和啤酒酵母的抑制作用,抑制强度也随凝集素浓度的减小而减弱(图 3); 其抑制甘薯薯瘟病原细菌的生长也需50 mol/mL的浓度。

表1 泥蚶凝集素对小鼠淋巴细胞转化的影响Tab.1 Effect of TGL on murine lymphocyte transformation
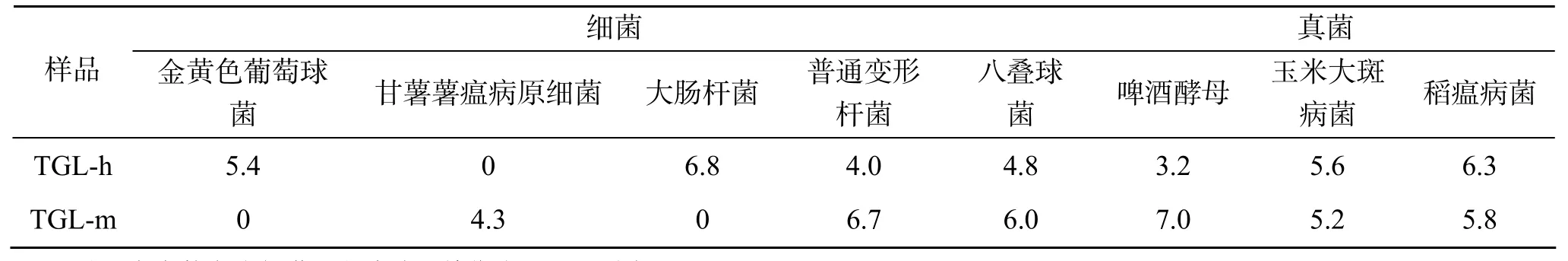
表2 泥蚶凝集素的抑菌活性Tab. 2 Antimicrobial activities of TGLa

表3 泥蚶凝集素的最小抑菌浓度Tab. 3 Minimum antimicrobial concentrations of TGL

图2 泥蚶血清凝集素抑制大肠杆菌的活性Fig. 2 Activitie of TGL-hemolymph against Escherichia coli
2.3 凝集素血清学性质
2.3.1 泥蚶凝集素抗血清的制备及效价测定
用TGL-h和TGL-m经过3次兔肌肉注射后, 得到的抗血清经琼脂扩散实验测定, 它们能与其相应的抗体结合出现明显的沉淀带, 效价分别为 1:32和1:16。
2.3.2 泥蚶凝集素免疫交叉反应
在梅花形打孔的中央孔加入抗血清, 周围孔按对角线位置加入TGL-h和TGL-m, 观察到TGL-h免疫得到的兔抗血清(中央孔)只能与 TGL-h(孔 1、4)产生沉淀线, 与 TGL-m(孔 2、5)不能形成免疫沉淀线(图 4)。而同样用兔抗 TGL-m(中央孔)的血清和TGL-m(孔 2、5)能发生免疫反应, 同TGL-h(孔 1、4)之间无沉淀线(图5)。

图3 泥蚶肌肉凝集素抑制普通变形杆菌(a)和啤酒酵母(b)活性Fig. 3 Antimicrobial activities of TGL-muscular against Proteas valgaris (a) and TGL-muscular against Saccharomyces (b)

图4 兔抗泥蚶血清凝集素血清交叉免疫双扩散Fig. 4 Crossed double immunodiffusion of antiserum against TGL-hemolymph
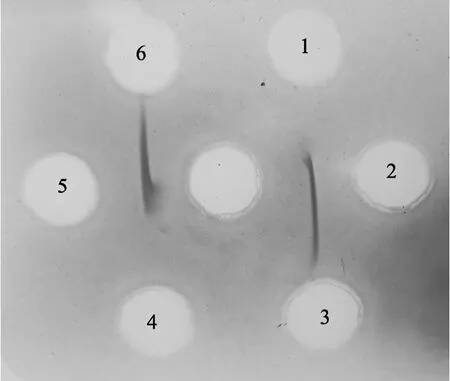
图5 兔抗泥蚶肌肉凝集素血清交叉免疫双扩散Fig. 5 Crossed double immunodiffusion of antiserum against TGL- muscular
3 讨论
凝集素在贝体内的分布有两种类型: 一类是体内不同部位含有相同性质但含量不等的凝集素。如在紫石房蛤(Saxidomuspurpuratus)的外套膜、足、闭壳肌、水管、鳃及消化器官内含有相同性质的凝集素, 以外套膜和足内的含量最高, 而在消化器官中最低。另一类是体内不同部位含有不同性质凝集素。余萍等[16]发现河豚的肝脏和卵巢所含的凝集素种类不同。朱呈智等[17]曾从粘虫幼虫体内提取两种以上的凝集素; Lothar Ren等[18]从鳗鱼血清中分离纯化出两种凝集素: MBL和FBL。对凝集素生物不连续性的研究多数集中在最适温度、pH方面的研究[19,20]。笔者在实验中也发现在泥蚶的不同部位存在两种天然凝集素, 其理化性质有较大差异, 本文是从免疫学的角度研究二者的同源关系。双向免疫扩散实验不仅可对抗原或抗体进行定性鉴定和测定效价, 还可对两种不同来源的抗原或抗体进行比较, 分析其所含成分的异同[15]。早在1980年Yoshida K等[21]就通过免疫扩散发现从同一种植物中分离出的糖结合专一性不同的凝集素之间没有兔疫交叉反应, 如草藤凝集素(Vicia cracca lectin)VCLI的抗血清不与VCLII作用。实验中虽然TGL-h和TGL-m来自于同一材料, 但兔抗TGL-h血清只能与TGL-h产生沉淀线, 与 TGL-m 却不能形成免疫沉淀线; 同样的, 兔抗 TGL-m血清和 TGL-m能发生免疫反应, 但同TGL-h之间无沉淀线, 说明两者抗原特性不同, 没有同源性, 是两类不同的物质。凝集素在泥蚶体内表现出的特异性笔者认为主要是二者在蛋白质构象上存在较大差别[11,12], TGL-h分子质量约为123 ku, 为两个亚基的蛋白质, 其相对分子质量分别为15 ku和16 ku, 而TGL-m分子质量约为238 ku, 为单个亚基的蛋白质, 其相对分子质量为60 ku。
分布在全身体液和组织中的淋巴细胞、浆细胞和巨噬细胞能够对外源细胞表面的抗原起识别功能,从而发现是非己细胞, 产生免疫排斥反应, 是机体维持免疫功能的基本保证。许多研究表明, 一些非特异性抗原, 如刀豆球蛋白A、美洲商陆等有丝分裂素有高度的调理作用[22], 可以刺激小淋巴细胞转化为母细胞[23], 调理巨噬细胞的吞噬活性。如贻贝的一种凝集素能使其血细胞增强对酵母细胞的吞噬作用,促使入侵者被主体确认。拟菊海鞘血淋巴中对乳糖有特效的凝集素即HA-2使颗粒物更有效地被摄取。本实验采用全血微量培养的淋转实验测定TGL-h和TGL-m对细胞免疫的调节作用, 结果发现二者均能明显地促进小鼠淋巴细胞的转化, 促进淋巴细胞分裂, 不失为两种较为理想的促有丝分裂原和细胞转化刺激物, 在治疗免疫功能低下方面可能具有一定的应用价值。
从双壳类体内分离凝集素进行抗菌活性的研究目前还比较少, 大多都是直接抽取贝类血淋巴进行实验。魏玉西[24]报道菲律宾蛤仔(Ruditapes philippinarum)血淋巴中对金黄色葡萄球菌(Staphylococcus aureus)和鳗弧菌(Vibrio anguillarum)具有较强的抗菌活性; 贻贝(Mytilus edulis)血淋巴对金黄色葡萄球菌和四联微球菌(Micrococcus tetragenus)有抑菌活性;毛蚶(Scapharca subcrenata)血淋巴中含有对金黄色葡萄球菌和鳗弧菌有抑菌活性的物质。实验中TGL-h和TGL-m对革兰氏阳性与阴性细菌均有一定的凝集作用, 其机制可能就是凝集素通过与暴露在细菌表面的GlcNAc基团结合, 来识别革兰氏阳性菌的磷壁酸及革兰氏阴性菌的脂多糖, 从而使某些细菌发生凝集反应。凝集素作为无脊椎动物一种重要的体液免疫因子, 拥有专一性受体识别因子, 它们通过与糖蛋白或糖脂相互作用凝集细胞或沉淀糖缀合物的碳水化合物结合蛋白或糖蛋白。因此凝集素可充作识别分子, 识别自身和非自身物质, 并具有化学趋化性使之向病原体移动, 并伴随着吸附作用最终将病原体吞噬, 从而在贝类的免疫防御中起着重要的作用[25]。
从本实验结果可以看出, 我国沿海的泥蚶具有较强的促进免疫活性等生物学功能, 应进一步加以研究和利用。目前, 笔者对 TGL的结构分析和活性作用机理等方面的研究正在进行中, 以期揭示其细胞识别的分子生物学机理。
[1] Liener I E.Phytohemagglutinins (Phygolectins)[J].Ann Rev Physiol, 1997, 27: 291-319.
[2] 陈惠黎, 王克夷.糖复合物的结构与功能[M].上海:上海医科大学出版社.1997. 301-322.
[3] Lis H, Sharon N.Lectin as molecules and tools[J].Ann Rev Biochem, 1986, 55: 35-40.
[4] Rini J M.Lectin structure[J].Ann Rev Biophys Biomol Struct, 1995, 24: 551-577.
[5] Kumar M A, Timms D E, Neet K E,et al. Characterization of the lectin from the bulbs ofEranthis hyemalis(winter aconite) as an inhibitor of protein systhesis[J].J Biol Chem, 1993, 268: 25 176– 25 183.
[6] 孙建忠, 王克夷.植物凝集素的超级家族[J].生物化学与生物物理进展.1994, 21(2): 104-109.
[7] Chrispeels M J, Raikhel N V.Lectins, lectin genes and their role in plant defense[J].Plant Cell, 1991, 3: 1-9.
[8] Peumans W J, van Damme J M.Lectin as plant defense proteins[J].Plant Physiol, 1995, 109: 347-352.
[9] 曾仲奎, 吴洽庆, 鲍锦库, 等.棉花凝集素对枯萎病菌的抑制作用与其受体的研究[J].四川大学学报(自然科学版).1995, 32(3): 338-342.
[10] 谢起浪, 张炯明, 柴雪良, 等.泥蚶人工育苗技术探讨[J].浙江海洋学院学报(自然科学版).2001, 20(3):199-201.
[11] 陈寅山, 柯佳颖, 饶小珍.泥蚶(Tegillarca granosaLinnaeus)血淋巴液凝集素的分离纯化及其性质研究[J].分子细胞生物学报.2006, 39(5): 453-461.
[12] 柯佳颖, 陈寅山, 戴聪杰.泥蚶肌肉凝集素的分离纯化及部分性质[J].泉州师范学院学报(自然科学版).2008, 26(2): 100-105.
[13] 刘祖洞, 江绍慧.遗传学实验(第二版)[M].北京: 高等教育出版社, 1987, 150-157.
[14] 施炜星, 孙册.红花菜豆(矮生红花变种)凝集素的生物学作用[J].生物化学杂志.1995, 11(5): 567-573.
[15] 朱立平, 陈学清主编.免疫学常用实验方法[M].北京: 人民军医出版社.2000,19-22.
[16] 余萍, 林曦.河豚内脏提取物的部分生物学活性[J].药物生物技术, 2000,7(4): 236-238.
[17] 朱呈智, 李海峰, 赵刚, 等.粘虫幼虫血清、血浆及血细胞裂解液凝集活性的比较研究[J].南开大学学报(自然科学版), 1993, 4: 13-17.
[18] Renwrantz L.A.Stahmer opsonining properties of an isolated haemolymph agglutinin and demonstration of lectin molecule at the surface of haemocytes ofMytilus edulis[J].Comp Physiol, 1983, 149: 535-546.
[19] 戴聪杰, 陈寅山, 谢进金, 等.罗氏沼虾血清及肌肉提取液凝集活性的比较研究[J].泉州师范学院学报(自然科学).2005, 23(2): 68-71.
[20] 王新生, 胡宝庆, 文春根.褶纹冠蚌血清和肌肉凝集素的活性研究[J].水生态学杂志.2008, 1(2): 95-100.
[21] Yoshida K, Takahashi M, Haga K,et al.Comparison of three blood-clotting substances inStaphylococcus aureusstrains[J].J Clin Microbiol, 1980, 11(3): 293-294.
[22] 王长法, 张士璀, 王昌留.水生无脊椎动物凝集素研究概述[J].海洋科学, 2005, 29(4): 63-67.
[23] Yoshimoto R, Kondoh N, Isawa Met al.Plant lectin,AIFl011, on the tumor tumpr-specific immunity through activation of T cells specific for the lectin[J].Cancer Immunology Immunotherapy, 1987, 25: 25-30.
[24] 魏玉西, 郭道森, 李丽, 等.几种海产双壳贝类血淋巴中抗菌物质的诱导及其活性测定[J].海洋科学,2002, 26(8): 5-8.
[25] Tamplin M L, Fisher W S.Occurrence and characteristics of agglutination ofVibrio choleraeby serum from the eastern oyster,Crassostrea virginica[J].Appl Environ Microb, 1989, 55: 2 882-2 887.
Received: Nov, 6, 2009
Key words:Tegillarca granosa; lectins; antibacterial activity; immunological properties
Abstract:Lymphocyte transformation and antimicrobial experiment were tested with two lectins (TGL-h and TGL-m), which were extracted from hemolymph and muscle ofTegillarca granosa. These two lectins had immune-regulating function in lymphocyte transformation; in addition, they showed different degrees of inhibition of five bacteria,Staphylococcus aureusFasarium oxyssporam,Escherichia coli,Proteas valgaris, andSarcina lutea,and three fungi,Saccharomyces carlsbergensis,Helminthos porium turcicum, andPiricularia oryzae. The inhibition of fungi was greater than the inhibition of bacteria. The two antisera did not cross-react in double immunodifusion experiments, indicating that these two lectins do not have homology.
(本文编辑:康亦兼)
The antibacterial activity and immunological properties of lectins from Tegillarca granosa Linnaeus
KE Jia-ying1, CHEN Yin-shan2, DAI Cong-jie1
(1. Bioengineering Depatrment, Quanzhou Normal University, Quanzhou 362000, China; 2. College of Life Sciences, Fujian Normal University, Fuzhou 350007, China)
Q959.215+.2
A
1000-3096(2010)11-0035-06
2009-11-06;
2010-04-15
福建省教育厅A类科技项目(JA09213); 福建省高校服务海西建设重点项目(No. A101); 泉州师范学院重点学科项目(No. XK0609);泉州师范学院大学生科研基金项目(2009DA023)
柯佳颖(1981-), 女, 福建泉州人, 硕士, 讲师, 主要从事生物化学研究, 电话: 0595-22288062, E-mail: kejiaying2003@163.com
