产过氧化氢酶菌株CE-1的筛选与鉴定
2010-09-24张增祥郝建华
张增祥, 王 伟 郝建华 牛 瑞 孙 谧
(1. 中国水产科学研究院 黄海水产研究所海洋产物资源与酶工程实验室, 山东 青岛 266071; 2. 上海海洋大学 食品学院, 上海 201306)
产过氧化氢酶菌株CE-1的筛选与鉴定
张增祥1,2, 王 伟1, 郝建华1, 牛 瑞1, 孙 谧1
(1. 中国水产科学研究院 黄海水产研究所海洋产物资源与酶工程实验室, 山东 青岛 266071; 2. 上海海洋大学 食品学院, 上海 201306)
经过含 H2O2的平板初筛和摇瓶发酵复筛, 从保存的水样中筛选到一株过氧化氢酶高产菌株CE-1,其所产过氧化氢酶活性和比活分别为1 356.2 U/mL和3 401 U/mg。菌株CE-1为革兰氏阴性杆状细菌,根据其形态特征、16S rRNA基因序列系统进化树分析和生理生化特性, 以及属内不同种间性状差异等因素的综合分析, 将菌株CE-1鉴定为气单胞属(Aeromonas)细菌。
过氧化氢酶;分离;鉴定;系统发育学分析
过氧化氢酶(hydroperoxidase, catalase, 过氧化氢氧化还原酶, EC1.11.1.6)是一类广泛存在于动物、植物和微生物体内的末端氧化酶, 能够高效催化过氧化氢分解, 具有清除生物体内自由基, 保护细胞免受损害等作用[1]。由于其高效催化的能力, 近年来广泛用于食品、医学诊断以及纺织、造纸等工业领域[2]。近几十年来过氧化氢酶一直是国内外研究的热点[3], 而目前国内对微生物过氧化氢酶的研究主要集中在其发酵生产、酶学性质和应用方面[2,4~11]。本实验是在对实验室所保存的水样进行广泛筛选的基础上, 筛选分离出一株高过氧化氢酶活性的菌株并对其进行了分类鉴定以及系统发育学分析, 为下一步的研究奠定了基础。
1 材料和方法
1.1 实验材料
基础培养基: 蛋白胨 1%, 牛肉膏 0.3%, NaCl 0.5%, pH 7.0~7.5。
1.2 主要试剂和仪器
考马斯亮蓝G250, USB公司; ExTaq DNA聚合酶,大连宝生物工程有限公司; 其他试剂均为国产分析纯。
Nikon 50i型显微镜: 日本 Nikon公司; Sonics VCF1500超声破碎仪: 美国 Sonics公司; 日立高速冷冻离心机: 日本HITACHI公司; 752N紫外可见光分光光度计: 上海精密科学仪器有限公司; PCR仪:德国Whatman Biometra公司。
1.3 水样
所用水样为中国水产科学研究院黄海水产研究所海洋产物资源与酶工程实验室保存。
1.4 产过氧化氢酶菌株的筛选和分离
1.4.1 初筛
含 2%(w/v)琼脂的基础培养基灭菌后冷却至50℃加入H2O2, 使终浓度达1 mmol/L。倒平板。以200 µL样品涂布, 25 ℃培养24 h。生长出的单菌落划斜面保藏。
1.4.2 复筛
初筛获得的菌株从斜面接入含50 mL基础培养基的250 mL摇瓶。200 r/min, 25 ℃条件下培养24 h。离心收菌体, 以pH 7, 50 mmol/L磷酸盐缓冲液重悬菌体并在冰浴中超声破碎。离心后取上清测过氧化氢酶活性和蛋白含量。
1.5 酶活力和蛋白含量的测定
过氧化氢酶酶活力采用紫外分光光度法[12]。测无菌体的发酵液和破碎后上清的活性。酶活性以H2O2在 240 nm处分解速率进行计算。反应体系为50 mmol/L pH 7磷酸盐的钠盐缓冲液, H2O2浓度20 mmol/L。取一定量样品加到1 mL磷酸盐缓冲液中,在比色杯中混匀, 再迅速加入以磷酸盐缓冲液配制的40 mmol/L的H2O21 mL起始反应。以时间(x)对吸光度(y)作图, 直线回归计算出斜率即反应速率。将25 ℃每分钟消耗 1µmol H2O2的酶量定义为一个活力单位。
蛋白含量测定采用Bradford法[13]。过氧化氢酶比活力计算公式:

1.6 形态特征的观察
将经过筛选所确定的菌株, 平板划线, 25 ℃培养24 h, 观察菌落形态并进行革兰氏染色[14]。
1.7 16S rDNA的PCR扩增和测序以及系统发育树分析
提取细菌总 DNA, 以 16S rDNA通用引物:27f(5’-AGAGTTTGATCCTGGTCAG-3’)和 1492r(5’-CGGCTACCTTGTTACGAC-3’)扩增, PCR 反应体系和扩增程序参考文献[15]。
PCR产物送上海生工测序。将所测定菌株的16S rDNA序列通过BLAST检索已有序列, 进行相似性比较分析, 下载与实验菌株亲缘关系较近的序列, 用Clustal X软件进行多序列比对, 采用MEGA4软件的邻接法(neighbor-joining method)进行系统发育分析。
1.8 产过氧化氢酶菌株的生理生化鉴定
根据菌株培养特征,细胞形态,革兰氏染色和氧化酶反应选择法国梅里埃公司API 20E试剂条,测定菌株生理生化反应,并参照《Bergey’s Manual of Systematic Bacteriology》进行鉴定。
2 结果与分析
2.1 菌株筛选
2.1.1 初筛结果
用含高浓度过氧化氢的平板进行初筛, 25 ℃培养24 h后初筛平板上出现肉眼可见的菌落, 说明在水样中存在过氧化氢酶活性较高的菌株。将生长出的菌落分别划线分离, 共筛选到 14株高活性菌株,斜面培养基4 ℃保藏。
2.1.2 复筛结果
上述14株菌株经过摇瓶发酵培养后, 测定酶活性和蛋白质含量。结果显示, 比活力大于1 200 U/mg的菌株仅有7株。这7株菌分别经8次摇瓶传代培养后, 仅有1株的产酶稳定性较好, 酶活力和比活分别达到1 356.2 U/mL和3 401 U/mg, 是第一代菌株酶活性的90.2%, 而其他菌株均低于80%。故确定该菌为下一步的实验菌株, 并命名为CE-1。
2.2 菌株鉴定结果
2.2.1 形态特征
菌株 CE-1在基础培养基平板上25 ℃培养24 h,菌落为乳白色、微凸、易挑取, 表面光滑湿润、边缘整齐。菌体大小约为 0.2~0.5 μm×1.0~4.4 μm; 革兰氏染色阴性; 呈杆状, 圆端, 单个或短链状排列。
2.2.2 菌株CE-1的16S rDNA序列和系统发育树分析
产过氧化氢酶菌株CE-1的16S rDNA PCR产物测序, 获得长度为1384 bp的序列(登录号GQ161962)。与 GenBank已有序列进行比较, 菌株 CE-1的 16S rDNA与豚鼠气单胞菌(Aeromonas caviae)的序列(登录号X74674)完全一致。用MEGA4软件的邻接法构建系统发育树(图1), 可见CE-1是气单胞属细菌。
2.2.3 生理生化特征
将菌株CE-1和系统发生学相关的气单胞菌属菌株的特性进行比较, 可见存在明显差别(表1)。
16S rDNA序列分析一般应用于区分和确定属之间的关系, 通常不能以此作为定种的依据, 而且在相似度达到 97%以及以上时会大大降低鉴定的可靠性[16,17]。而在气单胞菌属中各菌种的16S rDNA相似度都很高, 根据16S rDNA相似性无法确认CE-1是豚鼠气单胞菌。菌株CE-1的生理生化性状同16S rDNA相似菌株(包括豚鼠气单胞菌)的性状的比较中,产半乳糖苷酶、产精氨酸双水解酶、产明胶酶、使山梨醇氧化/发酵、产细胞色素氧化酶、使葡萄糖氧化和使苦杏仁苷氧化/发酵等指标中存在很大的差异,这些生化指标的差别会影响将CE-1鉴定到种的准确性, 因此将其鉴定为气单胞菌属细菌。
3 结论
采用添加 H2O2的平板培养基, 从实验室所保存的水样中筛选到具有高效产生过氧化氢酶能力的菌株CE-1, 并用API 20E试剂条和16S rDNA序列进行综合分析, 将这株细菌鉴定为气单胞属细菌。菌株CE-1产酶稳定性良好, 经过摇瓶发酵测得酶活力和相对酶活分别达到1 356.2 U/mL和3 401 U/mg, 这与国内外报道的产过氧化氢酶菌株相比有一定的优势(表 2)。本实验再次证明 H2O2平板法筛选高活性过氧化氢酶菌株是方便有效的[12]。而且在目前产过氧化氢酶菌株的大量研究中, 尚未见气单胞菌属细菌高产过氧化氢酶的报道, 该菌株的成功分离提供了新的产过氧化氢酶微生物资源, 同时也丰富了对气单胞菌的认识。

图1 菌株CE-1的系统发育学地位Fig. 1 Phylogenetic Status of strain CE-1
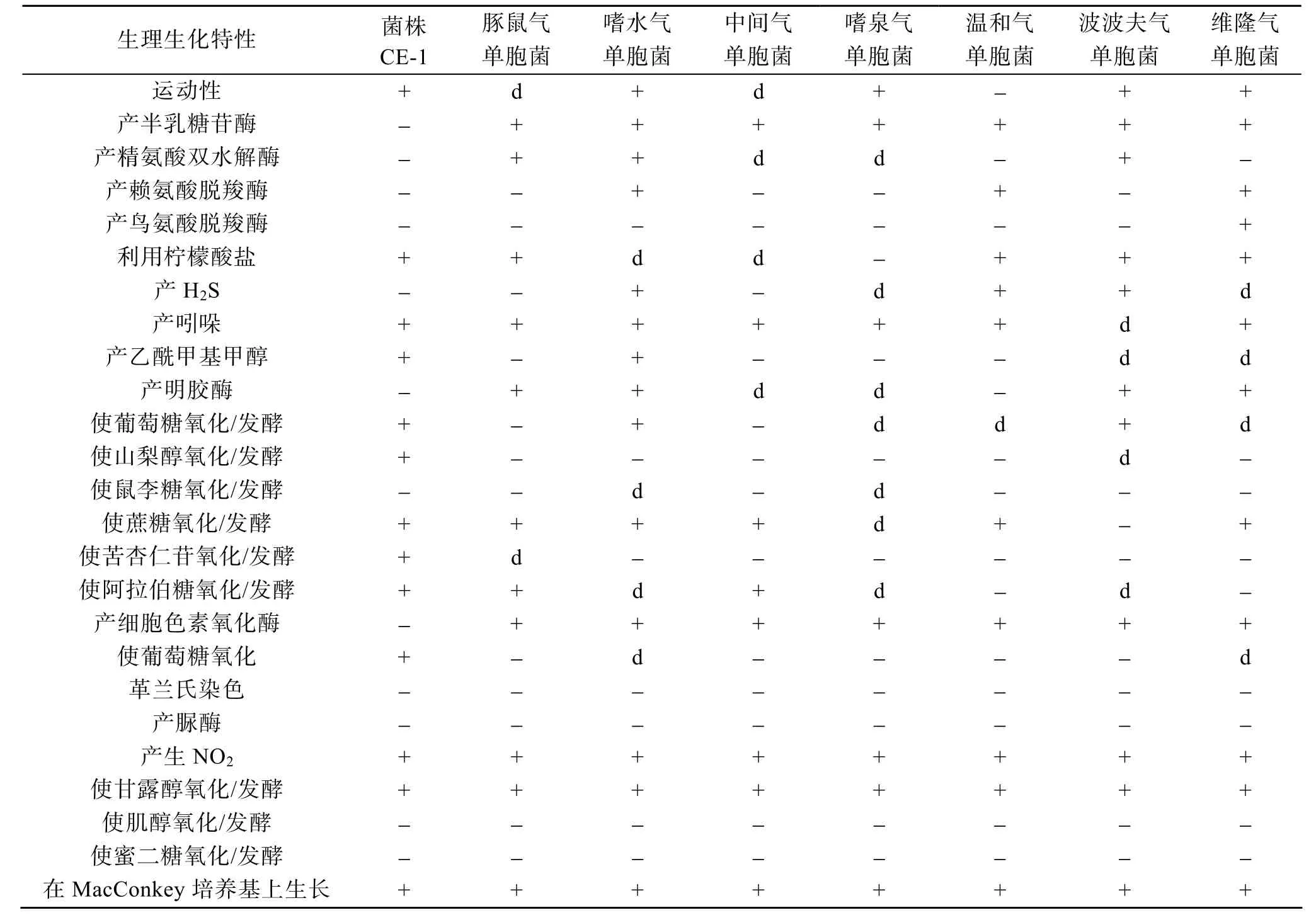
表1 菌株CE-1和系统发生学相关的气单胞菌属菌株的生理生化特征比较Tab. 1 Comparison of physiological characteristics of strain CE-1 with related Aeromonas species

表2 一些菌株产过氧化氢酶水平比较Tab. 2 Comparison of catalase production by different strains quantitated by activity in medium
目前从Aspergillus niger分离纯化得到的过氧化氢酶已经进行了工业生产和商业应用, 其所产过氧化氢酶酶活力为 4000 U/mg[23], 本实验所筛选得到的菌株CE-1所产过氧化氢酶的比活可达3 401 U/mg,对比可见CE-1具有较大的开发应用潜力, 是一株值得深入研究的菌株。下步的工作将对该菌株诱变育种以及最佳培养条件进行优化, 同时, 本实验的开展为后续酶的分离纯化以及性质研究等提供了必要的基础, 也对下一步的研究具有重要的指导意义。
[1] Schriner S E, Linford N J, Martin G M, et al. Extension of murine life span by overexpression of catalase targeted to mitochondria[J]. Science, 2005, 308(5 730):1 909-1 911.
[2] 曹翔宇, 华兆哲, 燕国梁, 等. 过氧化氢酶发酵生产条件优化及在染整清洁生产中的应用研究[J]. 工业微生物, 2006, 36(4): 7-12.
[3] 刘冰, 梁婵娟. 生物过氧化氢酶研究进展[J]. 中国农学通报, 2005, 21(5): 223-232.
[4] 段绪果, 沈微, 李艳丽, 等. 耐热过氧化氢酶基因工程菌的构建及其发酵条件[J]. 食品与生物技术学报,2006, 25(2): 74-78.
[5] 陆挺, 汪成富, 戴英, 等. 过氧化氢酶发酵性能的研究[J]. 苏州大学学报(自然科学), 2001, 17(3): 95-97.
[6] 王凡强, 王正祥, 邵蔚蓝, 等. 热稳定性过氧化氢酶工程菌株发酵条件的研究[J]. 食品与发酵工业, 2002,28(2): 11-14.
[7] 刘建忠, 刘杰, 翁丽萍, 等. 巯基乙酸对过氧化氢酶的激活及其机制研究[J]. 中山大学学报(自然科学版),2001, 40(6): 39-41.
[8] 王凡强, 王正祥, 邵蔚蓝, 等. 重组大肠杆菌热稳定性过氧化氢酶的纯化及性质研究[J]. 微生物学报,2002, 42(3): 348-353.
[9] 刘昌龄, 王国庆. 细菌过氧化氢酶的分离、结晶及性质[J]. 生物化学与生物物理进展. 1990, 17(5):380-383.
[10] 冷晒祥, 钱国坻, 华兆哲, 等. 过氧化氢酶的棉针织物漂染工艺研究[J]. 印染, 2006, 32(19): 1-3.
[11] 花慧, 黄松, 沈国强, 等. 不同防腐剂对过氧化氢酶防腐效果的研究[J]. 食品添加剂, 2005, 26(1):167-169.
[12] WANG Wei, SUN Mi, LIU Wan-shun. Isolation and characterisation of H2O2-decomposing bacteria from Antarctic seawater[J]. Annals of Microbiology, 2008,58(1): 29-33.
[13] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dyebinding[J]. Analytical Biochemistry, 1976, 72 (1-2): 248-254.
[14] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001. 353-388.
[15] Rousseaux S, Hartmann A, Soulas G. Isolation and characterisation of new Gram-negative and Grampositive atrazine degrading bacteria from different French soils[J]. FEMS Microbiology Ecology, 2001,36 (2-3): 211-222.
[16] George M. Garrity, Don J. Brenner, et al. Bergey’s Manual of Systematic Bacteriology 2nd Edition[M].New York: Springer, 2005: 556-571.
[17] Stackebrandt E, Goebel B M.Taxonomic note: a place for DNA-DNA Reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology[J]. International Journal of Systematic Bacteriology, 1994, 44(4): 846-849.
[18] 唐丹玲, 唐文胜. 产过氧化氢酶的乳酸菌的筛选和产酶条件的研究[J]. 食品与发酵工业, 1992, 6: 30-33.
[19] 周一, 严自正, 卢运玉, 等. 耐热过氧化氢酶产生菌的筛选和发酵条件的研究[J]. 微生物学报, 1990,30(3): 223-227.
[20] 赵志军, 华兆哲, 刘登如, 等. 碱性过氧化氢酶高产菌的筛选、鉴定及发酵条件优化[J]. 微生物学通报,2007, 34(4): 667-671.
[21] Petruccioli M, Fenice M, Piccioni P, et al. Effect of stirrer speed and buffering agents on the production of glucose oxidase and catalase by Penicillium variabile(P16) in benchtop bioreactor[J]. Enzyme and Microbial Technology, 1995, 17(4): 336-339.
[22] Fiedurek J, Gromada A. Production of catalase and glucose oxidase by Aspergillus niger using unconventional oxygenation of culture[J]. Journal of Applied Microbiology, 2000, 89(1): 85-89.
[23] Yumoto I, Yamazaki K, Kawasaki K, et al. Isolation of Vibrio sp. S-l exhibiting extraordinarily high catalase activity[J]. Journal of Fermentation and Bioengineering, 1998, 85(1): 113-116.
Received: Dec., 10, 2009
Key words:Catalase; Isolation; Identification; Phylogenetic analysis
Abstract:Catalase-producing strain CE-1 was isolated from water samples using H2O2-containing plate screening and activity assay of the shake flask culture method. The values of the activity and specific activity were 1356.2 U/mL and 3401U/mg, respectively. CE-1 was Gram negative and rod in shape. Based on the comprehensive analysis of morphological and physiological characteristics, the 16S rDNA phylogenetic tree, and the differences among different species of Aeromonas, strain CE-1 was identified to be Aeromonas.
(本文编辑:康亦兼)
Isolation and identification of catalase-producing strain CE-1
ZHANG Zeng-xiang1,2, WANG Wei1, HAO Jian-hua1, NIU Rui1, SUN Mi1
(1. Laboratory of Marine Products and Enzyme Engineering, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 2. College of Food Science & Technology, Shanghai Ocean University, Shanghai 201306, China)
Q554+.6
A
1000-3096(2010)11-0054-05
2009-12-10;
2010-04-20
国家高技术研究发展(863)计划项目(2007AA091602); 国家自然科学基金项目(41006119); 中国水产科学研究院黄海水产研究所
基本科研业务费专项资金项目(2010-gy-01)
张增祥(1984-), 男, 山东安丘人, 硕士研究生, 主要从事微生物过氧化氢酶研究, 电话: 0532-85833961; E-mail: zhangzengxiang@yeah.net;孙谧, 通信作者, 电话: 0532-85819525, E-mail: sunmi@ysfri.ac.cn
