猪圆环病毒2型湖南株的分离与序列分析*
2010-09-21何世成刘道新鲁杏华吴发兴谈志祥郭成玲张燕霞
何世成,刘道新,张 志,鲁杏华,吴发兴,邹 敏,谈志祥,郭成玲,张燕霞
(1.湖南省动物疫病预防控制中心,湖南长沙 410007;2.中国动物卫生与流行病学中心,山东青岛 266034;3.湖南省动物卫生监督所,湖南长沙 410007)
猪猪圆环病毒2型(Porcine circovirus type 2,PCV-2)是圆环病毒科圆环病毒属的成员,是导致断乳后仔猪多系统衰竭综合症(Post-weaning multisystemic wasting syndrome,PMWS)的主要病原[1]。自1997年加拿大首次报道[2]以来,已在许多国家出现感染和流行。1999年朗洪武在北京、河北等地猪场中首次检测到猪圆环病毒2型在我国的存在[3],此后国内许多实验室也相继检测、分离到该病毒,并进行很多相关研究[4-6]。
根据PCV致病性和核酸序列的不同,猪圆环病毒可分为PCV-1和PCV-2,PCV-1认为是PK-15细胞培养的污染物,无致病性,基因组全长1 759 bp,而PCV-2却具有致病性,并已认为PCV-2是PMWS的主要病原,其基因组全长1 767 bp(或1 768 bp),PCV-1与PCV-2型内同源性都在90%以上,但两型间的同源性小于80%[7]。目前,PCV-2基因组序列相对稳定,但分离自不同地区的毒株会有一定的差异。从湖南省2003年-2008年疑似PMWS病死猪组织中分离到7株PCV-2,并进行了全基因测序和遗传进化分析,对湖南省6年来的PCV-2分子流行病学进行了研究。
1 材料与方法
1.1 材料
1.1.1 病料与试剂 病料为2003年-2008年湖南省内疑似PMWS病死猪的组织(包括肺与淋巴结)。PK-15细胞、宿主菌 TG-1由农业部动物检疫所流行病研究中心实验室提供;pMD 18-T Vector、r Taq 、dNTPs、DNA Marker、氨苄青霉素(Amp)、DNA胶纯化回收试剂盒购自宝生物工程(大连)有限公司。DNAzol Reagent为Invitrogen公司产品。HindⅢ、Bam HⅠ内切酶购自Promega公司。
1.1.2 引物 参考GenBank 2003年上海PCV2分离株全基因组序列(AY291318),利用DNA Star软件包中的Primer Select软件进行引物设计。
引物 1:5′-AACCTTAACCT T TCT TAT TC-3′
引物 2:5′-TTGAATTCTGGCCCTGCTCCC-3′
引物1、2扩增片段长 1 767 bp或1 768 bp,引物由宝生物工程(大连)有限公司合成,用前溶解于灭菌的TE(pH 8.0)中,稀释至浓度为50 pmol/μ L,分装保存于-20℃。
1.2 方法
1.2.1 病毒培养 将病死猪组织(肺与淋巴结)研磨粉碎(与PBS 1∶5),冻融3次,10 000 r/min离心10 min,取上清用氯仿抽提,除去具有囊膜的病毒。经0.22 μ m滤器过滤后接种PK-15细胞,12 h后弃去培养液,用300 mmol/L的 D-氨基葡萄糖处理30 min,经PBS洗涤后换上新鲜的培养液继续培养48 h。连续盲传4代,每次消化分瓶后12 h,均用300 mmol/L的D-氨基葡萄糖处理30 min。
1.2.2 病毒 DNA提取 每10 cm2细胞面上加1 mL DNA zol Reagent,摇动培养瓶以裂解细胞,小心将裂解物移入一离心管中,加入500 μ L无水乙醇,颠倒混匀,室温放置5 min,DNA呈可见絮状物析出,用灭菌枪头小心将DNA挑至另一离心管,加入1 mL 750 mL/L的乙醇洗涤两次,空干15 s后,缓慢加入200 μ L 8 mmol/L的 NaOH 溶液溶解DNA。置-20℃冻存备用。取10 μ L用作PCR模板。
1.2.3 PCR扩增 所加PCR成份按试剂盒说明书,PCR扩增条件为95℃变性5 min;94℃1 min,54℃1 min,72℃2.5 min,35循环;72℃延伸10 min,4℃保存。PCR产物在含溴化乙锭的10 g/L琼脂糖凝胶上电泳,紫外光下观察PCR扩增结果。
1.2.4 PCR扩增产物的克隆与酶切鉴定 PCR产物在10 g/L琼脂糖电泳后,切下含有目的条带的琼脂块,用DNA胶纯化回收试剂盒回收凝胶中的DNA 。取5 μ L胶回收产物与1 μ L pMD 18-T Vector和4 μ L Ligation Solution在4 ℃下连接过夜;按常规方法转化TG-1感受态细胞。
挑取白色菌落接种LB液体培养基,37℃震摇过夜。以碱裂解法小量堤取质粒。用 HindⅢ、Bam HⅠ内切酶双酶切鉴定重组质粒,以切出约为1.7 kb片段的质粒为阳性重组质粒。
1.2.5 测序分析 将阳性重组质粒送宝生物工程(大连)有限公司测序。应用DNA Star软件对序列进行分析比对。比对用序列来自GenBank,其中13株为PCV-2,2株为PCV-1(表1)。
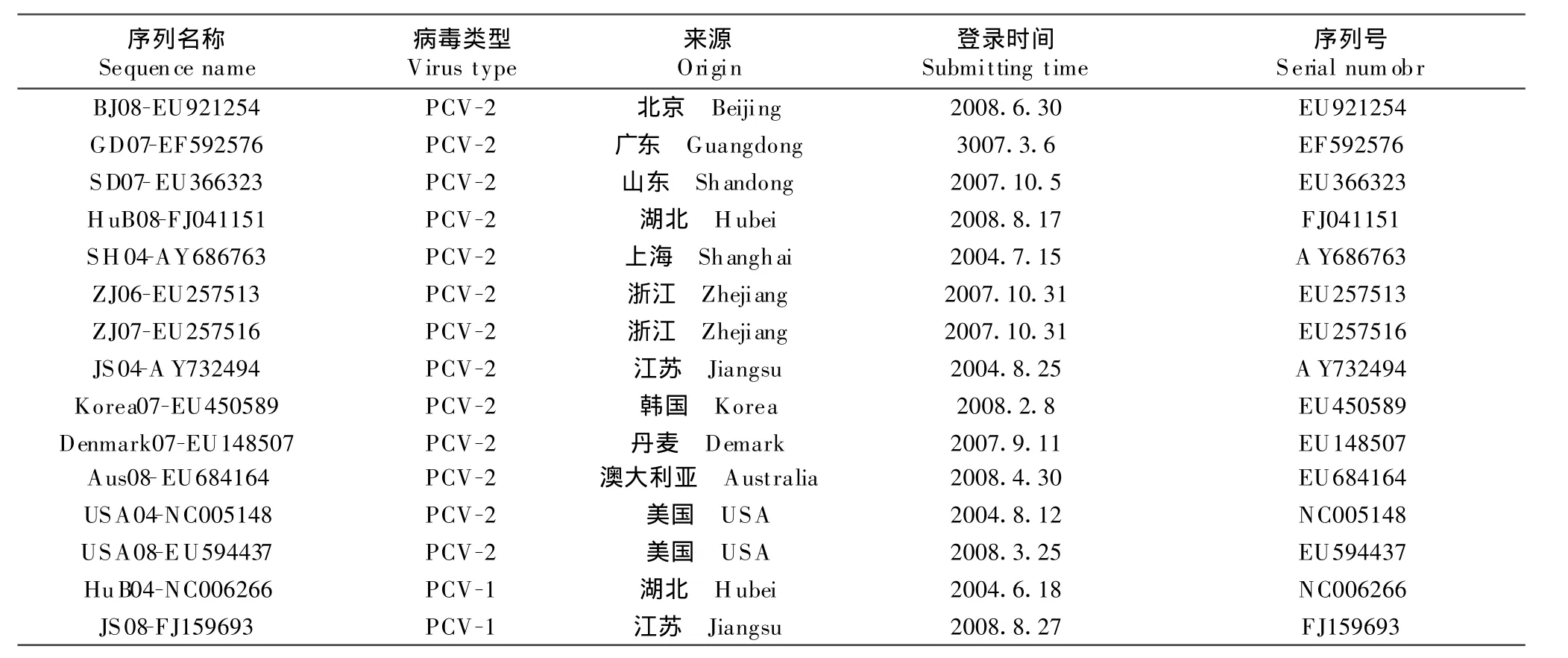
表1 比对用GenBank序列Table 1 T he refered sequences of PCV isolates from GenBank
2 结果
2.1 病毒分离结果
从2003年-2008年,共分离获得了7株PCV-2湖南株,分离时间和数量分别为2003年1株(HuN-03)、2005年 1株(HuN-05)、2006年 2株(HuN-0601、HuN-0602)、2007年 2株(HuN-0701、HuN-0702)、2008年1株(HuN-08)。每分离1株即进行基因组的克隆测序。
2.2 病毒基因组PCR扩增、克隆
对PK-15病毒培养液进行病毒基因组DNA的PCR扩增,将PCR扩增产物与pMD 18-T载体连接,并转化 TG-1感受态细胞,用 HindⅢ、Bam HⅠ双酶切鉴定筛选阳性克隆。图1和图2是1株全基因组PCR扩增结果和阳性重组质粒的双酶切鉴定结果。
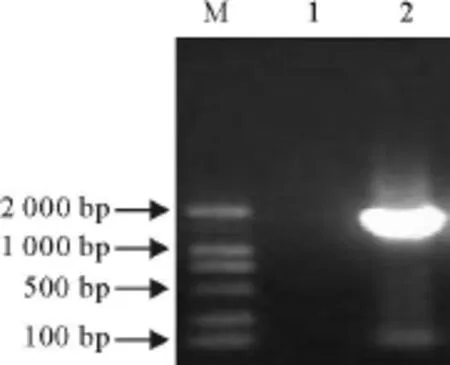
图1 PCV-2分离株全基因组PCR扩增结果Fig.1 The amplified result of complete genome of PCV-2 isolate by PCR

图2 阳性重组质粒双酶切鉴定 Fig.2 Identification of the recombinant plasmid by double enzyme digestion
2.3 PCV-2全基因组测序与基因组结构分析
7株湖南 PCV-2分离株全基因序列均为1 767 bp,都包括11个潜在的开放阅读框(ORF),每个ORF的基因组定位与所编码的多肽分子质量如下:ORF1(51 nt~995 nt,35.8 ku),ORF2(1 033 nt~ 1 734 nt,27.8 ku),ORF3(357 nt~671 nt,11.9 ku),ORF4(386 nt~565 nt,6.5 ku),ORF5(1 016 nt~1 036 nt,0.76 ku),ORF6(1 521 nt~ 1 610 nt,3.0 ku),ORF7(1 681 nt~1 740 nt,2.0 ku),ORF8(688nt~753nt,2.4 ku),ORF9(1 731 nt~92 nt,4.5 ku),ORF10(1 523 nt~ 1 630 nt,4.2 ku)和 ORF11(989 nt~1 033 nt,1.8 ku),其中ORF1、ORF2是最大的两个ORF,分别编码复制相关蛋白(Rep蛋白)和病毒衣壳蛋白(CaP蛋白)。7株湖南PCV-2分离株基因组上都具有保守的茎环结构(5-GAAGTGCGCTGTAAGTAT TACCAGCGCACTTC-3)和9碱基基序(5-AAGTATTAC-3′),与其他PCV-2分离株一致。
2.4 PCV-2全基因组的序列比较与分析
将7株湖南PCV-2分离株与GenBank上的8株国内PCV-2株、5株国外 PCV-2株、2株国内PCV-1株序列进行比对分析,同源性分析结果显示(图3),我省7株 PCV-2株间同源性在94.9%~99.3%之间,与13株国内外PCV-2基因组同源性在93.6%~99.7%之间,与2株PCV-1亲缘关系较远,同源性只有75.7%~76.5%。
遗传进化树(图4)分析显示,7株湖南分离株分属4个进化方向,HuN-0601株与其他6株进化关系较远,与所分析的8株国内其他省份的毒株也没有与其相同进化关系的毒株,与美国USA04和丹麦Denmark07毒株有较近的进化关系,表明该分离株可能为国外传入,并且在国内没有成为主要流行基因型。HuN-03可能是其它5株遗传演变的母本,它与上海SH04株同属一个遗传分支,显示出其为我国早期PCV-2流行毒株的可能性。其他5株与所比较的大部分毒株都有较近的遗传关系,但也可分为2个较独立的进化方向,其中,HuN-05、HuN-0702、HuN-08在一个进化方向内,与美国USA08、澳大利亚 Aus08、韩国 Korea07、浙江 ZJ06、浙江ZJ07、广东GD07、江苏 JS04同属一个分支,由于JS04株早在2004年就发表,表明了这一遗传分支存在时间久,流行范围广,遗传稳定性高,提示该分支病毒为PCV2国际流行遗传稳定毒株;而HuN-07、HuN-0602与山东、湖北、北京的毒株同处一个遗传分支,表现出国内流行特性,分析其可能是一种国内地域适应性流行毒株。
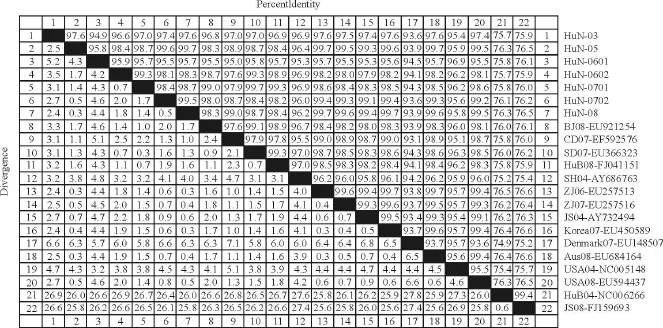
图3 湖南PCV-2分离株同源性分析Fig.3 The homology analysis of the PCV-2 Hunan isolates
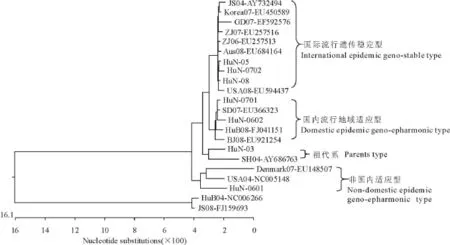
图4 湖南省PCV-2毒株的遗传进化树Fig.4 Phylogenetic analysis of PCV-2 complete genomes
3 讨论
PMWS从一出现就呈现世界范围内的广泛流行,给养猪业造成巨大的经济损失,引起了人们的普遍重视[8-9]。PCV-2作为引起PMWS的一种主要病原,也成为研究的焦点。目前研究表明,PCV-2为一种免疫抑制性病原,当其单独感染时,仅能导致轻微的PMWS,但是当与 PRRSV、PRV、PPV或细菌等共同感染时,则会复制出典型的PMWS症状[10-11]。
本试验从湖南省2003年-2008年疑似PMWS的病死猪组织中分离到7株PCV-2流行毒株,并对其进行了全基因组测序分析,结果显示,湖南省7株PCV-2流行株基因组均为1 767 bp,未出现1 768 bp的毒株,基因组序列内虽有多处点突变,但均未破坏11个潜在的ORF结构,都具有保守的茎环结构和9碱基基序,这两个结构已证实与PCV-基因组滚环复制的起始有关,PCV-2中9碱基基序的第一个碱基由PCV-1中的T突变为A,当该基序的前两个碱基被改变时,病毒子的复制能力也随之消失[12-13]。
7株湖南PCV-2病毒毒株间同源性在94.9%~99.3%之间,与GenBank中的13株 PCV-2基因组同源性在93.6%~99.7%之间,与PCV-1亲缘关系较远,同源性只有75.7%~76.5%,表明PCV-2有较稳定的基因序列,且与PCV-1核酸序列相差较大。
对7株湖南PCV-2流行毒株进行遗传进化关系分析,结果显示,我省PCV-2流行毒株至少存在4种遗传分支,一支可能是国外传入但未形成主体,一支是省内流行毒株的母本系,一支是国际流行核酸高度稳定谱系,一支是地域适应性体系,从毒株分离时间判断,现今湖南省流行的PCV-2毒株基本为后两支遗传谱系毒株。本次的分析方向与结果在国内尚属首次,与其他学者不一致的原因可能在于所选比较毒株不同所致。
[1]A llan G M,McNeily F,Kennedy S,et al.Isolation of porcine circovirus-like virus from pigs with a wasting disease in the USA and Europe[J].J Vet Diagn Invest,1998,10:3-10.
[2]A llan G M,Eills J A.Porcine circovirus:a review[J].J Vet Diagn Invest,2000,12(1):3-14.
[3]郎洪武,张广川,吴发权,等.断奶猪多系统衰弱综合征血清抗体检测[J].中国兽医科技,2000,30(3):3-5.
[4]周继勇,陈庆新,叶菊秀,等.猪圆环病毒2型感染的血清学分析[J].中国兽医学报,2004,24(1):1-3.
[5]王贵平,将智勇,宋长绪,等.猪 2型圆环病毒广东分离株的全基因组克隆及序列分析[J].中国预防兽医学报,2004,26(4):248-251.
[6]秦晓冰,金宁一,郑 敏,等.猪圆环病毒2型内蒙古株全基因组的克隆及序列分析[J].中国兽医学报,2004,24(4):352-354.
[7]Cheung A K,Bolin S R.Kinetics of porcine circovirus type 2 replication[J].A rch Virol,2002,147(1):43-58.
[8]Allan G M,McNeilly F,Meehan B M,et al.Isolation and characterisation of circoviruses from pig s with wasting syndromes in Spain,Denmark and Northern Ireland[J].Vet Microbiol,1999,66(2):115-123.
[9]Morozov I,Sirinarumitr T,Sorden S D,et al.Detection of a novel strain of porcine circovirus in pig s with postweaning multisy stemic wasting syndrome[J].J Clin Microbiol,1998,36(9):2535-2541.
[10]冯志新,姜 平,王先炜,等.PRRSV与 PCV2体外共感染对猪肺泡巨噬细胞免疫学功能的影响[J].中国预防兽医学报,2007,29(12):950-955.
[11]杨汉春.猪免疫抑制性疾病的流行特点与控制对策[J].中国畜牧兽医,2004,31(5):41-43.
[12]M ankertz A,Persson F,M ankertz J,et al.M apping and characterization of the origin of DNA replication of porcine circovirus[J].J Gen Virol,1997,71(3):2562-2566.
[13]M ankertz A,Hillenbrand B.Replication of po rcine circovirus type 1 requires two protein encoded by the viral rep gene[J].Virology,2001,279(2):429-438.
