能量平衡对围产期奶牛泌乳和干物质摄入量及机体代谢的影响*
2010-09-21朱玉哲张洪友郑家三
夏 成,朱玉哲,张洪友,徐 闯,郑家三
(黑龙江八一农垦大学动物科技学院,黑龙江大庆 163319)
随着我国奶牛数量的增长,集约化程度的提高,单产泌乳量的增加,奶牛产后能量负平衡的危害越来越大。奶牛产犊后,产奶量迅速增加,约4周~8周达到产奶高峰,而最大干物质采食量通常在产后10周~14周出现。采食量的增加滞后于产奶量的增加,能量的供给不能满足需求而导致能量负平衡。能量负平衡的出现导致奶牛血液生化指标和内分泌水平在短时间内发生剧烈变化,如果奶牛长期处于能量负平衡状态,导致体内糖代谢与脂肪代谢紊乱,酮体在体内蓄积,最终引起酮病[1]。
能量负平衡对奶牛机体代谢的负面影响以及机体代谢的调节机制成为一个研究的热点。能量负平衡伴随血液代谢和内分泌的变化,对能量代谢调节起主要作用的激素包括胰岛素、胰高血糖素、应激激素、瘦蛋白、生殖激素、胰岛素样生长因子、肠肽和神经肽Y等,其中瘦蛋白对摄食的调节作用尤为突出[2]。
国内外对奶牛能量负平衡及其内分泌调控机制已有较多的研究报道,但是有关能量负平衡的调控机制仍有不明之处。本试验旨在阐明不同能量平衡状况对围产期奶牛泌乳量、干物质摄入的影响及其代谢调节作用,为今后预防奶牛能量负平衡提供科学依据。
1 材料与方法
1.1 材料
1.1.1 试验用动物 黑龙江省某一个集约化奶牛场随机选取年龄(3岁~6岁)、胎次(2~5)相近的30头高产奶牛。
1.1.2 主要仪器 7230G分光光度计为上海第三分析仪器厂产品;低速台式离心机为上海安亭科学仪器厂产品;旋涡混匀器为上海第一医学院仪器厂产品;半自动生化分析仪为ECOM-F 6124;γ放射免疫计数器(GC-2010,美国)。
1.1.3 主要试剂 血糖(Glu,mmol/L)、游离脂肪酸(NEFA,μ mol/L)试剂盒购自长春汇力生物技术有限公司;β-羟丁酸(BHBA,mmol/L)试剂盒购自英国朗道 公 司。 胰 岛 素 (INS,μ IU/mL)、瘦 蛋 白(LP,ng/mL)、胰高血糖素(Gn,pg/mL)和皮质醇(Cor,ng/mL)试剂盒购自北京科美东雅生物技术有限公司。
1.2 方法
1.2.1 试验动物处理 30头试验奶牛在产前21、14、7 d、分娩当天(0 d)、产后 7、14、21 d 早晨空腹尾静脉采集肝素抗凝血10 mL~20 mL,3 000 r/min离心10 min分离血浆,分装3管~5管,置-80℃贮存待检。根据7个时间点血糖水平,分为低血糖组(L)和高血糖组(H)两组。同时记录泌乳量(MY,kg/d)和干物质摄入量(DMI,kg/d)。
1.2.2 试验奶牛的日粮组成 153 g/kg玉米、15 g/kg麦麸、12 g/kg脂肪粉、27 g/kg浓缩料、49.5 g/kg豆饼、4 g/kg石粉、5.2 g/kg小苏打、1.8 g/kg食盐、2.5 g/kg碳酸氢钙、280 g/kg苜蓿、350 g/kg青贮、100 g/kg羊草。营养水平为63.74%干物质、4.63%脂肪、40.09%NDF、每天早晨5:00,下午2:00,晚8:00统一投料饲喂,自由饮水,每头每天饲喂精料8 kg,粗料24 kg。
1.2.3 数据处理 应用SPSS11.5软件One-way ANOVA(单因素方差分析)进行数据分析,试验数据均以平均数±标准差(¯X±SD)表示,当差异显著时用Duncan检验法进行各组间的多重比较。横排上标小写字母(a、b、c、d)为不同者差异显著(P <0.05),上标大写字母(A 、B 、C 、D)为不同者差异极显著(P<0.01)。
2 结果
2.1 试验奶牛产后泌乳量与干物质摄入量
表1显示,试验奶牛产后 7、14、21 d的 MY呈升高趋势。产后21 d显著高于产后7 d和14 d(P<0.05)。产后DMI也呈升高趋势,7 d与14 d和21 d差异显著(P <0.05)。

表1 试验奶牛泌乳量与干物质摄入量Table 1 Milk yield and dry matter intake of tested cows
2.2 能量负平衡的发生率
表2显示,能量负平衡的发生率,产前低于产后,分娩时最低为0%,产后逐渐升高,产后21 d达最高。

表2 围产期奶牛能量负平衡的发生率Table 2 Incidence of negative energy balance in dairy cows in transition period
2.3 试验奶牛围产期血浆Glu、NEFA和BHBA的浓度
血浆Glu浓度,两组试验奶牛分娩前血糖浓略有升高,分娩当天达最高,产后均下降。L组围产期均小于H组,产后明显低于H组(P<0.01)。血浆NEFA浓度,两组试验奶牛围产期呈起伏变化,产后高于产前。L组除产前14 d和7 d,分娩时外围产期均明显高于H组(P<0.05)。血浆BHBA浓度,两组试验奶牛围产期呈上升趋势,产后高于产前,L组高于H组,产后差异明显(P<0.01或P<0.05),见表3。
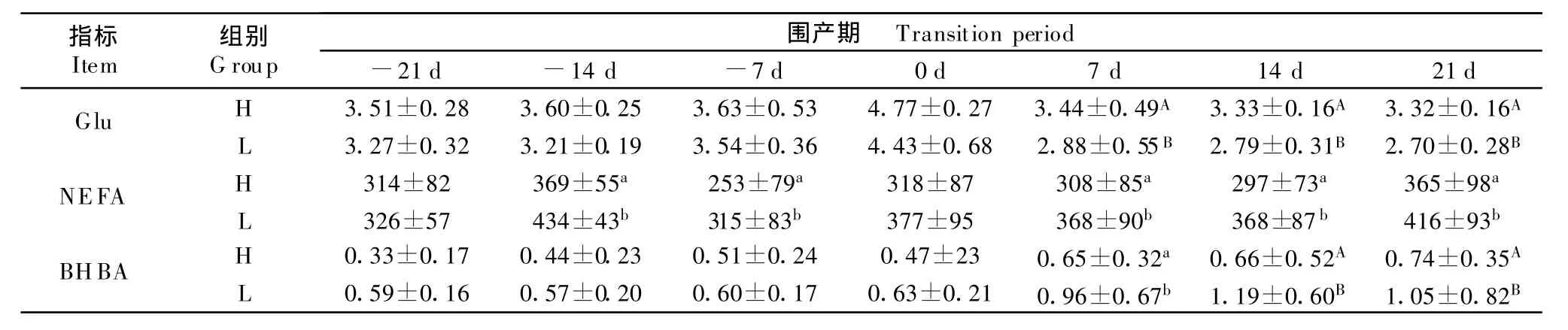
表3 试验奶牛围产期血浆Glu、NEFA和 BHBA的浓度T abel 3 Concentration of plasma Glu,NEFA and BHBA in dairy cow s in transition period
2.4 试验奶牛围产期血浆4种激素的浓度
试验奶牛围产期血浆Ins浓度产前21 d和14 d平稳变化,产后开始下降,产后明显低于产前,H组高于L组。随着分娩的临近和泌乳初期的出现,L组Gn浓度持续升高,而H组Gn浓度呈波浪式升高,两组产后Gn浓度水平均比产前高。各牛场L组奶牛Leptin在产前均下降,且在分娩当天降到最低点。H组的Leptin浓度水平高于L组。Cor浓度在分娩当天升高,产后浓度高于产前,L组Cor浓度在产后升高趋势明显高于H组(表4)。
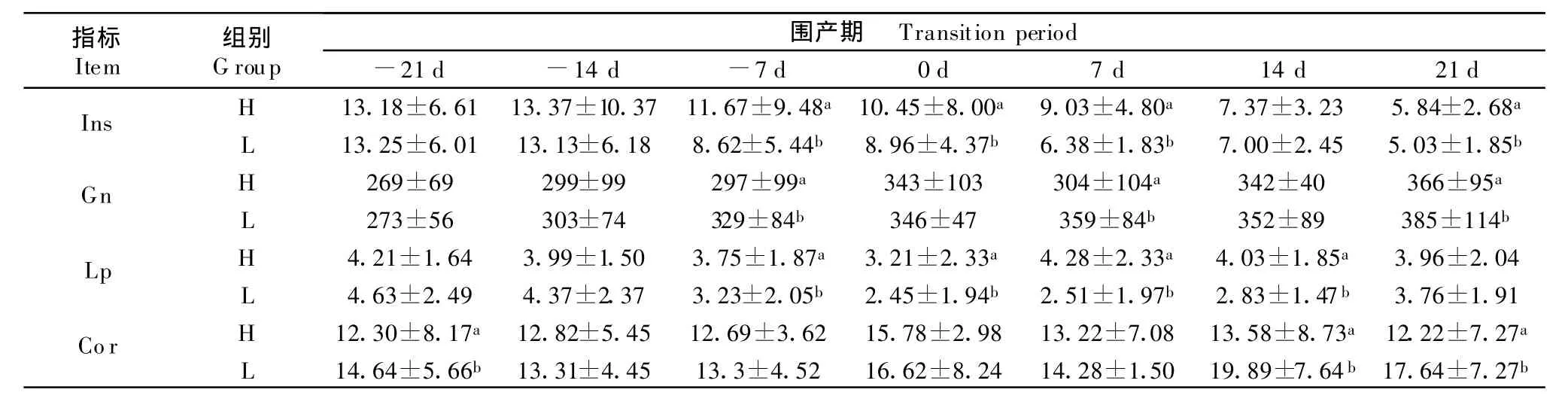
表4 试验奶牛围产期血浆Ins、Gn、Lp和Cor浓度Tabel 4 Concentration of plasma Ins,Gn,Lp and Cor in dairy cows in transition period
3 讨论
本试验中产前两组奶牛血糖均在正常水平,血浆NEFA和BHBA浓度处于正常水平,变化平稳,仅少量奶牛发生能量负平衡(小于17%)。这说明干奶期能量摄入能满足多数奶牛自身的需要。随着试验奶牛产后泌乳量增加,干物质摄入(DMI)也增加,但是产后能量负平衡发生率明显高于产前(高达53.33%),产后血糖浓度均降低,血浆 NEFA和BHBA浓度均升高,低糖组奶牛表现更明显。这表明一半奶牛产后DMI增加不能满足泌乳需求,尤其低糖组奶牛机体能量缺乏严重,血糖低于正常水平,酮体达到亚临床酮病水平。由于奶牛产后泌乳需要,对营养需要量增加,而奶牛此时食欲和采食量均没有恢复,不能从饲料中获得足够的能量以满足自身需要,导致能量负平衡,表现血糖急剧下降,为了满足泌乳前几周的能量需要,奶牛从脂肪组织中动员了大量的脂肪酸,结果导致循环中游离脂肪酸浓度急剧升高[3]。加上反刍动物肝脏脂肪酸氧化或以VLDL的形式输出甘油三酯的能力有限,肝脏摄入过多的脂肪酸超过了肝脏输出或氧化脂肪酸的能力,就会以甘油三酯的形式在肝脏中蓄积形成脂肪肝。脂肪酸的不完全氧化产物形成酮体,可能导致酮病发生[4]。由于在分娩前后DMI少或增加缓慢,奶牛发生NEB,血浆NEFA增加,血酮升高,易发酮病[5]。
另外,本试验中尽管奶牛产后发生能量负平衡,但是两组奶牛表现程度不同,这与机体适应性的代谢调节能力有关。本试验中低血糖组血浆Gn浓度高于高血糖组,高血糖组Ins浓度高于低血糖组。由于Gn促进奶牛肝脏糖原分解和丙酸盐、乳酸盐的糖异生,升高血糖;同时促进脂肪组织中脂肪的分解,有生酮作用[6]。Ins首要作用是控制血糖平衡,血糖浓度增加会刺激Ins分泌增加,通过促进肝糖原合成和外周组织脂肪合成,增加细胞对葡萄糖的吸收和利用,降低血糖[7]。Gn和Ins是调节血糖浓度的主要激素,主要作用于肝脏,二者相互协调、相互作用,通过调节糖异生关键酶活性来调控肝糖输出,维持血糖稳定[8]。因此,高血糖组奶牛表现血糖、血浆NEFA和BHBA水平维持正常,表明机体代谢调节能量强,可维持血糖正常,能量负平衡得以缓解。而低血糖组奶牛表现血糖、血浆BHBA达到亚临床酮病水平,表明机体适应性调节能力相对较弱,易发能量负平衡和酮病。
此外,机体Lp和Cor在奶牛围产期能量平衡调节中发挥一定的作用。近年来研究表明血浆Leptin与体脂、能量平衡或饲料水平呈正相关,且Leptin浓度的恢复似乎取决于能量负平衡的程度和时间[9]。泌乳期间正能量平衡的奶牛瘦蛋白浓度高于负能量平衡的奶牛及在泌乳期负能量平衡的奶牛血浆Leptin浓度较低[10]。研究报道泌乳期奶牛随产奶量增加,能量消耗增大,采食量增加,诱导低血Leptin症,利于泌乳期采食量增加[11]。本试验中奶牛高血糖组Leptin浓度较高,低血糖组 Leptin浓度较低,产后这种差别更加明显。这些结果表明奶牛血浆Leptin与能量平衡有密切联系,机体Leptin参与了能量平衡的调节。同样地,皮质醇主要对糖代谢进行调节,在血糖浓度不足时,高浓度皮质醇促进糖的异生和脂肪动员,具有明显的升糖作用。但应激时皮质醇也升高[12]。试验中血糖较低组Cor浓度高于血糖较高组。分娩当天Cor浓度上升,这可能与分娩应激有关。分娩时血糖浓度升高,与一些文献报道不一致,值得今后进一步探索。
[1]王 林,高 慧,王 峰.奶牛酮病研究进展[J].动物保健,2006(1):42-44
[2]汪启迪.瘦蛋白与其他相关激素间的互调作用[J].国外医学:内分泌学分册,1999,19(5):152-155.
[3]Goff J P,Horst R L.Phy siological changes at parturition and their relationship to metabolic disorders[J].J Dairy Sci,1997,80(7):1260-1268.
[4]G rummer R R.Etiology of lipid-related metabolic disorders in periparturient dairy cows[J].J Dairy Sci,1993,76:3882-3896.
[5]张克春,谭 勋.围产期奶牛葡萄糖、脂肪和钙代谢的研究动态[J].乳业科学与技术,2007(2):92-94.
[6]Overton T R,Waldron M R.Nutritional management of transition dairy cows:strategies to optimize metabolic health[J].J Dairy Sci,2004,87:105-119.
[7]Rukkwamsuk T,Wensing T.Effect of overfeeding during the dry period on regulation of adipose tissue metabolism in dairy cows during the periparturient period[J].J Dairy Sci,1998,81:2904-2911.
[8]Donkin L E.Regulation of gluconeogenesis by insulin and glucagons in the neonatal bovine[J].Am J Physiol Regul Integ r Comp Physiol,1994,266(4):1229-1237.
[9]Casanueva F,Dieguez C.Neuroendocrine regulation and actions of leptin[J].Front Neuroendocrinol,1999,20(4):317-363.
[10]CLiefers S.Leptin Concentrations in relation to energy balanee,milk yield,intake,live weig ht,and estrus in dairy cows[J].J Dairy Sci,2003,86:799-807.
[11]牛淑玲,李艳飞,王 哲,等.不同能量摄入水平对围产期奶牛生产性能及血浆瘦素浓度影响的研究[J].畜牧与兽医,2005,37(2):1-4.
[12]钟乐伦,姚军虎,徐 明.反刍动物葡萄糖营养研究进展[J].饲料博览,2006(5):13-15.
