评价饮水DBPs致HepG2细胞损伤的2种试验方法
2010-09-20张绍慧刘爱林鲁文清
张绍慧,陈 钊,廖 静,魏 巍,刘爱林,鲁文清
(华中科技大学同济医学院,劳动卫生与环境卫生学系,环境与健康教育部重点实验室,湖北 武汉 430030)
评价饮水DBPs致HepG2细胞损伤的2种试验方法
张绍慧,陈 钊,廖 静,魏 巍,刘爱林,鲁文清*
(华中科技大学同济医学院,劳动卫生与环境卫生学系,环境与健康教育部重点实验室,湖北 武汉 430030)
应用结晶紫染色法细胞毒性试验和胞质分裂阻滞法微核试验(CBMNT)评价饮水消毒副产物(DBPs)的HepG2细胞毒性和遗传毒性,探讨该2种试验方法纳入饮水安全性评价体系的可行性.根据遗传毒性和致癌性选用了5种DBPs,分别对HepG2细胞进行染毒,结果表明,5种DBPs的细胞毒性大小排序为3-氯-4-二氯甲基-5-羟基-2(5氢)-呋喃酮(MX)>二氯乙腈>二溴乙酸>二氯乙酸>三氯乙酸,其细胞毒性潜力(%C½值)分别为89.74,283.81,1217.02,5066.81,9335.38µmol/L,该5种DBPs在一定浓度下均可致HepG2细胞微核率显著增加,表现出明显的遗传毒性,其遗传损伤能力排序与细胞毒性大小相同.可考虑将这两种实验方法纳入到饮水安全性评价体系中.
消毒副产物;细胞毒性试验;微核试验
Abstract:Cytotoxicity and genotoxicity of drinking water disinfection by-products (DBPs) in HepG2 cells was to evaluate using crystal violet-colorimetric assay and the cytokinesis-block micronucleus test, and the feasibility of introducing these assays into evaluation system for drinking water safty was explored. HepG2 cells were treated with five DBPs which were chosen based on their genotoxicity and carcinogenicity. The descending rank order in cytotoxicity was 3- chloro -4 - (dichloromethyl) -5 hydroxy -2 (5 H) – furanone (MX) > dichloroacetonitrile (DCAN) > dibromoacetic acid (DBA) > dichloroacetic acid ( DCA ) > trichloroacetic acid (TCA), with a value of cytotoxic potency (% C ½ values) ranged from 89.74 (MX) to 9335.38 (TCA) µmol/L. Micronuclei occurring frequency significantly increased in HepG2 cells treated with five DBPs. The rank order of their genotoxicity among the five DBPs was the same as that of their cytotoxicity. The results indicated that these two assays are feasible for assessing the drinking water safety.
Key words:disinfection by-products;cytotoxicity assay;micronucleus assay
在饮水消毒处理过程中,消毒剂与水中的有机物,如腐殖酸、富里酸、藻类等易发生取代、加成和氧化反应,能生成卤代烃类等消毒副产物(DBPs).有报道的DBPs已达600多种[1],其中一些 DBPs已被证实具有遗传毒性,某些甚至有致癌性[2].因此对饮水可能导致的潜在遗传毒性进行检测对饮水安全性评价具有重要意义.现有关于饮水 DBPs暴露的遗传毒性评价方法中所采用的受试生物种类较少且遗传学观察终点单一,不能准确鉴别遗传毒物与非遗传毒物.建立一套多受试系统和多观察终点的遗传毒理学组合实验用于评价饮水安全性显得尤为迫切.本研究选取健康风险较高的5种DBPs[1],以人类来源的肝肿瘤细胞HepG2为靶细胞,应用结晶紫染色法和胞质分裂阻滞法微核试验评价 DBPs的细胞毒性和遗传毒性, 为将该2种试验方法纳入到饮水安全性评价体系的可行性提供依据.
1 材料与方法
1.1 材料
HepG2细胞由荷兰莱登大学Darroudi博士惠赠;5种DBPs(表1),苯并(a)芘[B(a)P],细胞松弛素B和二甲基亚砜(DMSO)均为Sigma公司产品; DMEM高糖培养基、新生牛血清和胰蛋白酶均为Gibco公司产品.

表1 5种DBPs在水中的浓度、遗传毒性和致癌性Table 1 Summary of occurrence, genotoxicity, and carcinogenicity of five DBPs
1.2 细胞毒性试验
处于对数生长期细胞经 0.25%胰蛋白酶消化后,接种于 96孔细胞培养板.预实验可知每孔接种4000个细胞、经72h培养后细胞可基本单层铺满孔底.三氯乙酸、二氯乙酸和二溴乙酸溶于D-hank’s液中;二氯乙腈和MX溶于DMSO中.溶剂的浓度不超过1%.各DBPs设8~10个染毒浓度组、1个阴性对照组(含有细胞+培养基+血清)和 1个空白对照组(仅含有培养基+血清),每组设5个平行孔.各孔总体积为200µL.接种后置于37℃、5%CO2培养箱中.培养72h后,细胞经PBS清洗2次,甲醇固定,1%结晶紫染液染色.去离子水冲洗后晾干,每孔加 10%的冰乙酸.于595nm的波长下检测吸光度值,结果以相对阴性对照组的生长率表示[3].
1.3 胞质分裂阻滞法微核试验(CBMNT)
细胞接种于6孔细胞培养板(2×105个/孔)中,补加培养基至2mL,于37℃,5%CO2培养箱中培养24h后染毒.所有受试物均设4个浓度,阳性对照为B(a)P(100μmol/L),阴性对照同细胞毒性试验.染毒之前用PBS冲洗细胞2次,加入新鲜培养基.各受试物的染毒时间均为24h.染毒结束后更换新鲜培养基,加入 4μL细胞松弛素B(3μg/mL),混匀后孵育24h,将细胞转入离心管,离心后加入5mL预冷的KCl.再经多次固定后制片.以10%Giemsa染色 10min,冲洗晾干后封片.镜下观察计数细胞,计算核分裂指数(NDI)和微核率(MN‰)[4].
1.4 统计分析
试验结果输入 EXCEL表格后,应用 SPSS 11.5统计分析软件.采用χ2检验对微核率进行统计分析;核分裂指数使用Dunnett’t检验.
2 结果
2.1 5种DBPs致HepG2的72h细胞毒性
由图1可见,在各DBPs的剂量反应曲线中,随着染毒浓度的增加,相对阴性对照组的生长率逐渐下降.
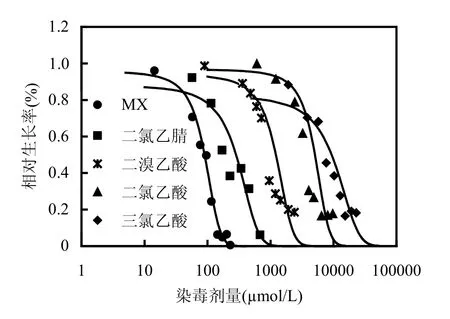
图1 DBPs致HepG2细胞72h细胞毒性Fig.1 The cytotoxic effect of DBPs on HepG2 cells after 72h treatment
2.2 5种 DBPs诱导的 HepG2细胞微核率和NDI
由表2可见,随着DBPs染毒浓度的增加,各染毒浓度水平出现的微核率均高于同组的阴性对照值,同时NDI值均出现下降趋势,即反映该染毒剂量致细胞毒性损伤在增强.且微核率与NDI值这两项指标与DBPs染毒浓度具有一定的剂量-反应关系.各DBPs诱导HepG2细胞微核率与阴性对照相比出现统计学意义的最低浓度值相差较大,具体的数值为:100μmol/L(MX),200μmol/L(DCN),500μmol/L (DBA),1000μmol/L (DCA),5000μmol/L (TCA).
表2 5种DBPs对HepG2细胞微核率和NDI的影响Table 2 NDI and MN in HepG2 cells induced by 5 DBPs
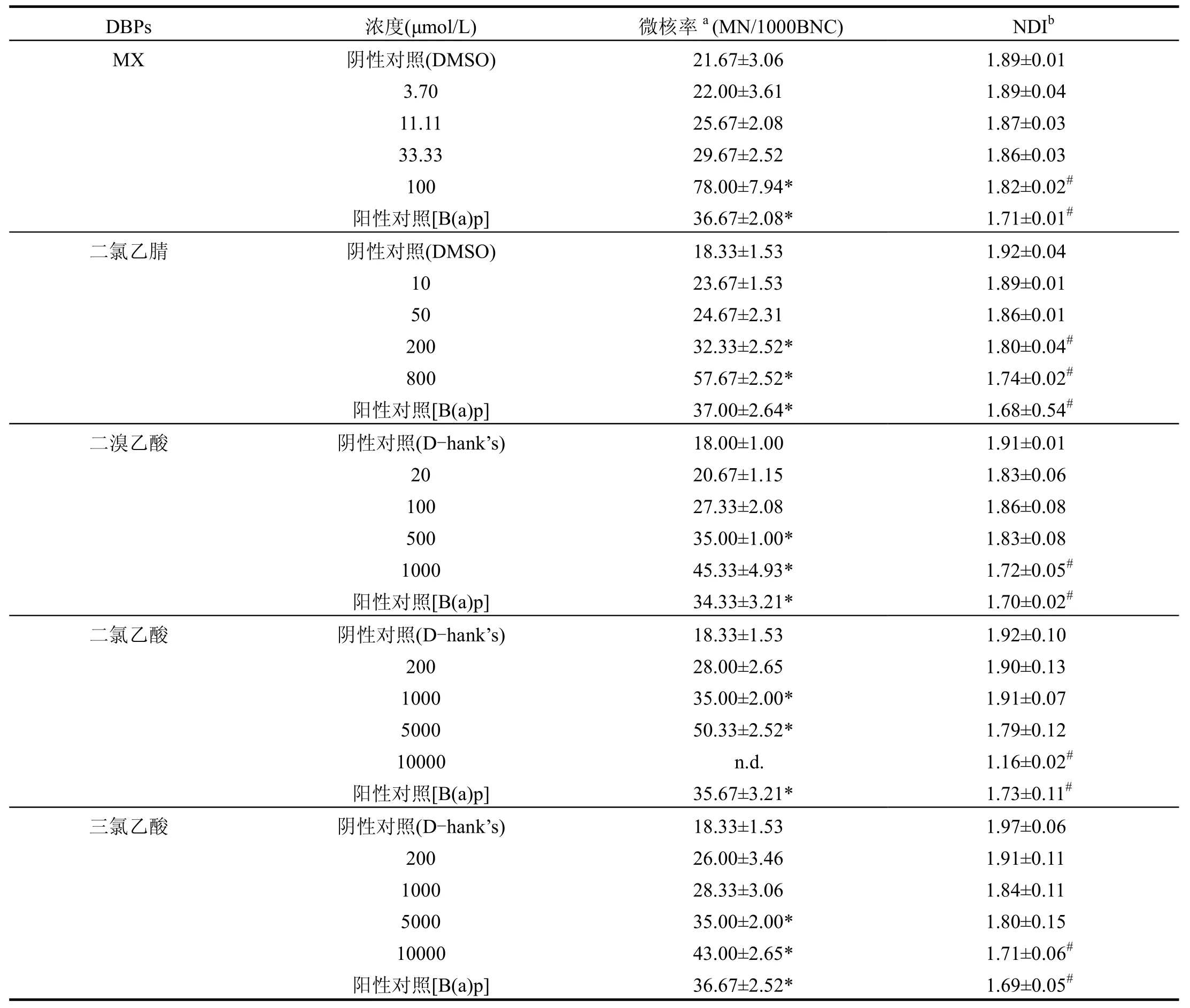
表2 5种DBPs对HepG2细胞微核率和NDI的影响Table 2 NDI and MN in HepG2 cells induced by 5 DBPs
注:a.微核率的统计方法为χ2检验;b.NDI的统计方法为Dunnett’t 检验;n.d.细胞毒性过大,细胞大量死亡而无法计数1000个双核细胞;*与阴性对照相比较,微核率变化具有统计学意义, P<0.05;#与阴性对照相比较,NDI变化具有统计学意义,P<0.05
?
3 讨论
HepG2细胞作为一种代谢完全的人类来源细胞,保留了一系列生物转化过程中的I相和II相酶,已经成为评价化合物遗传毒性的有力工具[5].结晶紫染色观察细胞相对活性具有操作简便且灵敏、准确等特点[6].微核试验可对人类、啮齿类动物的致癌、致突变物进行有效鉴别, Galloway等[7]对49种化学物应用小鼠骨髓细胞微核试验进行致癌性筛查,只有4种致癌物得不到阳性结果.Tinwell等[8]研究后发现,大部分人类致癌物和经典的致突变物都会引起小鼠骨髓细胞的微核率显著增加.由微核试验发展而来的CBMNT可有效去除因受试物或不良的细胞培养状态所致的细胞分裂动力学改变而引起的假阴性结果,因而与传统的微核测定法相比,具有更好的精确度[9].
在结晶紫染色试验的基础上,采用细胞毒性潜力对 DBPs的相对毒性大小进行定量比较.细胞毒性潜力不仅可反映受试物对细胞的致死性,还综合考虑了细胞生长及分裂周期受到的延迟和干扰作用[3],可用于在多类型靶细胞间进行多种受试物细胞毒性大小的定量比较.本研究结果表明,5种DBPs对HepG2细胞毒性大小与文献报道的该 5种 DBPs对靶细胞 CHO[3,10]和 S. typhimurium[11]的细胞毒性大小排序基本一致,进一步验证了本研究结果的可靠性.
在遗传毒性试验研究中,5种DBPs诱导的微核率随染毒浓度的增大均呈上升趋势,并最终达到使 HepG2细胞遗传毒性明显增强的效应. 其中DCA在1000μmol/L、TCA在5000μmol/L的浓度下即可获得致HepG2细胞的阳性遗传毒性结果.Plewa等[3]和Mark等[10]应用SCGE/CHO试验体系检测DBPs的遗传毒性时, DCA和TCA在 染 毒 剂 量 分 别 达 到 25000μmol/L 和5000μmol/L时也未发现其遗传毒性作用,本研究采用的CBMNT/ HepG2试验体系对检出DBPs的遗传毒性似乎更为灵敏.在以往其他一些遗传毒性试验中呈现阴性结果的 TCA[1]在本次试验中也获得阳性结果,表明以HepG2细胞为靶细胞的试验方法可能会提高 DBPs遗传毒性的检出效率.根据5种DBPs出现阳性结果时的最小染毒浓度,结合出现阳性结果时的微核率与各自阴性对照的微核率的比值的大小,对该 5种 DBPs致HepG2细胞的遗传毒性潜力进行排序,由大到小依次为: MX>DCN>DBA>DCA>TCA,同细胞毒性大小顺序相同.可见 DBPs的细胞毒性大小与其对靶细胞造成的遗传损伤能力成正相关.
4 结语
结晶紫染色法细胞毒性实验可对5种DBPs的细胞毒性大小作出很好的定量评价,而CBMNT也可对该5种DBPs造成的遗传损伤进行有效的检出.据此,可考虑将以 HepG2细胞为靶细胞的这 2种试验方法纳入对饮水安全性进行评价的遗传毒理学组合实验中,但还需应用到采集的水样中以获得进一步的验证.
[1] Susan D R, Michael J P, Elizabeth D W, et al. Occurrence, genotoxicity, and carcinogenicity of emerging disinfection by-products in drinking water: A review and roadmap for research [J]. Mutation Research, 2007,636:178-242.
[2] Komulainen H. Experimental cancer studies of chlorinated by-products [J]. Toxicology, 2004,198:239-248.
[3] Plewa M J, Kargalioglu Y, Vankerk D, et al. Mammalian cell cytotoxicity and genotoxicity analysis of drinking water disinfection by-products [J]. Environmental and Molecular Mutagenesis, 2002,40:134-142.
[4] Lu W Q, Chen X N, Yue F, et al. Studies on the in vivo and in vitro mutagenicity and the lipid peroxidation of chlorinated surface (drinking) water in rats and metabolically competent human cells [J]. Mutation Research, 2002,513:151-157.
[5] Laura Marabini, Silvia Frigerio, Enzo Chiesara, et al. Toxicity evaluation of surface water treated with different disinfectants in HepG2 cells [J]. Water Research, 2006,40:267-272.
[6] 杨 浩,鞠冬阳,程希平,等.3种方法检测体外神经细胞存活的技术探讨 [J]. 生命科学研究, 2005,9:327-330.
[7] Galloway S M. The micronucleus test and NTP rodent carcinogens: not so many false negatives [J]. Mutation Research, 1996,352:185-188.
[8] Tinwell H, Ashby J. Comparative activity of human carcinogens and NTP rodent carcinogens in the mouse bone marrow micronucleus assay: An integrative approach to genetic toxicity data assessment [J]. Environmental Health Perspectives, 1994, 102:758-762.
[9] Fenech M. The in vitro micronucleus technique [J]. Mutat. Res., 2000,455:81-95.
[10] Mark G M, Elizabeth D W, Kristin M, et al. Haloacetonitriles vs. regulated haloacetic acids: Are nitrogen-containing DBPs more toxic? [J]. Environ. Sci. Technol., 2007,41:645-651.
[11] Kargalioglu Y, McMillan B J, Minear R A, et al. An analysis of the cytotoxicity and mutagenicity of drinking water disinfection by-products in Salmonella typhimurium [J]. Teratog. Carcinog. Mutagen., 2002,22:113-128.
Application of two assays for damage assessment of damage caused by drinking water disinfection by-products in HepG2 cells.
ZHANG Shao-hui, CHEN Zhao, LIAO Jing, WEI Wei, LIU Ai-lin, LU Wen-qing*
(Key Laboratory of Environment and Health, Ministry of Education, Department of Occuptional and Environmental Health, School of Public Health, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China). China Environmental Science, 2010,30(2):275~278
X503,X824
A
1000-6923(2010)02-0275-04
2009-07-14
“十一五”国家科技支撑计划(2006BAI19B02)
* 责任作者, 教授, luwq@mails.tjmu.edu.cn
张绍慧(1976-),男,辽宁锦州人,华中科技大学同济医学院博士研究生,主要从事环境遗传毒理学研究.
