嗜盐菌群在甲苯降解过程中群落结构的变化解析
2010-09-20张丽花毛心慰
蒋 婧,王 慧*,张丽花,毛心慰,闫 海
(1.清华大学环境科学与工程系,环境模拟与污染控制国家重点联合实验室,北京 100084;2.北京科技大学应用科学学院,北京 100083)
嗜盐菌群在甲苯降解过程中群落结构的变化解析
蒋 婧1,王 慧1*,张丽花2,毛心慰1,闫 海2
(1.清华大学环境科学与工程系,环境模拟与污染控制国家重点联合实验室,北京 100084;2.北京科技大学应用科学学院,北京 100083)
从胜利油田的高盐油污土壤中富集到1个高效降解BTEX(苯、甲苯、乙苯、二甲苯)的嗜盐菌群,分析了菌群在甲苯降解过程中的群落结构变化.结果表明,该菌群在 5%盐度下可完全降解 200mg/L甲苯.PCR-DGGE图谱显示,随着甲苯的加入,该菌群的优势种属由Bacillus sp.和Bacillus aquimaris转变为Thalassospira xiamenensis、Pseudomonas stutzeri、Virgibacillus sp.和Bacillus sp..这4种微生物在整个降解过程中稳定存在,且在降解完成后24h内没有衰亡的迹象.另外,该菌群可以降解菲,显示了降解多种芳香族化合物的能力.
BTEX;嗜盐菌群;PCR-DGGE;微生物群落结构
Abstract:A halophilic bacterial consortium that could degrade BTEX (benzene, tolunene, ethybenzene, xylene) at the salinity of 5% was enriched from oil-contaminated saline soil. Bacterial community structure dynamics in toluene degradation by the consortium was analyzed. The consortium could degrade 200 mg/L toluene at the salinity of 5%. PCR-DGGE profiles revealed that with toluene addition, the predominant species shifted from Bacillus sp. and Bacillus aquimaris to Thalassospira xiamenensis, Pseudomonas stutzeri, Virgibacillus sp. as well as Bacillus sp., four of which remained stable during the degradation process and the following 24h when toluene was depleted. In addition, the consortium could degrade phenanthrene, illustrating its versatility in utilizing aromatic hydrocarbons.
Key words:BTEX;bacterial halophilic consortium;PCR-DGGE;microbial community structure
BTEX包括苯、甲苯、乙苯和二甲苯,属于单环芳烃类物质,对人体中枢神经系统有抑制作用[1],并对人体生殖发育产生毒性效应[2-5]. BTEX是石油中芳香族化合物的主要成分,而石油污染常常伴随着高盐环境[6-7].我国陆上油田土壤的含盐量普遍较高,如中原油田、辽河油田和胜利油田的土壤含盐度分别为 7,9,15g/kg[8].另一方面,在石油开采过程中产生的大量落地原油及含盐石油废水(盐度>3.5% W/V)的排放均导致油污土壤具有高盐特征,对普通微生物的正常代谢产生严重的影响,因而修复效果很不理想[6].
目前,高盐环境下微生物对污染物的降解已受到广泛关注.许多嗜盐细菌或菌群从受污染的环境中被分离或富集,它们在一定盐度范围内能降解烷烃、多环芳烃、BTEX、石油、柴油等污染物[7,9-12].由于菌群的结构与其降解功能密切相关,所以研究嗜盐菌群群落结构在生物降解中的变化对理解盐环境中生物修复的过程、提高生物修复效率具有重要意义[13-16].本研究利用 PCRDGGE技术解析了1个BTEX降解菌群[17]在甲苯降解过程中的群落结构变化,并测试了该菌群降解底物的多样性,以期为高盐环境中生物修复技术提供理论依据.
1 材料与方法
1.1 材料
1.1.1 培养基 SSDMY培养基组分见文献[18].
盐度为5%的LB培养基:胰蛋白胨10g/L,酵母提取物5g/L,氯化钠50g/L,用NaOH调节pH值至7.4,121℃灭菌20min.
1.1.2 试剂与主要仪器 苯、甲苯、乙苯、二甲苯(北京现代精细化工,>99.5%),菲(Alfa Aesar, >98%).
气相色谱仪(岛津,GC-14B),高效液相色谱仪(岛津,10Avp).
1.2 实验方法
1.2.1 降解实验 本研究中的菌群参见文献[17].菌群降解BTEX的实验:将甘油管冰上解冻,清洗菌体后接种至5%盐度的LB培养基.30℃、150r/min避光过夜培养,接种 1mL(OD600=0.8)至含 99mL SSDMY(0.01%酵母提取物)的 300mL锥形瓶(带龙口塞,气密性好)中,并向瓶中加入污染物[分别为苯、甲苯、苯和甲苯混合物(1:1)、BTEX(苯:甲苯:乙苯:二甲苯=1:1:1:1),终浓度均为200mg/L],30℃、150r/min、避光驯化3d,接种,培养并检测甲苯浓度.
菌群降解菲的实验:10mL SSDMY(添加0.02%的酵母提取物)液体培养基,加入100μL菲-二甲基甲酰胺溶液(100g/mL)使得培养基中菲的终浓度为 100mg/L,接种菌液 250μL,30℃、150r/min、避光振荡培养,于第6d和第11d进行检测.均设置灭活菌液作为空白对照.BTEX浓度测定采用顶空气相色谱法[19].采用岛津 GC-14B(Shimadzu)气相色谱分析仪,分离柱为ΜLBON HR-1(0.25mm× 30m)毛细管柱,检测器为FID氢火焰离子化检测器.分析条件为:毛细管柱温100℃,进样器温度150℃,检测器温度150℃.测定结果为3个平行的均值.菲的测定方法如下:在培养瓶中加入50mL甲醇,超声30min,充分萃取培养液及菌体表面的菲,0.45μm 滤膜过滤后,采用HPLC(岛津10Avp)测定萃取液中菲浓度,进样量为20μL[20].HPLC条件:色谱柱为C18反相柱(依利特,Hypersil BDS C18,250mm×4.6mm×5μm),流动相为甲醇:水(80:20),流速 1mL/min,检测波长254nm,柱温40℃.测定结果为3个平行的均值.
1.2.2 群落结构分析 细菌总 DNA的提取:分别在接种后的 24,36,48,60,72,96,120,144h收集1.5mL菌液.12000r/min离心,弃上清.采用细菌基因组小量提取试剂盒(博大泰克)提取总 DNA,取5μLDNA溶液1%琼脂糖凝胶电泳检测.
细菌 16S rRNA基因片段扩增以细菌总DNA为模板,进行 PCR扩增.采用目标片段为16S rRNA基因 V6区的引物968f(GC夹板)和1401r[21]. PCR反应体系和程序参见文献[17].
DGGE电泳分析 采用 Bio-Rad公司DcodeTM基因突变检测系统对PCR反应产物进行变性梯度凝胶电泳分离.采用 16cm×16cm 8%聚丙烯酰胺凝胶,变性剂范围为 40%~55% (7mol/L尿素和 40%去离子甲酰胺的混合物为100%变性剂).在1×TAE中,60℃,100V条件下电泳 12h,用 SYBR-Gold(1:000)避光染色 40min, ddH2O清洗后,转移至UVP凝胶成像系统上进行DGGE凝胶图像采集和分析.
16S rDNA测序及系统发育树的构建:目的条带切胶回收后送交北京三博远志生物技术公司测序.将测序结果提交 NCBI数据库并登记获得登录号.Blast搜索出相似性高的序列,利用Clustal软件进行多序列比对,通过Mega3.1构建系统发育树.
2 结果与讨论
2.1 菌群对BTEX的降解
该菌群对 BTEX的降解如表 1所示.在SSDMY(添加 0.02%酵母提取物)中,菌群对所列污染物(初始浓度为200mg/L)均能在80h内完全降解.

表1 菌群对BTEX的降解Table 1 Biodegradation of BTEX by the consortium
考察了在SSDMY培养基(添加0.01%酵母提取物)中菌群对甲苯的降解情况,降解曲线如图1所示.菌群在5d可完全降解200 mg/L甲苯.

图1 菌群降解甲苯的降解曲线Fig.1 Biodegradation of toluene in SSDMY by the consortium
2.2 菌群群落结构的解析及其在降解甲苯过程中的动态变化
为考察解析菌群在降解甲苯过程中群落结构的变化,分别在接种后的24,36,48,60,72,96,120, 144h收集菌体,并提取DNA进行群落结构分析.对DGGE图谱中较亮的16条优势条带进行回收测序,获得的序列提交GenBank注册并获得登陆号(FJ820238-FJ820253),利用 BLAST将所测得的序列与GenBank中已经登录的序列进行同源性比对,获得数据库中与该16条序列相似度高的序列,通过软件进行多序列比对并构建系统发育树,结果见图2和表2.
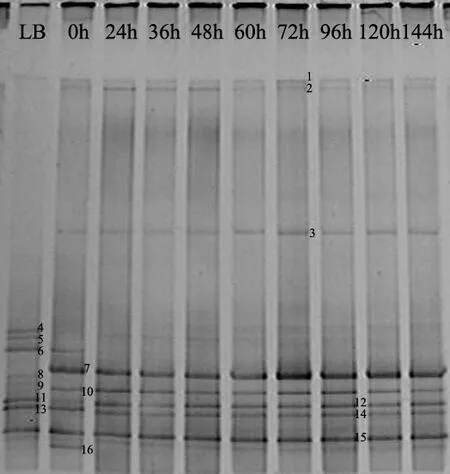
图2 5%盐度下菌群群落结构在甲苯降解过程的动态变化Fig.2 Dynamics analysis by DGGE of the consortium in SSDMY during toluene degradation
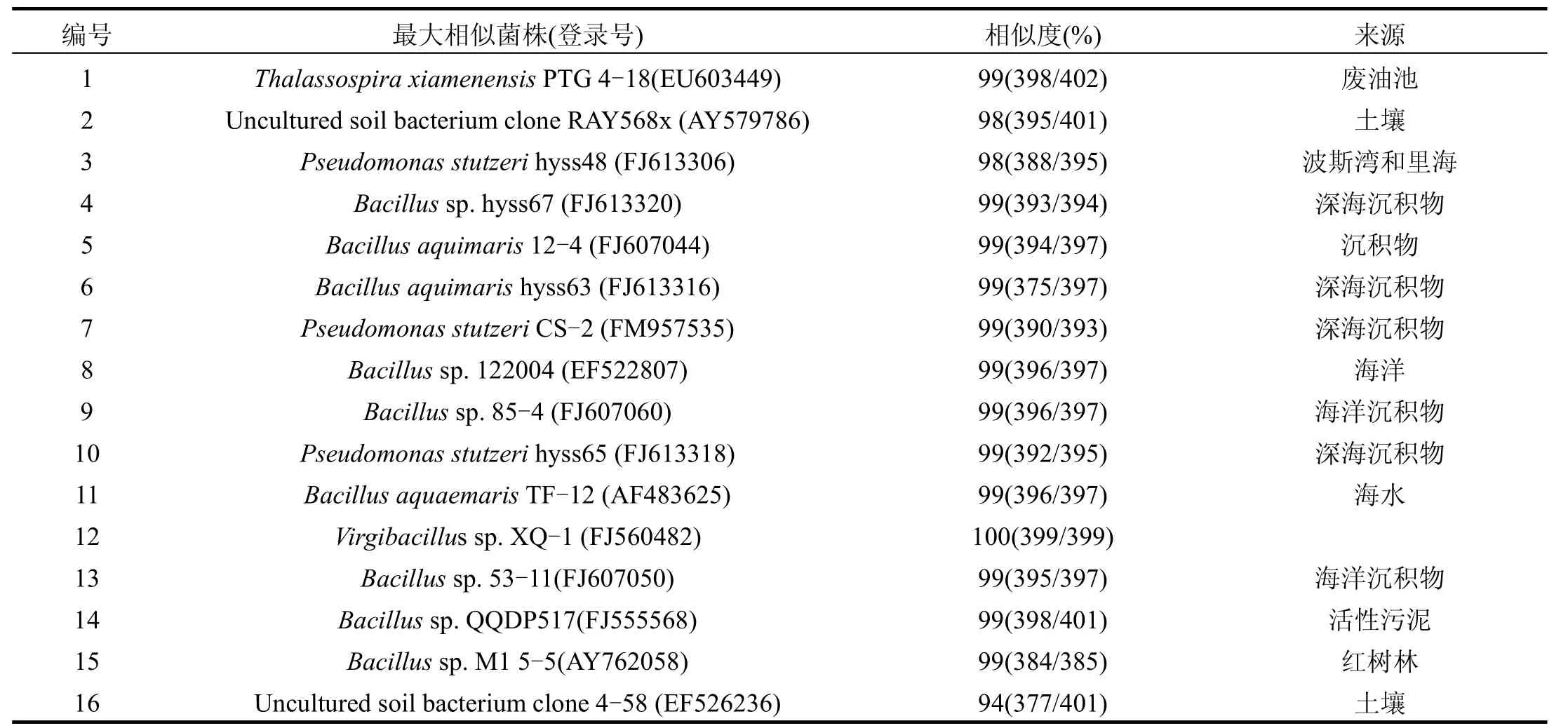
表2 菌群在5%盐度下降解甲苯的DGGE图谱对应条带的序列比对分析Table 2 Sequence analysis of bands retrieved from the 16S rDNA DGGE profile of the consortium in SSDMY during toluene degradation
根据序列比较的结果,除条带 16外,其他条带所含的DNA序列与GenBank中已知序列拥有较高的相似度(≥98%),其中条带12与已知序列相似度达 100%.菌群各条带所对应的微生物主要集中在Thalassospira、Pseudomonas、Bacillus、Virgibacillus等属,与条带2和16相似的细菌种类为不可培养菌株.各个菌株来源于不同的环境,大都具有重要的生态功能.与条带7和条带10相似度均达到99%的是Pseudomonas stutzeri.该种的许多菌株具有降解芳烃的能力,如菌株OX1分别以苯、甲苯、二甲苯和二甲苯酚为唯一碳源和能源生长[22];G11菌株在石油浓度为 1% (V/V)~ 2.5% (V/V)时降解率可达69%~59%[23];AN10和 P16分别可以降解萘和菲[24-25].与条带12相似度达到100%的Virgibacillus sp.XQ-1是Liu等[26]分离得到的可以降解溴氰菊酯的菌株;与条带14相似度达99%的是间苯二酚降解菌株Bacillus sp. QQDP517;与条带15相似度达到99%的Bacillus sp. M15-5是苯并[a]芘降解菌群的组分.这些在甲苯降解过程中出现的主要条带对应的菌株大都具有明确的降解污染物的功能.其中与条带 1相似度达99%的Thalassospira xiamenensis是Liu等[26]从废油池中分离出的石油烃降解菌.其他条带对应的最大相似菌株,虽然没有报道表明具有降解污染物的功能,但是大都来源于海洋和含盐土壤,属于嗜盐细菌.

表3 菌群中的优势种属随甲苯加入的变化Table 3 Dominant bacteria in the consortium before and after adding toluene
由图2和表3可见,经5%盐度LB培养基活化后的菌群群落(泳道 LB)在甲苯驯化 3d以后(泳道0h),条带4,5,8,9和11消失,条带6亮度变浅,并出现条带2,3,7,10和16.在加入甲苯前,菌群中的优势种主要为 Bacillus;加入甲苯驯化后菌群中开始出现 Thalassospira xiamenensis和Pseudomonas stutzer,这表明它们能够耐受高浓度的甲苯,与甲苯的降解有关;驯化时消失的Bacillus sp. hyss67、Bacillus aquimaris 12-4、Bacillus sp. 122004、Bacillus sp. 85-4和Bacillus aquaemaris TF-12,可能无法耐受甲苯.而在降解过程中,条带1,2,3,7,10,12,14和15始终稳定存在,表明 Thalassospira xiamenensis、Pseudomonas stutzeri、Virgibacillus、Bacillus在甲苯降解过程中起到重要作用.这一现象与上述种属已知功能是相符的.其中,优势条带7在降解过程中亮度不断增强并在72h时达到最大(此时甲苯降解率达75%),此后 3d亮度有所下降,但是仍高于前 72h水平.另一条优势条带 15,在降解过程中亮度没有明显的变化,表明该条带对应菌株在群落中的相对含量始终较为稳定.鉴于条带7,条带15的优势地位,与它们相似度最高的 Pseudomonas stutzeri和Bacillus sp. M1 5-5在降解中可能起到了最为关键的作用.这一现象与这 2株菌已知的功能相符:与条带 7相似度达到 99%的 Pseudomonas stutzeri 能降解多环芳烃,与条带15相似度达到99%的Bacillus sp. M1 5-5是苯并[a]芘降解菌群的组分.尽管接种后120h已检测不到甲苯存在,但主要条带并未观察到明显的亮度下降,表明菌群中的优势菌株在降解结束后并不会立刻进入衰亡期,其优势状态还会持续.
2.3 菌群对多环芳烃的降解
在培养基中添加 0.02%酵母提取物时,菲在第11d的降解率为47.96%(图4).这一现象与对菌群的系统发育分析结果是一致的:与条带1相似度达99%的Thalassospira xiamenensis是石油烃降解菌;与条带 7相似度达到 99%的 Pseudomonas stutzeri 是多环芳烃降解菌;与条带15相似度达到99%的Bacillus sp. M1 5-5是苯并[a]芘降解菌群的组分.这一结果显示了该菌群降解底物的多样性,在实际生物修复中具有良好的应用前景.
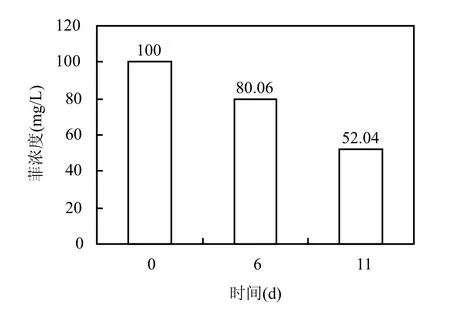
图3 菌群对菲的降解Fig.3 Biodegradation of phenanthrene by the corsortium
3 结论
3.1 菌群在5%盐度下可以完全降解苯、甲苯、苯和甲苯混合物(1:1)、BTEX(苯:甲苯:乙苯:二甲苯=1:1:1:1). 另外,该菌群可以降解菲,11d的降解率为47.96%.
3.2 在以甲苯为底物培养时,菌群群落结构发生显著变化,优势种属由Bacillus sp.和Bacillus aquimaris转变为 Thalassospira xiamenensis、Pseudomonas stutzeri、Virgibacillus sp.和Bacillus sp..
3.3 在 5%盐度下,Thalassospira xiamenensis、Pseudomonas stutzeri、Virgibacillus和 Bacillus在甲苯降解过程中的优势种属.在整个过程中,菌群群落结构稳定,并在降解完成后 24h内没有衰亡的迹象.
[1] 范亚维,周启星.BTEX的环境行为与生态毒理 [J]. 生态学杂志, 2008,27(4):632-638.
[2] 刘 钧,赵玉元,高明太,等.苯经呼吸道吸入对大鼠胚胎的致畸毒性 [J]. 中国临床康复, 2002,6(24):3678-3679.
[3] Pearson M A, Hoyme H E, Seaver L H, et al.Toluene embryopathy: Delineation of the phenotype and comparison with fetal alcohol syndrome [J]. Pediatrics, 1994,93:211-215.
[4] Faber W D, Roberts L S G, Stump D G. Two generation reproduction study of ethylbenzene by inhalation in Crl-CD rats[J]. Birth Defects Research, 2006,77:10-21.
[5] 王小芬,张树来,李厚勇,等.二甲苯对动物生殖系统毒性作用的实验研究 [J]. 职业卫生与病伤, 1995,10(4):224-228.
[6] Diaz M P, Boyd K G. Biodegradation of crude oil across a wide range of salinities by an extremely halotolerant bacterial consortium MPD~M,immobilized onto polypropylene fibers [J]. Biotechnol.Bioeng., 2002,79:145-153.
[7] Kleinsteuber S, Riis V, Fetzer I, et al. Population dynamics within a microbial consortium during growth on diesel fuel in saline environments [J]. Applied and Environmental Microbiology, 2006, 72:3531-3542.
[8] 杨玉楠,韩 东.嗜盐菌强化石油污染土壤生物修复的可行性研究 [J]. 农业环境科学学报, 2007,26:121-126.
[9] Bertrand J C, Almallah M, Acquaviva M. Biodegradation of hydrocarbons by an extremely halophilic archaebacterium [J]. Lett. Appl. Microbiol., 1990,11:260-263.
[10] Oren A, Gurevich P, Azachi M, et al. Microbial degradation of pollutants at high salt concentrations [J]. Biodegradation, 1992, 3:87-398.
[11] McMeekin T A, Nichols P D, Nichols S D, et al. Biology and biotechnological potential of halotolerant bacteria from Antarctic saline lakes [J]. Experientia, 1993,49:1042-1046.
[12] Nicholson C A, Fathepure B Z.Aerobic biodegradation of benzene and toluene under hypersaline conditions at the Great Salt Plains, Oklahoma [J]. FEMS Microbiology Letters, 2005,245: 257–262.
[13] Cui Z S, Lai Q L, Dong C M, et al. Biodiversity of polycyclic aromatic hydrocarbon-degrading bacteria [J]. Environmental Microbiology, 2008,10(8):2138-2149.
[14] 谭田丰,邵宗泽.海洋石油烃降解菌群构建及其在降解过程中的动态分析 [J]. 厦门大学学报(自然科学版), 2006,45:262-266.
[15] 王伟东,崔宗均,王小芬,等.快速木质纤维素分解菌复合系 MC1对秸秆的分解能力及稳定性 [J]. 环境科学, 2005,26(5):156-160.
[16] Itoa H, Hosokawa R, Morikawaa M. A turbine oil-degradingbacterial consortium from soils of oil fields and its characteristics [J]. International Biodeterioration and Biodegradation, 2008,61:223-232.
[17] 毛心慰,王 慧,赵百锁.降解 BTEX的嗜盐菌群的多样性及其降解特性研究 [J]. 环境科学学报, 2009,29(4):709-715.
[18] Zhao Baisuo, Wang Hui, Mao Xinwei, et al. Biodegradation of phenanthrene by a halophilic bacterial consortium under aerobic conditions [J]. Current Microbiology, 2009,58:205-210.
[19] 席劲瑛,胡洪营,朱洪博,等.两株甲苯高效降解菌降解性能的比较 [J]. 中国环境科学, 2005,25:102-105.
[20] 宁大亮,王 慧,王立华,等.难降解有机物对黄孢原毛平革菌P450的诱导作用及P450功能研究 [J]. 中国环境科学, 2009, 29(4):95-100.
[21] Nubel U, Engelen B, Felske A, et al. Sequence heterogeneities of genes encoding 16S rRNAs in Paenibacillus polymyxa detected by temperature gradient gel electrophoresis [J]. Journal of Bacteriology, 1996,178:5636-5643.
[22] Cafaro V, Notomista E, Capasso P, et al. Specificity of two multicomponent monooxygenases from Pseudomonas stutzeri OX1:molecular basis for catabolic adaptation of this microorganism to methylated aromatic compounds [J]. Applied and Environmental Microbiology, 2005, 71(8):4736-4743.
[23] Celik G Y, Aslim B, Beyatli Y. Enhanced crude oil biodegradation and rhamnolipid production by Pseudomonas stutzeri strain G11 in the presence of Tween-80 and Triton X-100 [J]. Journal of Environmental Biology, 2008,29(6):867-870.
[24] Bosch R, Moore E R B, Garcia-Valdes E, et al. NahW, a novel, inducible salicylate hydroxylase involved in mineralization of naphthalene by Pseudomonas stutzeri AN10 [J]. Journal of Bacteriology,1999,181 (8):2315-2322.
[25] Grimberg S J, Stringfellow W T, Aitken M D. Quantifying the biodegradation of phenanthrene by Pseudomonas stutzeri P16 in the presence of a nonionic surfactant [J]. Applied and Environmental Microbiology,1996,62(7):2387-2392.
[26] Liu C L, Wu Y H, Li L, et al. Thalassospira xiamenensis sp. nov. and Thalassospira profundimaris sp. nov. [J]. International Journal of Systematic and Evolutionary Microbiology, 2007,57: 316-320.
Analysis of bacterial community structure in toluene degradation by a halophilic consortium.
JIANG Jing1, WANG Hui1*, ZHANG Li-hua2, MAO Xin-wei1, YAN Hai2
(1.State Key Joint Laboratory on Environmental Simulation and Pollution Control, Department of Environmental Science and Engineering, Tsinghua University, Beijing 100084, China;2.College of Applied Science, University of Science and Technology Beijing, Beijing 100083, China). China Environmental Science, 2010,30(2):216~221
X172
A
1000-6923(2010)02-0216-06
2009-04-07
国家自然科学基金资助项目(30970098,2073001);国家重点实验室专项基金课题(09Y03ESPCT)
* 责任作者, 副教授, wanghui@mail.tsinghua.edu.cn
蒋 婧(1984-),女,湖北武汉人,清华大学环境科学与工程系硕士研究生,主要从事环境微生物研究.
