HPLC法测定人血浆中来曲唑浓度及人体相对生物利用度
2010-09-20赵玉婷徐世希王胜峰周彦彬冉黎灵丁劲松
赵玉婷 徐世希 王胜峰 周彦彬 田 娟 冉黎灵 左 英 丁劲松*
中南大学药学院(410013)
来曲唑是人工合成的第3代非甾体类高选择性芳香化酶抑制剂[1],通过与细胞色素P450芳香化酶中亚铁血红素的铁原子结合,竞争其活性位点并抑制该酶活性,从而减少雌激素的生物合成[2]。临床上主要用于雌激素依赖性疾病,如妇女绝经期乳腺癌[3]和不孕症[4]的治疗。目前,生物介质中来曲唑的测定方法有高效液相色谱法(highperformance liquid chromatography,HPLC)[5,6]、酶免疫分析法[7]和高效液相-串联质谱法[8]等。酶免疫分析法在分析过程中会生成很多交联反应代谢物影响其准确性和重现性;高效液相-串联质谱仪器普及难度大,不适于多数实验室采用;HPLC法具有准确度高、重现性好、成本较低等优点,是检测来曲唑浓度的常用方法。本实验成功建立了测定人体血浆样品中来曲唑浓度的HPLC-UV法,并通过比较分析来曲唑分散片和来曲唑片在健康受试者体内的药动学特征,评价其相对生物利用度及二者的生物等效性,从而为来曲唑分散片的临床合理用药提供重要依据。
1 材料与方法
1.1 仪器与试剂
岛津LC-2010C高效液相色谱仪;LC-Solution数据处理系统;TGL16M台式高速冷冻离心机(长沙英泰仪器有限公司) ;AB-265S型分析天平(日本梅特勒);WH-2微量旋涡混合仪(上海沪西分析仪器厂)。
来曲唑对照品(北京德众万全药物技术开发有限公司提供,批号:070322,含量:99.75%);咪唑斯汀对照品(三九医药股份有限公司提供,批号:20070307,含量:99.6%);磷酸二氢钾(广东汕头市西陇化工厂,批号:060612),乙腈(色谱纯,TEDIA);其他试剂均为国产分析纯(AR级);所有试验用水均为超纯水。
1.2 贮备液的配制
来曲唑贮备液:精密称取来曲唑对照品0.04977g(相当于来曲唑0.04965g)于50mL容量瓶中,用无水乙醇溶解并定容至刻度(0.9929mg/mL)。置于-4℃冰箱中保存,使用时稀释至所需浓度。
内标贮备液:精密称取咪唑斯汀对照品0.01002g于50mL容量瓶中,用甲醇溶解并定容至刻度(0.20mg/mL)。置于-4℃冰箱中保存,使用时稀释至所需浓度(1.0µg/mL)。
1.3 色谱条件
色谱柱:迪马 Diamonsil C18柱(4.6mm×200mm,5µm);柱温:30℃;流动相:乙腈∶磷酸二氢钾溶液=41∶59(v/v);流速:1.0mL/min;检测波长:239nm。
1.4 血浆样品处理
精密吸取血浆1.0mL,置10mL具塞尖底玻璃离心管中,加入内标溶液(1.0µg/mL咪唑斯汀溶液)100μL,涡漩混匀,加入4mL乙醚,涡旋3min,2000r/min离心5min,转移有机相至另一支干燥的10mL具塞尖底玻璃离心管中,40℃水浴氮气吹干,残渣用流动相100μL复溶,进样20μL。
1.5 给药与血样采集
本试验经中南大学药学院伦理委员会批准。18名健康男性受试者,年龄为19~24岁,体质量61~72kg,在签署知情同意书并体检合格后纳入试验。受试者随机分成两组,禁食12h后,于次日晨分别空腹口服来曲唑分散片或来曲唑片2.5mg,在给药前(0h)和给药后0.25、0.5、0.75、1.0、1.5、2、4、8、12、24、48、96、144h 从肘静脉取血5mL,3周后交叉服药,取血方法和时间点同前1周期。采集的血样标本置于肝素化试管中,立即离心分离血浆,-20℃保存至测定。
1.6 药物动力学参数的计算和统计学处理
参数Tmax和Cmax为实测值,AUC0-t用梯形面积法计算,消除速率常数K和t1/2用血药浓度-时间曲线尾端(消除相)数据直线回归计算。AUC0-t、Cmax经对数转换后进行药物间、周期间、个体间的3个因素方差分析,再以双向单侧t检验进行生物等效性评价,Tmax进行非参数检验。
2 结 果
2.1 色谱行为
在选定的色谱条件下,来曲唑与内标及血浆中内源性杂质分离良好,来曲唑和内标的保留时间分别为6.8和8.0min,峰形良好。空白血浆、来曲唑和内标对照品、空白血浆中加入来曲唑和内标对照品、受试者服药后血浆样品的色谱图见图1。

图1 空白血浆(A)、来曲唑(1,2000μg/L)和内标(2)对照品(B)、来曲唑(49.6μg/L)和内标加入空白血浆基质中(C)和受试者口服受试制剂1.5h后的血浆样本加入内标后色谱图(36.36μg/L)(D)
2.2 线性范围和定量下限
精密吸取空白血浆1.0mL,置10mL具塞尖底玻璃离心管中,分别加入来曲唑贮备液,配制成来曲唑浓度为2.48、3.10、6.20、12.40、24.80、49.60、99.20µg/L的标准血浆样品,涡旋1min,混匀,按“血浆样品处理”项操作,记录色谱图。以测得的来曲唑峰面积A与内标峰面积Ai比值对来曲唑血药浓度C(µg/L)进行线性回归,得回归方程为A/Ai=0.0570×C+0.0925 (r=0.9994)。血浆中来曲唑浓度在2.48~99.2µg/L范围内与峰面积比线性关系良好,其最低定量浓度为2.48µg/L。
2.3 萃取回收率
配制浓度为2.48、6.20、12.40、49.6µg/L的来曲唑无水乙醇液和1.0µg//mL的咪唑斯汀甲醇液,每个浓度各制备5份作为对照品溶液,取20µL进样记录色谱图,得到对照溶液中来曲唑和内标的峰面积。另用空白血浆配制成来曲唑浓度为2.48、6.20、12.40、49.60µg/L和内标浓度为1.0µg/mL的血浆样品各5份。按“1.4”项下处理,进样20µL记录血浆样品中来曲唑和内标的峰面积,以血浆样品的峰面积除以同浓度的对照品峰面积所得的百分率计算萃取回收率。结果来曲唑4个浓度的萃取回收率分别为(90.55±12.26)%、(88.38±1.62)%、(88.82±8.65)%、(67.56±10.46)%(n=5);内标萃取回收率为(81.42±6.38)%(n=5)。
2.4 方法回收率及精密度
配制来曲唑浓度为2.48、6.20、12.40、49.60µg/L的血浆样品各5份,按“1.4”项下处理后进样,记录来曲唑和内标峰面积,按回归方程计算测得浓度,分别在1天内测定5次,以测得值与加入值的比值计算方法回收率和日内精密度。上述3组样品连续测定3d,计算日间精密度。结果方法回收率在87.88%~104.02%(n=20),日内、日间RSD均<10%。
2.5 样品稳定性试验
配制来曲唑浓度为6.20、12.40、49.60µg/L的血浆样品,室温下放置8h、复溶后室温下放置12h、反复冻融2次或冻存20d,检验其稳定性。结果在这4种情形下,来曲唑血浆样品均处于稳定状态(RSD<8.6%)。
2.6 方法学质控
配制来曲唑浓度为6.20、12.40、49.60µg/L的血浆样品,即质控样品(QC样品),按“1.4”项下操作,20µL进样。低、中、高3个浓度的质控样品均匀分布在未知样品测试顺序中。本试验进行了9次共27个QC样品,结果QC样品的测定值均落在靶值的87.7%~113.04%。
2.7 血样测定和药物动力学参数
18例受试者口服来曲唑受试制剂或参比制剂后的0~144h平均血药浓度-时间曲线见图2,受试试剂和参比制剂的主要药代动力学参数见表1。
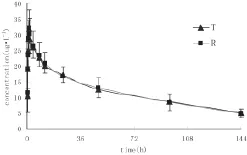
图2 18例男性健康志愿者单剂量口服受试制剂(T)或参比制剂(R)2.5 mg后平均血药浓度-时间曲线
2.8 统计检验结果
用梯形法(AUC0-t)估算受试制剂与参比制剂的相对生物利用度为(101.20±19.33)%。方差分析结果表明,二者主要药动学参数Cmax、AUC0-144和AUC0-∞在制剂间和周期间均没有显著性差异(P>0.05);Cmax、AUC0-144、AUC0-∞比值的90%置信区间分别为95.1%~103.3%、90.5%~108.4%、84.7%~112.1%;两制剂的Tmax经非参数法检验未发现有显著性差异(P>0.05),根据以上结果判定两制剂生物等效。
表1 18名健康受试者分别单剂量口服2.5mg来曲唑受试制剂或参比制剂后的药物动力学参数(n=18,±SD)
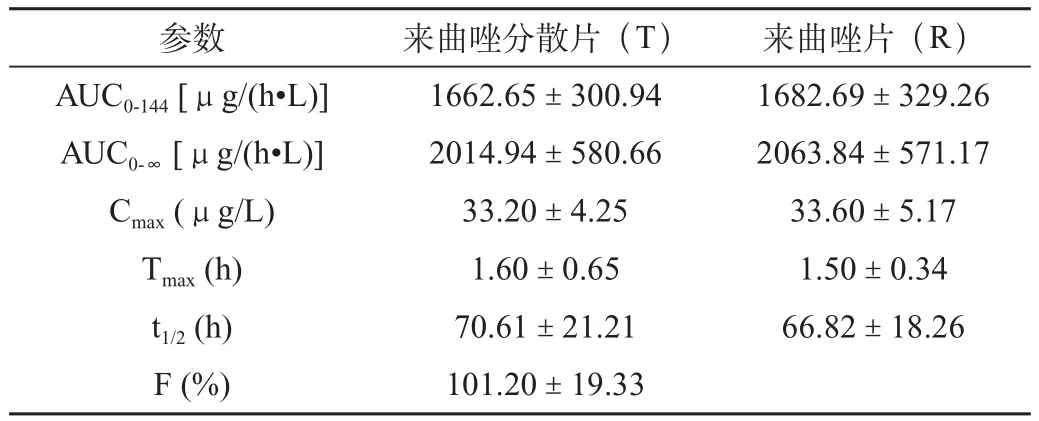
表1 18名健康受试者分别单剂量口服2.5mg来曲唑受试制剂或参比制剂后的药物动力学参数(n=18,±SD)
参数 来曲唑分散片(T) 来曲唑片(R)AUC0-144 [μg/(h·L)] 1662.65±300.94 1682.69±329.26 AUC0-∞ [μg/(h·L)] 2014.94±580.66 2063.84±571.17 Cmax (μg/L) 33.20±4.25 33.60±5.17 Tmax (h) 1.60±0.65 1.50±0.34 t1/2 (h) 70.61±21.21 66.82±18.26 F (%) 101.20±19.33
3 讨 论
本文建立的测定来曲唑浓度的HPLC-UV法具有成本低、速度快、操作简便、敏感度高及准确性好等优点。文献采用C18柱液-固相萃取方法[9],回收率提高,但成本增加,洗脱时间长(大约20min);本文以乙醚为萃取剂,操作简单、成本降低,萃取回收率高,保留时间仅为6.8min,耗时少。此方法的定量下限为2.48µg/L,方法回收率在87.88%~104.02%(n=20),日内、日间RSD均<10%,符合体内药物分析及药动学研究的要求。此外,本实验首次采用咪唑斯汀为内标,其色谱峰与来曲唑及内源性物质完全分离,保留时间为8min,稳定性好,符合内标选择的标准。
两种制剂的药动学参数统计分析结果表明,来曲唑分散片的相对生物利用度为(101.20±19.33)%。两制剂Cmax、AUC0-144和AUC0-∞没有显著性差异(P>0.05),其比值的90%置信区间均符合生物制剂等效标准,Tmax经非参数法检验亦未发现显著性差异(P>0.05),表明来曲唑分散片和来曲唑片具有生物等效性。
[1] Dombernowsky P,Smith I,Falkson G,et,al. Letrozole,a new oral aromatase inhibitor for advanced breast cancer: double-blind randomized trial showing a dose effect and improved efficacy and tolerability compared with megestrol acetate[J] .J Clin Oncol,1998,16(2):453-461.
[2] Haynes B.P,Dowsett M,Miller W.R,et al. The pharmacology of letrozole[J] .J Steroid Biochem,2003,87(1):35-45.
[3] Marsh S,Liu G. Pharmacokinetics and pharmacogenomics in breast cancer chemotherapy[J] .Adv Drug Delivery Rev,2009,61(5):381-387.
[4] Mitwally MF,Casper RF. Use of an aromatase inhibitor for induction of ovulation in patients with an inadequate response to clomiphene citrate[J] . Fertil Steril,2000,75 (2):305-309.
[5] Zarghi A,Foroutan SM,Shafaati A,et al.Quantifi cation of carvedilol in human plasma by liquid chromatography using fluorescence detection: Application in pharmacokinetic studies[J] .J Pharm and Biomed Analysis,2007,44 (1):250-253.
[6] Zarghi A,Foroutan SM,Shafaati A,et al. HPLC Determination of Letrozole in Plasma using Fluorescence Detection: Application to Pharmacokinetic Studies[J] . Chromatographia,2007,66(9/10):747-750.
[7] Pfister CU,Duva M,Godbillon J.Development,application and comparison of an enzyme immunoassay and a high-performance liquid chromatography method for the determination of the aromatase inhibitor CGS 20 267 in biological fl uids[J] . J Pharm Sci,1994,83(4):520-524.
[8] Kumar URA,Basavaiah K,Tharpa K,et al .Determination of raloxifene hydrochloride in human urine by LC-MS-MS[J] . Chem Ind& Chem Engi Quart,2009,15 (1):119-123.
[9] Marfi F,Pineau V,Siouf AI,et al. High-performance liquid chromatography of the aromatase inhibitor,letrozole,and its metabolite in biological fluids with automated liquid-solid extraction and fl uorescence detection[J] . J Chromatogr B,1996,683(2):251-258.
