人参皂苷 F组对急性脑缺血大鼠细胞凋亡及 VEGF表达的影响
2010-09-20冯志霞张培旭陈嘉峰桂明玉李绪文姜二晨金永日
冯志霞, 张培旭, 陈嘉峰, 李 岩, 桂明玉, 李绪文, 姜二晨, 金永日
人参皂苷是人参中的活性成分,目前已经从人参根中提取出 40余种[1]人参皂苷单体,按皂苷元母核的结构可分为齐墩果酸类、原人参二醇类、原人参三醇类。至今为止,关于二醇组人参皂苷如人参皂苷 Rb1、Rb2、Rb3、Rc、Rd、Rg3、Rh2以及三醇组人参皂苷如人参皂苷 Rg1、Rg2、Re等的研究较多。研究结果表明,人参皂苷具有很多药理作用,如抗肿瘤、免疫调节、改善学习记忆、降脂降糖、扩张血管、保护心肌细胞、清除自由基、抑制钙超载、抑制细胞凋亡、减轻兴奋性神经递质的毒性作用等[2~5]。F组人参皂苷是由人参皂苷 F1、F2、F3、F5、Fe等组成的混合物。研究表明,人参皂苷 F1对血管性痴呆、阿尔茨海默病、骨性关节炎、缺血性心脏病、白内障、再生障碍性贫血、帕金森病具有治疗作用。但至今为止关于 F组人参皂苷对缺血性脑血管病的作用及机制的研究鲜见报道。
本实验旨在对 F组人参皂苷在脑缺血中的作用进行动物实验研究,为 F组人参皂苷的临床应用提供实验学依据。
1 材料与方法
1.1 实验动物分组 选用健康雄性 Wistar大鼠 70只,2~3月龄,体重 250~300g,由吉林大学基础医学院动物室提供。随机分为 5组:A假手术组、B盐水对照组、C小剂量给药组、D中剂量给药组、E大剂量给药组,每组 14只。C、D、E组分别于术前30min及术后 30min、3h给予不同剂量的 F组人参皂苷腹腔内注射。小剂量组(10mg/kg)、中剂量组(15mg/kg)、大剂量组(20mg/kg),盐水对照组则在相同时间给予与 E组等体积的生理盐水腹腔注射。
1.2 动物模型制备 参照 Zea Longa线栓法[6]制作右侧大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型。大鼠用 10%水合氯醛(350mg/kg)腹腔注射麻醉,分离右侧颈总动脉、颈内及颈外动脉,结扎颈外动脉,近心端距离分叉1.5 cm处结扎颈总动脉。在颈总动脉距离分叉处0.5cm处剪一小口,插入直径为 0.26mm的尼龙线,进线长度约 1.8cm±0.05cm,阻断右侧大脑中动脉供血区的血流。假手术组进线长度为 1.2cm,其他操作与手术组相同。术后 2h动物完全清醒后参考 Longa法进行神经功能评分,将评分在 1~3分之间的动物纳入实验,Longa评分法:0分,无神经系统功能缺失症状,活动正常;1分,不能完全伸展左侧前爪;2分,爬行时出现向左转圈;3分,行走时身体向左侧倾倒;4分,不能自发行走、意识水平下降。如有死亡的大鼠,取同批次大鼠补足。
1.3 检测指标及方法
1.3.1 脑梗死体积的测定 每组取 6只大鼠于术后 24h断头取脑,将脑组织放入 -20℃冰箱中冷冻,自额极向后冠状面切成 2mm厚的切片,放入2%TTC溶液中,严格避光,37℃恒温孵育,30min后移置 4%多聚甲醛中固定,正常组织被染成红色,无染色区为梗死组织。数码相机拍照后,应用 Imagine-pro p lus 6.0图像分析软件测量脑梗死面积,再按照V=(A1+A2+…+An)t/2的公式计算出梗死体积。t为切片厚度,A为梗死面积。
1.3.2 脑组织 HE染色标本的制备及观察各组取 4只大鼠分别于术后 24h麻醉,打开胸腔,完全暴露心脏,由左心室插入 20号针头,剪开右心耳,依次用生理盐水及4%多聚甲醛各 200ml灌注固定,灌注后断头取脑,放入新鲜配制的 4%多聚甲醛中固定 24h。常规乙醇梯度脱水,二甲苯透明,石蜡包埋,包埋后组织块连续冠状切片,片厚约 7μm,HE染色后,光镜下观察并摄片。
1.3.3 TUNEL染色方法及观察 各组取 4只大鼠,灌注及固定方法同前,固定后的脑从前到后切成 2mm厚的脑片 5片,取中间一片进行石蜡包埋。包埋后组织块连续冠状切片,片厚约 7μm,取 2张切片按试剂盒说明进行 TUNEL染色。凋亡细胞计数时,每张切片在高倍镜下(40×)于缺血侧额顶皮质及海马区分别随机采集 5个视野,计数每个视野的凋亡细胞个数,计算其平均值。
1.3.4 VEGF免疫组化染色方法及观察 各组取 4只大鼠,灌注取脑及切片方法同前,用 SP法进行免疫组化染色,每张切片于缺血侧随机选择 5个视野计数阳性细胞数,取其平均值代表大鼠VEGF的阳性表达程度。
2 结 果
2.1 大鼠局灶性脑缺血后梗死灶的大小 存活大鼠于术后 24h断头取脑,发现梗死侧大脑半球水肿明显,体积明显大于对侧。TTC染色显示,与盐水对照组大鼠相比,给药组大鼠梗死体积均有显著减小,差异有统计学意义(P<0.05)。但大中小剂量给药组之间的梗死体积无明显差异(P>0.05)(见表1)。

表1 各组大鼠缺血 24h后梗死灶体积的比较
2.2 HE染色观察 盐水对照组皮层缺血区可见大片脑组织坏死,神经元脱失,局部区域可见有出血灶,血管腔隙增大,管腔内可见成簇的红细胞。神经元呈现不同程度的缺血性改变:肿胀的神经元胞浆淡染,呈圆形或者椭圆形;残存的神经元胞体小,胞核固缩呈三角形,核仁消失。由于出现了广泛水肿,在制成病理切片过程中水分脱失,导致视野内可见到大量的空泡样变,类似海绵状。药物治疗组大鼠脑缺血范围小,梗死边缘组织结构未完全破坏,缺血区残存神经元较多,空泡样改变程度较轻(见图1、图2)。
2.3 TUNEL染色 盐水对照组缺血侧大脑半球皮层、海马区、基底节区可见凋亡细胞,缺血中心区呈散在分布,缺血边缘区内侧成簇分布,阳性细胞核呈棕黄色,胞质均质浓缩,胞核深染,轮廓清晰,细胞体积小,边集于核周呈新月形或环形,并且可见少量大小不等深染成棕黄色的圆形小体,形似凋亡小体。给药组在缺血侧缺血中心区及缺血周围区亦可检测到凋亡细胞,呈散在分布,形态与盐水对照组相似,数量显著少于对照组(P<0.05)。3个剂量组之间也存在统计学意义,随着给药剂量的增加,凋亡细胞数目减少(P<0.01)(见表2、见图3~图7)。
2.4 VEGF免疫组化染色 VEGF在假手术组即有少量的阳性表达,主要分布于皮层、海马和皮质下结构。阳性着染细胞主要为神经元、神经胶质细胞,表达于核周胞浆和主树突,胞核为阴性表达。盐水对照组,VEGF阳性着染细胞数目增多。药物治疗组,在缺血后 24h阳性着染细胞数均高于对照组的表达数目(P<0.01),3个剂量组之间的差异也存在统计学意义,随剂量增加,阳性表达细胞数增加(P<0.01)(见表3、见图8、图9)。
表2 各组大鼠缺血 24h后凋亡细胞数的比较(±s)

表2 各组大鼠缺血 24h后凋亡细胞数的比较(±s)
注:HP表示 40×10倍视野
组别 样本数 剂量(mg/kg)凋亡细胞数(个/HP)假手术组盐水对照组小剂量组中剂量组大剂量组4 4 4 4 4 10 15 20 0 27.15±2.84 19.45±0.53 14.85±0.34 10.90±0.53
3 讨 论
细胞凋亡是细胞的程序性死亡,在脑缺血中神经元死亡包括坏死和凋亡两种方式,缺血核心区以坏死为主,而半暗带内的迟发性神经元死亡则以凋亡为主[7]。脑缺血后,能量代谢障碍,糖酵解增加,产生大量乳酸,使细胞内 H+浓度增加,激活 Na+/H+交换体,排出细胞内多余的 H+以维持 pH正常,导致细胞内 Na+超载,引起 Na+/Ca2+交换增强,后者导致钙超载。钙超载与细胞凋亡密切相关,被认为是导致细胞凋亡的最后通路。钙超载参与神经元凋亡的机制目前尚不清楚,可能与以下因素有关:(1)钙超载破坏了线粒体的结构和功能,使细胞能量代谢受阻,ATP生成减少;(2)钙超载发生于细胞核,激活 Ca2+-Mg2+依赖的内源性核酸内切酶,使DNA降解成 185~200bp核小体单位的 DNA片段,导致神经元凋亡;(3)钙超载促进自由基的生成从而导致神经元的凋亡;(4)钙超载激活蛋白激酶 C(PKC),PKC通过多种途径引起神经元凋亡,如激活磷脂酶促进自由基生成、磷酸化核转录因子(NF-κB),导致其活化,使血管收缩,加重缺血缺氧等。
兴奋性氨基酸(EAA)主要通过钙超载介导细胞损伤。 EAA激活 N-甲基-D-天冬氨酸 (NMDA)受体使钙通道病理性开放,引起钙超载;EAA也可激活代谢型红藻氨基酸/a-氨基-3羟基-5-甲基异恶唑-4-丙酸(KA/AMPA)受体促进 Na+内流和 K+、Cl-外流,细胞膜持续去极化,进而启动电压依赖性钙通道开放,进一步加重钙超载。国内外研究发现,F组人参皂苷能阻滞神经元的电压依赖性 Ca2+通道、减少钙通道介导的细胞凋亡、减轻兴奋性神经递质的毒性作用。本实验结果证明,与盐水对照组相比,药物组的细胞凋亡数目减少(P<0.05),梗死体积减小,且随剂量的增加凋亡细胞减少更加明显(P<0.05)。
VEGF能特异性地直接作用于血管内皮细胞,是促进新生血管形成的重要细胞因子,Jin[8]等研究发现缺氧是诱导 VEGF及其受体表达的主要因素,可提高 VEGF及 VEGFR的 mRNA表达、蛋白合成和生物活性,VEGF具有减少脑损害,促进新生血管形成、保护神经及促进缺血后神经元再生的功能。本实验证明,与盐水对照组比较,F组人参皂苷能促进VEGF表达上调(P<0.01),其表达随着给药剂量的增加而增多(P<0.01)。
本实验证明 F组人参皂苷能缩小局灶性脑缺血大鼠的脑梗死体积,减少细胞凋亡,促进 VEGF表达增加,F组人参皂苷对脑缺血损伤具有保护作用,为其用于缺血性脑血管病的治疗提供了实验学证据。

图1 盐水对照组脑缺血 24h梗死灶周围区病理改变(HE)40×
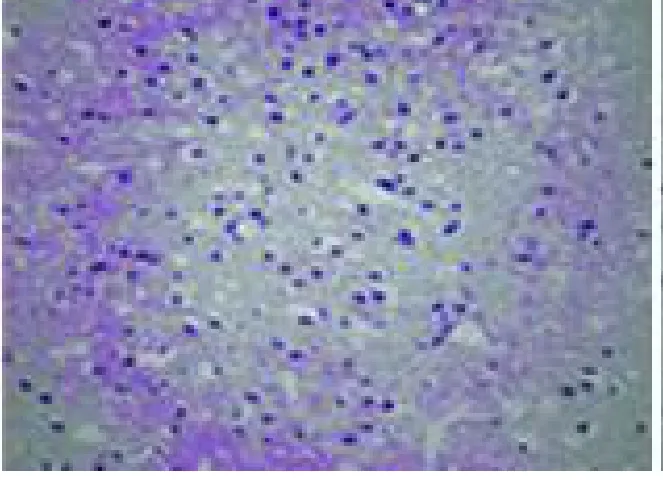
图2 大剂量给药组脑缺血 24h梗死灶 周围区病理改变(HE)40×
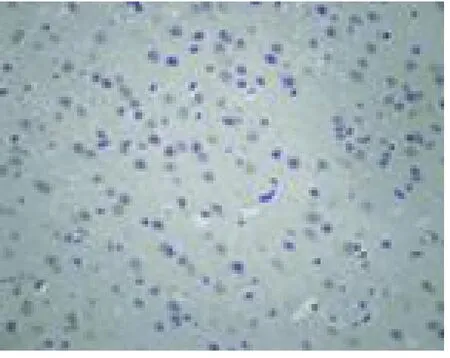
图3 假手术组在缺血 24h后 TUNEL检测凋亡细胞 40×
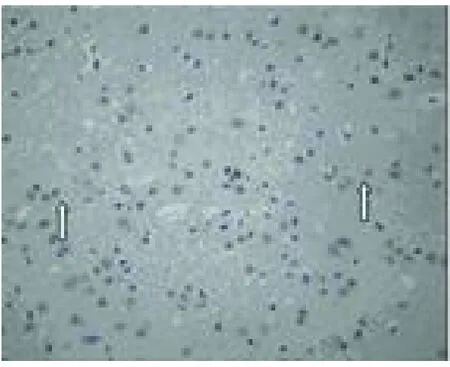
图4 对照组在缺血 24h后TUNEL检测凋亡细胞 40×

图5 小剂量给药组在缺血 24h后 TUNEL检测凋亡细胞 40×

图6 中剂量给药组在缺血 24h后 TUNEL检测凋亡细胞 40×

图7 大剂量给药组在缺血 24h后TUNEL检测凋亡细胞 40×
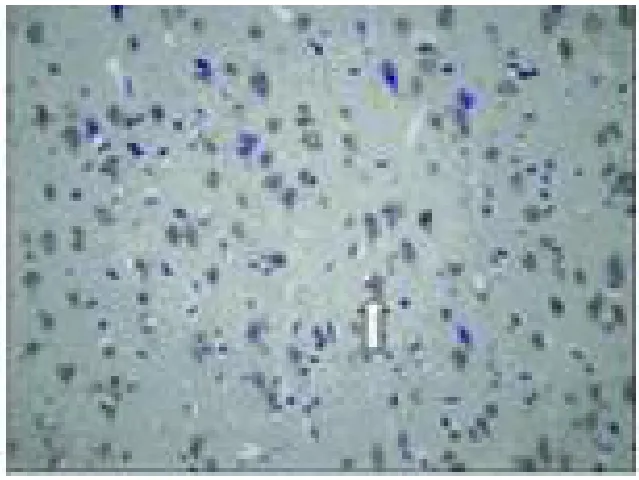
图8 盐水对照组在缺血 24h后 VEGF表达 40×
图9 大剂量给药组在缺血 24h后 VEGF表达 40×
[1]徐 丽.人参皂苷神经保护作用机制的研究进展[J].牡丹江医学院院报,2007,28(4):81-83.
[2]陈嘉峰,刘 岷,陈声武.急性脑缺血脑组织 Ach、ChAT的变化及人参皂苷的影响[J].中风与神经疾病杂志,1998,15(3):157-158.
[3]Hyunghee L,Frank JG,Michung Y.Ginsenoside Rf,a component of ginseng,regulates lipoprote in metabolism through peroxisome proliferator-activated receptor alpha[J].Biochem Biophys Res Commun,2006,339(1):196-203.
[4]Choi S,Jung SY,Lee JH,etal.Effects of ginsenosides,active components ofginseng,on nicotinic acetylcholine receptorsexpressed in Xenopusoocytes[J].Eur JPharmacol,2002,4421(2):37-54.
[5]Kim S,Nah SY,Rhim H,etal.Neuroprotective effectsof ginseng saponins against L-type Ca2+channel-mediated cell death in rat cortical neurons[J].Biochem Biophys Res Commun,2008,365(3):399-405.
[6]Longa EL,Weinstein PR,Carison S,etal.Reversiblem iddle cerebral artery occlusionwithout craniotomy in rats[J].Stroke,1989,20:84-87.
[7]Friedlander RM.Apoptosisand caspases in neurodegenerativediseases[J].N Engl JMed,2003,348:1365-1375.
[8]Jin KL,Mao XO,Nagayama T.Induction of vascular endothelial growth factor and hypoxia-inducible factor-1 alpha by global ischem ia in rat brain[J].Neurosci,2000,99(3):577-585.
