高抑菌活性的金银花内生真菌的 ITS序列分析法鉴定
2010-09-19伊艳杰李俊霞张慧茹
李 瑾,伊艳杰,时 玉,袁 元,李俊霞,张慧茹
(河南工业大学生物工程学院,河南郑州 450001)
高抑菌活性的金银花内生真菌的 ITS序列分析法鉴定
李 瑾,伊艳杰,时 玉,袁 元,李俊霞,张慧茹*
(河南工业大学生物工程学院,河南郑州 450001)
采用分子生物学方法,对金银花中分离的 2株具有高抑菌活性的内生真菌 JY2和 JY9的 r DNA中的 ITS序列进行了测序和分析.结果表明:JY2与镰刀菌属的同源性达到 99%以上,判定为镰刀菌属;JY9与现有相似序列的同源性都不高,只能推测其可能为子囊菌门,与原形态学鉴定的赤霉属有差别.
金银花;内生真菌;ITS序列
0 前言
药用植物内生菌是新型抗病药物的重要来源.金银花 (Flos Lonicerae)为常用传统中药,具有清热解毒、增强免疫、抑杀多种病原微生物、消除耐药质粒等功效.前期,笔者从金银花中分离到 2株具有高抑菌活性的内生真菌[1],对大肠杆菌和金黄色葡萄球菌具有较强的广谱抑菌活性,且其有效成分具有一定的耐热性和耐酸、碱性,适宜在生产中进行加工和制备,具有很好的应用前景.目前,国内外有关金银花抗菌内生真菌的研究报道尚未查阅到.作者采用 ITS序列分析方法,对分离的金银花内生真菌JY2和JY9进行分子生物学鉴定,旨在为下一步深入研究金银花内生真菌的药用价值提供理论依据.
1 材料与方法
1.1 材料
1.1.1 菌种
JY2、JY9菌株均为河南工业大学生物工程学院动物生理实验室分离得到.
1.1.2 试剂
基因组DNA提取试剂、Taq酶和 PCR相关试剂:北京百泰克生物技术有限公司;载体连接试剂盒:宝生生物工程(大连)有限公司.
1.1.3 PCR引物
采用真菌 ITS序列鉴定通用引物 ITS4、ITS5,其序列分别为:ITS4:5′-TCCTCCGCTTATTGATATGC-3′(20 bp);ITS5:5′-GGAAGTAAAAGTCGTAACAAGG-3′(22 bp),由上海生物工程技术服务有限公司合成.
1.2 方法
1.2.1 内生真菌的活化
将JY2和 JY9菌株在 PDA培养基上活化培养 4~5 d,从菌落边缘挑取适量的菌丝,转接于装有 100 mL PDB培养基的三角瓶中,28℃,160 r/min振荡培养 4 d,取出放入 4℃冰箱保存备用.
1.2.2 内生真菌总DNA的制备
取 10 mL菌液加入离心管中,4℃、8 000r/min离心 10 min,弃上清液,用乙醇清洗 1次.收集大约 3 g沉淀置于 -20℃预冷的研钵中,加少许裂解缓冲液进行研磨约5 min,转移到10 mL离心管中.加 65%预热的裂解缓冲液 2 mL和 2% SDS 2 mL充分摇匀后,65℃恒温作用 30~40 min,每隔 10 min轻轻颠倒摇匀离心管数次.然后6 000 r/min离心 5 min去除沉淀,取上清液,加1/5体积的 5×CTAB,65℃恒温作用 10 min,取出冷却后加等体积的氯仿异戊醇 (V∶V=24∶1),缓慢倒转离心管,使溶液成乳状并保持 2 min, 6 000 r/min离心 10 min,取上清液再转至另一离心管,加氯仿异戊醇抽提,直到界面清晰.将上清液转至另一离心管后,加 -20℃预冷 95%乙醇,于 -20℃放置 30 min~1 h,12 000 r/min离心,加适量 1×TE缓冲液,-4℃保存.
1.2.3 目的片段的 PCR扩增
以真菌 rDNA-ITS扩增的通用引物 ITS4和ITS5为上、下游引物,扩增内生真菌的 ITS序列. PCR反应体系为 (25μL):10×PCR缓冲液 2.5 μL,DNA模板 2μL,dNTP 2μL,buffer 2.5μL, 5μmol/L的上下游引物各 1μL,Taq酶 1 U,用超纯水补齐剩余体积.
PCR扩增条件:94℃预变性 5 min,94℃变性 30 s、55℃退火 1 min、72℃延伸 2 min,35个循环,72℃延伸 10 min,4℃保温.
PCR产物用 1%琼脂糖凝胶电泳进行检测,利用B IORAD凝胶成像系统照相.
1.2.4 ITS片段的连接与转化
将扩增的 ITS片段用连接试剂盒连接到PMD18-TVector载体上,参照连接试剂盒的操作说明进行连接.连接体系为 10μL:Solution9(LigationMix)5μL、P MD18-TVector 1μL、Insert DNA 2μL、ddH2O 2μL,轻轻混匀,置于 PCR仪中16℃连接 4~5 h.
按照文献[2]的方法,采用冷 CaCl2法制备大肠杆菌的感受态细胞,将连接的产物热激转入Escherichia coliJM109,37℃培养 24~48 h转化菌,以蓝白斑筛选转化的阳性菌.
1.2.5 菌落 PCR及 ITS测序
挑取白色阳性菌落划线培养,每个菌落划一条线.待菌苔长出后用牙签挑取少许菌,做菌落PCR.菌落 PCR反应条件稍有变化,预变性温度为 95℃,变性时间为 8 min.用凝胶电泳检测菌落PCR产物,对转入的目的片段的对应菌落做穿刺培养,将穿刺培养物送 Invitrogen(上海)公司测序.
1.2.6 DNA序列分析及系统发育树的构建
运用BLAST工具分析获得的内生真菌 ITS序列,在 GenBank中搜索相似序列,选取同源性较高的序列进行比对.将相关序列用 DNAMan (version4.0)作比对,构建系统发育树,确定内生真菌的分类地位.
2 结果与分析
2.1 PCR获得的 ITS产物
以JY2和 JY9的总DNA为模板,以 ITS4和ITS5为引物,进行 PCR扩增.PCR产物经琼脂凝胶电泳,结果见图 1.JY2的 ITS片段长度约为 570 bp,JY9的 ITS片段长度约为 560 bp.

图 1 菌株JY2和 JY9的 rDNA-ITS序列扩增结果
2.2 rDNA-ITS序列测序
经载体连接、转化到大肠杆菌、筛选阳性转化菌落后,对 JY2和 JY9这 2株金银花内生真菌的rDNA-ITS片段进行测序.JY2的 ITS序列长度为570 bp.在 GeneBank中未发现有金银花内生真菌序列,故将此序列登录在 GenBank中,登录号为GU380354.JY9的 ITS序列共计 558 bp,在 Gen-Bank中的登录号为 GU380355.
2.3 系统发育树的构建
将 2株内生真菌的 r DNA-ITS序列通过NCB I数据库进行BLAST分析,从中选取具有代表性的菌株,以 ITS序列同源性为基础,利用DNAMan软件构建系统发育树,并将两株内生真菌的测序结果用软件与 GenBank中获取的相似序列进行比对分析.JY2菌株的系统发育树见图 2.
由图 2可以看出,JY2菌株序列与镰刀菌属的多条序列相似程度较高,同源性在 99%以上,与形态学鉴定的结果一致.因此,将该菌株鉴定为镰刀菌属 (Fusarium sp.).
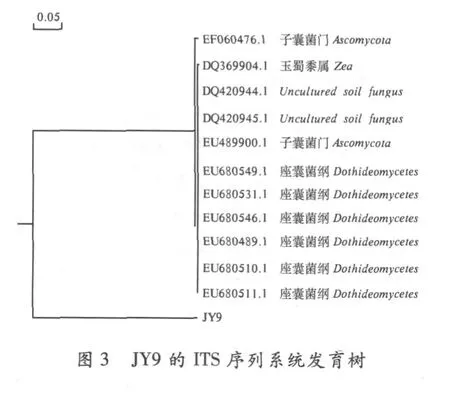
JY9菌株的系统发育树见图 3.
从图 3可以看出,JY9与所选相似序列均不在同一个分支上,同源性仅达到 14%,说明其 ITS变异较大,只能推测其可能为子囊菌门.笔者曾对其进行形态学鉴定,鉴定为肉座菌目肉座菌科的赤霉属.

3 讨论
目前对真菌的分类鉴定主要采用两种方法:形态学观察和分子生物学鉴定.传统的形态学观察在早期真菌鉴定中发挥巨大的作用,但是由于该方法在一定程度上受人为因素和环境条件的干扰,不能充分反映物种的进化关系,仅仅用形态学鉴定是有缺陷的.
近年来,随着分子生物学的发展,分子生物学技术在真菌学的鉴定中得到了广泛而深入的应用[3].真菌核糖体基因中位于 25S r DNA的 3′端与 18S rDNA的 5′端之间的 ITS序列和位于 25S rDNA的 5′端与 18S r DNA的 3′端之间的 ITS序列有不同的进化程度,表现为种内相对一致、种间差异比较明显,这一特点使得 ITS区段不仅适合于属内物种间或种内差异较明显的菌群间的系统发育关系分析,而且非常适合于真菌物种的分子鉴定[4],尤其对一些不产孢、无法利用形态学鉴定的菌株进行鉴定,ITS的应用优势尤为突出.易晓华等[5]对除虫菊 (Pyrethrum cinerariifolium)、王磊等[6]对白木香 (Aquilaria sinensis)、杨润压等[7]对南蛇藤 (Celastrus orbiculatus)以及郭尚彬等[8]对金钱松 (Pseudolarix kaem pferi)菌种的鉴定,都是基于 ITS序列分析进行鉴定的成功应用.
利用 PCR扩增内生真菌的 ITS序列,供试的rDNA-ITS序列通过与 GenBank数据库中有关序列进行BLAST比对,序列相似性≥99%,可以鉴别为相同种;序列相似性为 95%~99%,可以鉴别为相同属;序列相似性≤95%,可以鉴别为相同科.根据其基因序列,能够较为准确地将真菌鉴定到属及属以上、种、亚种,甚至菌株的水平.本研究采用分子生物学手段扩增真菌的核糖体 ITS片段,通过分析其 ITS序列,结合形态学特征,将菌株 JY2鉴定为镰刀菌属 (Fusarium sp.),将为下一步分析和利用菌株中的高效抑菌活性物质提供帮助.JY9的分子鉴定结果同形态学鉴定结果相差较大,与金银花内生菌的研究相对较少有关,也可能是一种新发现的菌株,还需要进一步进行研究确定.
镰刀菌(Fusarium)真菌是最常见的植物病原菌以及植物内生真菌,目前,在灯盏细辛(Erigeron breviscapus)[9]、苦楝 (M elia azeda rach)[10]、咖啡[11]等植物中均发现镰刀菌属的内生菌,金银花内生真菌 JY2菌株也鉴定为镰刀菌 (Fusarium),同国内外大多数学者的相关研究结果一致.因此,镰刀菌无论是作为植物病原菌还是具药用价值的内生菌,都具有重要的研究价值.
[1] 李瑾,张慧茹,刘诺阳,等.金银花内生真菌的分离鉴定及抑菌活性研究 [J].中国抗生素杂志,2010,35(3):236-240.
[2] 萨姆布鲁克 J,弗里奇 E F,曼尼阿蒂斯 T.分子克隆实验指南[M].金冬雁,黎梦枫,译.第 2版.北京:科学出版社,2006: 49-56.
[3] 匡治州,许杨.核糖体 r DNA ITS序列在真菌学研究中的应用 [J].生命的化学, 2004,24(2):120-122.
[4] 李海波,吴学谦,魏海龙,等.基于形态特征和 ITS序列对7个鹅膏菌属菌株的分类鉴定[J].菌物研究,2007,5(1):14-19.
[5] 易晓华,朱明旗,冯俊涛,等.1株具抑菌活性除虫菊内生真菌的菌种鉴定[J].西北农林科技大学学报:自然科学版,2008, 36(8):165-169.
[6] 王磊,章卫民,潘清灵,等.白木香内生真菌的分离及分子鉴定 [J].菌物研究, 2009,7(1):37-42.
[7] 杨润亚,姜琳琳,侯美灵,等.南蛇藤内生真菌 Y4的分子鉴定及其抑菌活性研究[J].鲁东大学学报:自然科学版,2008, 24(1):62-65.
[8] 郭尚彬,陈钧,王妍,等.金钱松内生真菌JJ18灭螺活性与菌株鉴定[J].中国媒介生物学及控制杂志,2008,19(5):442-445.
[9] 李治滢,杨丽源,周斌,等.灯盏细辛内生真菌的研究Ⅰ:菌种分离及其分类鉴定[J].云南大学学报:自然科学版,2003, 25(1):65-68.
[10]王雅琴,傅育红,高锦明,等.苦楝内生真菌抗菌活性的研究[J].西北林学院学报, 2007,22(1):20-22.
[11]Vega1 F E,Posada F,Peterson SW,et al. Penicillium species endophytic in coffee plants and ochratoxin A production[J].Mycologia,2006,98(1):31-42.
ITS SEQUENCE IDENTIFICATION OF ENDOPHYTIC FUNGIW ITH H IGH ANTIBACTER IAL ACTIV ITY FROMFLOS LON ICERAE
L IJin,YI Yan-jie,SH I Yu,YUAN Yuan,L IJun-xia,ZHANG Hui-ru
(School of B ioengineering,Henan University of Technology,Zhengzhou450001,China)
The article deter mined and analyzed the ITS sequence inr DNA of two strains of high-antibacterialactivityendophytic fungi(JY2 and JY9)isolated from FlosLonicerae bymolecular biologicalmethod.The results show that the homology between JY2 andFusariumis higher than 99%,so that the JY2 belongs toFusarium;and JY9 has low homology with other fungi the similar sequences so that we can infer that JY9 possibly belongs toAscom ycota.But according to morphology,JY9 belongs toGibberella,which is different from the above result.
Flos Lonicerae;endophytic fungi;ITS sequence
TS201.3
B
1673-2383(2010)03-0050-04
2010-02-09
河南工业大学基金项目 (09XZZ048);引进人才项目(150214)
李瑾(1985-),女,山东菏泽人,硕士研究生,主要从事中草药内生真菌抑菌活性的研究.
*通信作者
