7.0T MR下纯氧吸入后大鼠脑灰、白质弛豫值与脑血流变化
2010-09-19汤伟军刘士远陶晓峰
高 欣,汤伟军,王 霞,刘士远,陶晓峰
研究表明氧过多状态可使血液、肺、骨骼肌、脑脊液和脑等组织的T1弛豫值缩短[1-7]。因为氧过多状态下,血液中溶解的游离氧量增多,具有两个不成对电子的游离氧为顺磁性物质。同时,血液中氧合血红蛋白(O-Hb)的含量增多,顺磁性的去氧血红蛋白(deoxy-Hb)减少,使组织的T2弛豫值延长[6,8-11]。
新近的动物实验研究结果推测:氧过多状态下,T2值的延长是由于O-Hb比例的升高,而不是脑血流量或血容量增加[12],但同以往类似实验研究一样,上述实验也没有对氧过多状态下的实验动物的脑血流量进行测量,无法得到脑血流量变化的定量化数据。目前,采用动脉自旋标记(ASL)技术所获得的局部脑血流量与其他技术方法获得的脑血流量有很好的一致性和可重复性,但现在临床应用的磁共振扫描仪上ASL技术的空间分辨力非常有限,无法准确测量吸入纯氧前后大鼠的脑血流量的变化。本研究采用新的超高场7.0 T磁共振系统可以获得更高的空间分辨力及更精确的数据,目的是阐明吸入纯氧后,血中氧含量和脑血流变化对大鼠脑组织弛豫值的影响。为进一步研究运用氧过多刺激,观察脑血流变化奠定基础。
1 材料和方法
1.1 一般资料
大鼠脑组织弛豫值测量采用正常Sprague-Dawley雄性大鼠12只,体重200~250 g,SPF级,由中国人民解放军军事医学科学院实验动物中心提供。大鼠MRI脑血流量(CBF)测量采用正常Sprague-Dawley雄性大鼠8只,体重200~250 g,麻醉方式均采用腹腔内注射8%水合氯醛0.5 ml·mg-1·kg-1。
1.2 磁共振成像
Bruker PhamaScan磁共振成像系统,场强7.0 T,孔径16 cm,梯度场强300 mT/m。采用四通道相共振头线圈,俯卧位,双侧头部以耳钉固定防止头动,体部以胶带固定于线圈上。扫描过程中生命监视系统监测呼吸频率。气体麻醉导管通入100%O2,氧流量8 L/min,扫描过程中采用水浴床维持大鼠恒定体温于37±0.5℃范围内。
1.3 T1、T2、T2*弛豫值的测量
T1值测量为单层SE序列,定位为嗅球后5 mm,在6个不同的TR下得到(0.3,0.6,1,1.5,2和5 s),TE 11 ms,层厚1 mm,扫描时间16分38秒。T2值采用SE序列6个不同TE(20,40,60,80,100和120 ms),TR 3000 ms,层厚1 mm,层间隔1 mm,扫描时间9分36秒。T2*值采用6个不同TE的梯度回波序列(5,11,17,23,29和35 ms),TR 700 ms,翻转角20°,层厚1 mm,层间隔1 mm,扫描时间11分56秒。各序列均为NEX 4;FOV 3.5 cm×3.5 cm,Matrix 192×256。其他参数(频率、传送、接受调节)每次扫描时保持不变。每只受试大鼠在室内空气条件下分别进行T1、T2、T2*序列扫描。扫描结束后,进行吸入纯氧后的T1、T2、T2*序列扫描,每次扫描前均持续开放氧气6分钟,扫描过程中氧气保持开放。
1.4 CBF测量
采用四通道相共振头线圈,ASL/FAIR灌注成像序列扫描,定位嗅球后5 mm,层厚2 mm,TR 18000 ms,TE 13.5 ms,TI 分别为26、426、826和1226 ms,FOV 3.5 cm × 3.5 cm,Matrix 80×64。
1.5 数据处理分析
(1)弛豫值的计算:在GE AW4.3工作站T1、T2、T2*弛豫值测量软件上完成。感兴趣区(ROIs)分别放置于额叶的大脑皮层、皮层下纹状体和胼胝体(两名观察者),每一解剖结构处各选取3个感兴趣区,取平均值。数据分析采用SPSS 13.0软件包,配对Student t检验比较吸入纯氧前后的弛豫值变化。P<0.05者认为有显著统计学意义。采用单因素方差分析比较吸入纯氧前后大鼠灰、白质弛豫值的变化率。弛豫值变化率(%)=(吸纯氧后弛豫值—吸纯氧前弛豫值)/吸纯氧前弛豫值×100%),P<0.05认为有显著统计学意义。
(2)CBF的计算:数据处理采用Paravision灌注成像后处理软件。ROIs分别放置于CBF图上额叶的大脑皮层和皮层下纹状体(两名观察者),取3个感兴趣区的平均值,测量位置与弛豫值测量位置保持一致。CBF变化率=(吸纯氧后CBF-吸纯氧前CBF)/吸纯氧前CBF×100% 。
2 结果
2.1 T1弛豫值的变化
吸入纯氧后大鼠脑组织的T1值均有显著的缩短(图1)。大脑皮层的变化率为(-6.8±2.2)%;纹状体为(-4.6±1.2)%,胼胝体为(-3.0±1.5)%,吸入纯氧后T1值的缩短在鼠脑灰、白质之间存在显著差异(P<0.001)(表1)。T1值的变化率依次为大脑皮层>纹状体>胼胝体。
2.2 T2弛豫值的变化
吸入纯氧后大鼠脑组织T2值有明显延长(图2)。大脑皮层的变化率为(3.2±1.6)%;纹状体为(7.0±1.8)%,胼胝体为(12.4±7.5)%,吸入纯氧后T2值的延长在鼠脑灰、白质之间存在显著差异(P<0.001)(表2)。T2值的变化率依次为大脑皮层<纹状体<胼胝体。
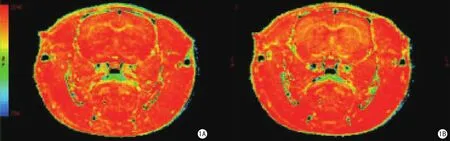
图1 T1 mapping后处理伪彩图(图1A、B的窗宽和窗位相同)。图1A显示吸入空气时脑组织T1弛豫值的伪彩图,图1B显示吸入100%氧气后脑组织T1弛豫值的伪彩图,前后比较显示脑组织T1值在吸入100%氧气后较吸入空气时缩短Fig 1 Post-processing color T1 maps (Fig 1A and 1B are in the same window width and window level).Fig 1A: T1 map of the rat brain during inhalation of room air.Fig 1B: T1 map of the rat brain during inhalation of 100% oxygen.Shortening of T1 value is identifi ed in the rat brain after being exposed to 100% oxygen.
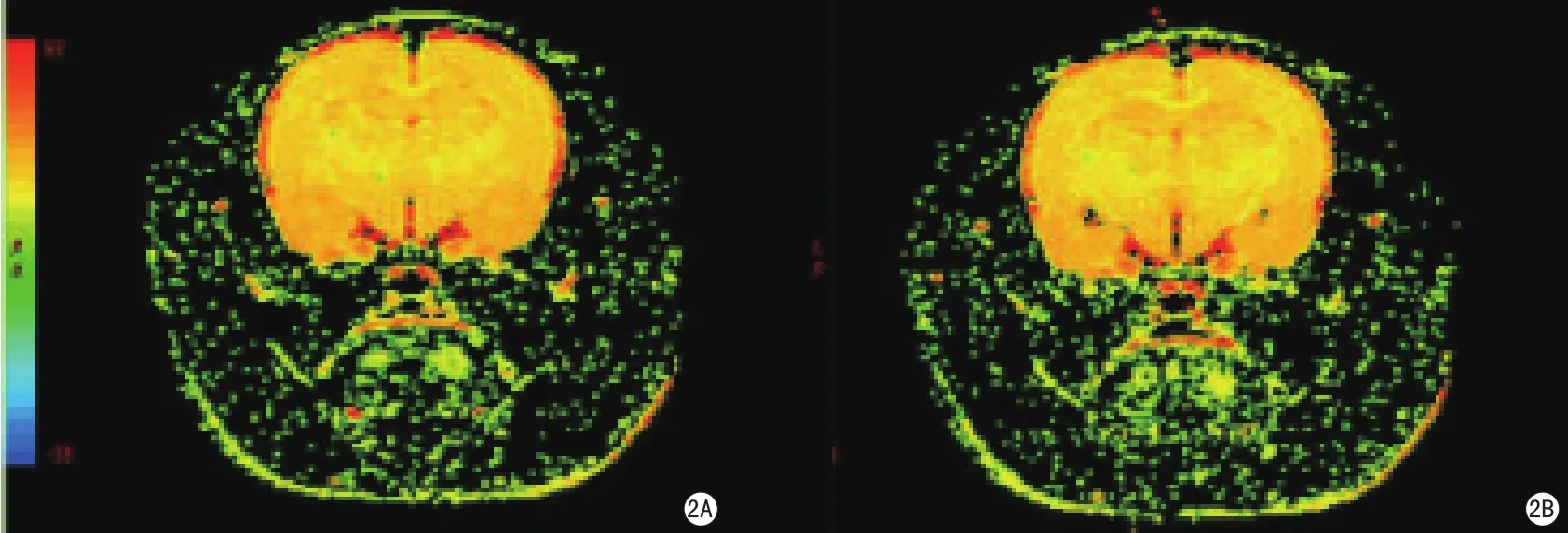
图2 T2 mapping后处理伪彩图(图2A、B的窗宽和窗位相同)。图2A显示吸入空气时脑组织T2弛豫值的伪彩图,图2B显示吸入100%氧气后脑组织T2弛豫值的伪彩图,前后比较显示脑组织T2值在吸入100%氧气后较吸入空气时延长Fig 2 Post-processing color T2 maps (Fig 2A and 2B are in the same window width and window level).Fig 2A: T2 map of the rat brain during inhalation of room air.Fig 2B: T2 map of the rat brain during inhalation of 100% oxygen.Prolongation of T2 value is demonstrated in the rat brain after inhaling 100% oxygen.
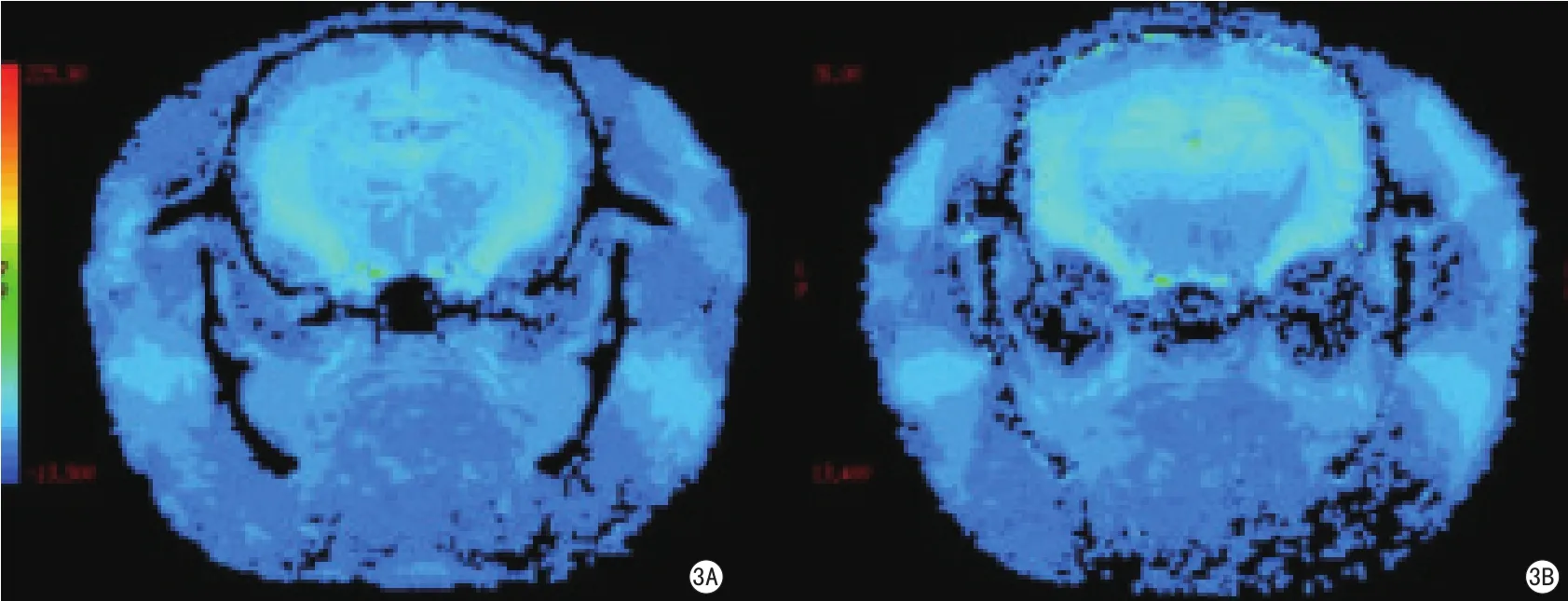
图3 T2* mapping后处理伪彩图(图3A、B的窗宽和窗位相同)。图3A显示吸入空气时脑组织T2*弛豫值的伪彩图,图3B显示吸入100%氧气后脑组织T2*弛豫值的伪彩图,前后比较显示脑组织T2*值在吸入100%氧气后较吸入空气时延长Fig 3 Post-processing color T2* maps (Fig 3A and 3B are in the same window width and window level).Fig 3A:T2* map of the rat brain during inhalation of room air.Fig 3B: T2* map of the rat brain during inhalation of 100%oxygen.Prolongation of T2* value is visually apparent in the rat brain after being exposed to 100% oxygen.
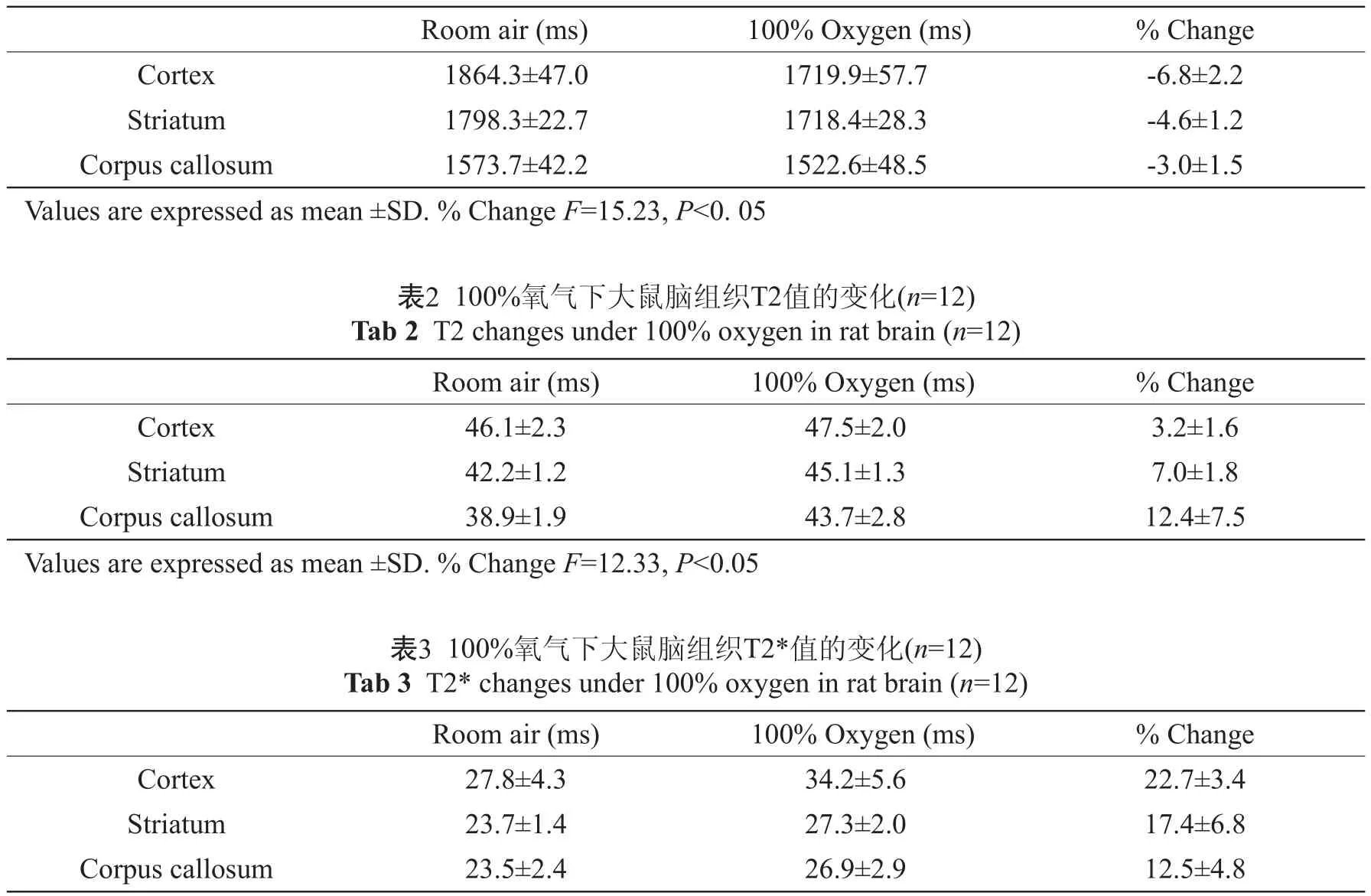
表1 100%氧气下大鼠脑组织T1值的变化(n=12)Tab 1 T1 changes under 100% oxygen in rat brain (n=12)

图4 吸入纯氧后大鼠脑灰、白质弛豫时间变化率的比较(%)吸入纯氧后T1值的缩短、T2值和T2*值的延长在灰、白质之间存在显著差异(P<0.001),T1值和T2*值的变化率依次为大脑皮层>纹状体>胼胝体;T2值的变化率依次为大脑皮层<纹状体<胼胝体Fig 4 Comparison of percentage changes of the relaxation time in rat brain after inhaling 100% oxygen (%).Percentage changes in all values between the cortex, striatum and corpus callosum were different (P<0.001) when exposed to 100% oxygen.Percentage changes of T1 and T2* value is respectively biggest in the cortex (cortex > striatum > corpus callosum), whereas that of T2 value is biggest in the corpus callosum (cortex < striatum < corpus callosum).

图5 吸入纯氧后大脑皮层及纹状体CBF变化率的比较(%为负值) 吸入纯氧后8只大鼠的大脑皮层和皮层下CBF均有不同程度下降,大脑皮层的CBF下降更为明显一些(注:变化率为均为负值,图中为方便比较取正值)Fig 5 Comparison of percentage changes of the CBF value between cortex and striatum (subcortex) in 8 rats after inhaling 100% oxygen (% is negative value).The decrease of CBF value was found both in the cortex and subcortex after inhaling 100% oxygen in 8 rats.The decrease of CBF value was more obvious in the cortex.(Percentage change is deliberately taken positive value for convenience)
2.3 T2*弛豫值的变化
大鼠脑组织T2*值,在吸入纯氧后有显著延长(图3)。大脑皮层的变化率为(22.7±3.4)%;纹状体为(17.4±6.8)%;胼胝体为(12.5±4.8)%。吸纯氧后T2*值的延长在鼠脑灰、白质之间存在显著差异(P<0.001)(表3)。T2*值的变化率依次为大脑皮层>纹状体>胼胝体(图4),变化幅度明显大于T2值。
2.4 CBF的变化
CBF测量结果显示与室内空气相比,吸入纯氧后大脑皮层和皮层下平均脑血流量均有不同程度下降,脑血流变化率在大脑皮层更为明显一些(图5)。
3 讨论
3.1 7.0 T MRI在大鼠脑组织弛豫值测量中的优势
文献报道,超高场(4.7~9.4 T)MR已成功运用于正常和脑缺血动物模型脑弛豫值的测量[10-12]。本实验使用7.0 T小动物专用MR扫描仪,具有7.0 Tesla的超高强磁场和300 mT/m的梯度场强,可以获得更高的空间分辨力及更精确的数据。理论上7.0 T MR扫描仪的信噪比约为1.5 T的4~5倍,可大大提高受检组织的信号强度,同时7.0 T MR小孔径及主磁场的均匀度、稳定性均保证了测量值的准确度。成像参数上采用FOV 3.5 cm×3.5 cm,矩阵192×256,空间分辨力可达到0.2 mm左右,明显优于1.5 T和3.0 T MRI。 本实验中针对性地对成像参数进行了优化,克服了3.0 T 以下MRI对实验动物脑组织T1值测量准确性相对较低的不足。
目前采用ASL/FAIR技术所获得的局部脑血流量与其他技术方法获得的脑血流量有很好的一致性和可重复性。7~9 T MR扫描仪的应用优势在于提高了敏感性并延长了血液的T1值,可在信号变化量增加的同时使自旋标记更好的蓄积[13]。
3.2 7.0T MRI下吸入纯氧后大鼠脑灰、白质弛豫值变化率的差异
吸入纯氧后大鼠脑灰、白质的T1值均有显著的缩短,与文献报道一致[3]。吸入纯氧气后,血液中溶解的游离氧随着氧分压的上升含量可由0.3 ml/100 ml升高至1.8 ml/100 ml,约为空气条件下的6倍[14],游离氧含量升高产生的顺磁性效应,导致T1值的缩短[3]。结果显示大脑皮层的T1值变化率大于纹状体,胼胝体最小。由于T1值取决于游离氧含量的多少,本实验中缩短T1值的效应在大脑皮层和皮层下较胼胝体更为明显,推测其原因主要由于脑白质内的血流灌注仅为大脑皮层的1/4,脑白质血管内溶解的游离氧浓度变化不如皮层和皮层下明显所致。
吸入纯氧后大鼠脑灰、白质的T2、T2*弛豫值均有明显延长。由于毛细血管和静脉系统内溶解氧浓度的升高,可造成顺磁性的deoxy-Hb比例减少,导致T2和T2*值的增高。此时T2*值的延长可能反映了组织从血液中摄取的氧含量的增多[15]。结果显示T2值的变化率在胼胝体和纹状体比大脑皮层中增长的更为显著,胼胝体变化率最大。因为脑白质以静脉和毛细血管分布为主,吸入纯氧后静脉血内的O-Hb的水平更高,O-Hb和deoxy-Hb的比例明显升高。同时,由于吸入纯氧,纹状体和胼胝体的脑血流量减少远小于大脑皮层,血液可中使T2值升高的O-Hb含量更高。
采用1.5 T磁共振分别进行T2*加权的FLASH和BOLD扫描发现正常人静脉窦的T2*信号增强率最大,灰质的增强率大于白质[17,18],由于人脑灰质与白质脑血容量的比例大约是2∶1[19],推测吸入纯氧对脑组织的增强效应可能与其血容量成比例。本实验发现吸入纯氧后大鼠脑灰、白质T2*值不同程度延长,大脑皮层的T2*值变化率明显高于胼胝体。本组实验结果在一定程度上也反映了大鼠灰、白质脑血容量大小的差异。
对于吸入纯氧后脑组织弛豫时间的变化,目前仅有Uematsu等[12]运用9.4 T MRI观察正常小鼠在纯氧和95%氧+5%二氧化碳混合气吸入后大脑皮层和垂体的T1、T2弛豫值变化,发现两种气体条件下弛豫值变化所呈现相似的反应。与上述研究不同的是,首先,本实验测量了正常大鼠在室内空气下和吸入纯氧后脑组织的弛豫值,可以为今后的相关研究提供重要的参考;其次,本实验对大脑皮层、纹状体、胼胝体在吸入纯氧后的弛豫值变化率进行了比较,进一步明确了灰、白质对于纯氧的反应是有差异的。最后,本组实验中还测量了吸入纯氧后的脑血流量变化,研究了脑血流对弛豫值变化率的影响。
3.3 吸入纯氧后大鼠脑灰、白质弛豫值和脑血流变化的关系
本实验比较了吸入纯氧后大鼠脑内不同灰质区和脑白质弛豫值的变化差异,同时还进一步结合CBF测量值,更为可靠地解释了脑血流变化对于弛豫值变化程度的影响。实验中发现吸入纯氧后大脑皮层和纹状体脑血流量均较空气状态下减少,与以往的研究一致[16,20]。大脑皮层的脑血流量较纹状体减少更明显,但其T1值的变化率却在三者中最明显。所以,吸入纯氧后,脑血管收缩引起的脑血流量的减少对于T1值变化率的影响甚小。由于灰质与白质脑血容量的比例大约是2∶1[19],脑灰质区溶解的游离氧量更多,所以T1值变化率的大小可能与不同区域的脑血容量差异有关。本实验结果显示灰、白质的T2*值变化率与T1值变化率相仿,也几乎不受脑血流量减少的影响,也与脑灰、白质之间脑血容量的差异有关。
本研究结果表明在空气条件下,由于静脉的影响,胼胝体(38.9±1.9 ms)比大脑皮层(46.1±2.3 ms)和纹状体(42.2±1.2 ms)的T2值更低,但在吸入纯氧之后,胼胝体内血红蛋白饱和度有足够升高,而皮层仅接受动脉供血,可导致胼胝体T2值(43.7±2.8 ms)较接近皮层(47.5±2.0 ms)的T2值。CBF测量结果显示纹状体和胼胝体的脑血流量减少远小于大脑皮层,血液可中使T2值升高的O-Hb含量更多,表明T2值的变化率与血流量变化有关。
综上所述,运用7.0 T超高强MR扫描仪,可以获得更高的空间分辨力及更精确、可靠的实验数据。吸入纯氧后,血液中溶解游离氧含量增大,使大鼠脑灰、白质T1弛豫值的缩短。氧合血红蛋白比例的升高造成脑灰、白质T2、T2*值的延长。大鼠脑灰、白质T2值变化率的差异,主要是由于灰、白质内动、静脉和毛细血管的分布不同和吸入纯氧后脑血流变化所决定的。吸入纯氧可以造成脑血管收缩,但是脑血流量减少对T1、T2*弛豫值影响甚少,T1和T2*值弛豫变化率与灰、白质的脑血容量有关。通过吸入纯氧这一简单、有效的途径,可以将游离氧作为一种外源性的顺磁性对比剂,为进一步探索评价脑血管反应的提供了新的方法。
[1]Young IR, Clarke GJ, Bailes DR, et al.Enhancement of relaxation rate with paramagnetic contrast agents in NMR imaging.J Comput Tomogr, 1981, 5(6): 543-547.
[2]Edelman RR, Hatabu H, Tadamura E, et al.Noninvasive assessment of regional ventilation in the human lung using oxygen-enhanced magnetic resonance imaging.Nat Med,1996, 2(11):1236-1239.
[3]Tadamura E, Hatabu H, Li W, et al.Effect of oxygen inhalation on relaxation times in various tissues.J Magn Reson Imaging, 1997, 7(1):220-225.
[4]Jones RA, Ries M, Moonen CT, et al.Imaging the changes in renal T1 induced by the inhalation of pure oxygen: a feasibility study.Magn Reson Med, 2002, 47(4): 728- 735.
[5]Noseworthy MD, Kim JK, Stainsby JA, et al.Tracking oxygen effects on MR signal in blood and skeletal muscle during hyperoxia exposure.J Magn Reson Imaging, 1999,9(6): 814-820.
[6]Deliganis AV, Fisher DJ, Lam AM, et al.Cerebrospinal fluid signal intensity increase on FLAIR MR images in patients under general anesthesia: the role of supplemental O2.Radiology, 2001, 218(1):152-156.
[7]Kettunen MI, Grohn OH, Silvennoinen MJ, et al.Effects of intracellular pH, blood, and tissue oxygen tension on T1rho relaxation in rat brain.Magn Reson Med, 2002,48(3):470-477.
[8]Thulborn KR, Waterton JC, Matthews PM, et al.Oxygenation dependence of the transverse relaxation time of water protons in whole blood at high field.Biochim Biophys Acta, 1982, 714(2):265-270.
[9]Wright GA, Hu BS, Macovski A.1991 I.I.Rabi Award.Estimating oxygen saturation of blood in vivo with MR imaging at 1.5 T.J Magn Reson Imaging, 1991, 1(3): 275-283.
[10]Messager T, Franconi F, Lemaire, et al.MRI Study of transient cerebral ischemia in the gerbil: interest of T2 mapping.Invest Radiol, 2000, 35(3):180-185.
[11]Guilfoyle DN, Dyakin VV, O'Shea J, et al.Quantitative measurements of proton spin-lattice (T1) and spin-spin(T2) relaxation times in the mouse brain at 7.0 T.Magn Reson Med, 2003, 49(3):576-580.
[12]Uematsu H, Takahashi M, Hatabu H, et al.Changes in T1 and T2 observed in brain magnetic resonance imaging with delivery of high concentrations of oxygen.J Comput Assist Tomogr, 2007, 31(5):662-665.
[13]杨正汉,冯逢,王霄英.磁共振成像技术指南-检查规范、临床策略及新技术应用.北京:人民军医出版社, 2007:297-299.Yang ZH, Feng F, Wang XY.A guide to technique of magnetic resonance imaging - criterion of examination,clinical strategy and application of new techniques.Beijing: People's Military Medical Press, 2007: 297-299.
[14]Law R, Bukwirwa H.The physiology of oxygen delivery.Update Anaesthesia, 1999, 10:1-2.http://www.nda.ox.ac.uk/wfsa/html/u10/u1003_01.htm
[15]Santosh C, Brennan D, McCabe C, et al.Potential use of oxygen as a metabolic biosensor in combination with T2*-weighted MRI to defi ne the ischemic penumbra.J Cereb Blood Flow Metab, 2008, 28(10):1742-1753.
[16]Lu J, Dai G, Egi Y, et al.Characterization of cerebrovascular responses to hyperoxia and hypercapnia using MRI in rat.Neuroimage, 2009, 45(4):1126-1134
[17]Berthezène Y, Tournut P, Turjman F.Inhaled Oxygen: A Brain MR Contrast Agent? AJNR, 1995, 16(10):2010-2012.
[18]Losert C, Peller M, Schneider P, et al.Oxygen-enhanced MRI of the brain.Magn Reson Med, 2002, 48(2):271-277.
[19]Greenberg JH, Alavi A, Reivich M, et al.Local cerebral blood volume response to carbon dioxide in man.Circ Res, 1978, 48(2):324-331.
[20]Bulte DP, Chiarelli PA, Wise RG, et al.Cerebral perfusion response to hyperoxia.J Cereb Blood Flow Metab, 2007,27(1): 69-75.
