高羊茅对土壤中菲、芘污染的修复机制研究
2010-09-19潘声旺魏世强
潘声旺,魏世强
(1.成都大学环境科学与工程研究所,四川成都 610106;2.西南大学资源环境学院,重庆 400715)
高羊茅对土壤中菲、芘污染的修复机制研究
潘声旺1,2,魏世强2
(1.成都大学环境科学与工程研究所,四川成都 610106;2.西南大学资源环境学院,重庆 400715)
采用盆栽试验法,研究高羊茅对土壤中芘、菲的去除效果与修复机制.结果显示:试验浓度范围(0~322 mg·kg-1)内,高羊茅能在芘、菲污染土壤中正常生长,且对污染物有较好的去除效果.种植高羊茅70 d后,菲、芘去除率分别为52.82%~83.28%、47.27%~75.39%;平均去除率分别比对照1(加0.1%NaN3)高63.04%、57.48%,比对照2(无NaN3)高45.59%、41.8%.修复植物也具有一定的积累作用,根部、茎叶部积累量随土壤中菲、芘含量增加而增大;生物浓缩系数则随菲、芘含量增加而减小,且根部大于茎叶部、芘大于菲.修复过程中,非生物因子、植物积累、植物代谢、微生物降解对菲去除的贡献率分别为5.1%、0.29%、3.42%、17.47%,对芘去除的贡献率分别为2.56%、1.87%、3.4%、15.68%;植物—微生物间的交互作用对菲、芘去除的贡献率则高达41.88%和36.54%.说明植物—微生物交互作用是土壤中菲、芘去除的主要原因.
植物修复;多环芳烃;高羊茅;土壤
0 引 言
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是环境中普遍存在的一类持久性有机污染物,其性质稳定、水溶性差,在环境中的含量逐年上升.在我国,局部土壤 PAHs含量高达 102μg·kg-1~104μg·kg-1,部分交通干线、厂矿和城郊附近已达到108μg·kg-1数量级[1],严重威胁着土壤的生态安全和人类健康.目前,有效修复土壤PAHs污染已成为环境保护领域的焦点问题.
与传统修复方法相比,植物修复投资少、效益高、环境友好,其发展潜力巨大.但植物修复技术起步较晚,其修复机制还不甚明确[2].本研究选择菲、芘为PAHs代表物,以分布广、适应性强的地被植物高羊茅(Festuca arundinacea)作为修复材料,探讨其对菲、芘污染的修复作用及机制,以期为PAHs污染土壤的生态修复提供依据.
1 材料与方法
1.1 试验材料
以7 d龄高羊茅幼苗为试验材料.种子经双氧水处理后,无菌条件下催芽、培养7 d.选择大小相近的幼苗,经蒸馏水洗净后备用.供试土壤为紫色土,其理化性质如下:有机质22.3 g.kg-1,CMC为27.43 cmol·kg-1,pH值为7.19,速效N、P、K分别为114.6、24.7、94.8 mg.kg-1.
1.2 试验方法
盆栽试验于温室内进行,试验周期70 d.土样采集后,风干,过3 mm筛.将一定量的菲、芘经丙酮溶解后,均匀洒在土样表层,待丙酮挥发后,多次搅拌、混匀,各制备6个污染水平,初始浓度如表1所示.

表1 土壤中菲、芘初始浓度
不同污染水平的土壤上,分别设置4种处理:①处理1(CK1).无植物,加0.1%NaN3(抑制微生物活动)[3];②处理2(CK2).无植物,不加NaN3;③处理3 (TR3).种植物,加0.1%NaN3;④处理4(TR4).种植物,不加NaN3.取各土样2 kg装盆,50%田间持水量下室内平衡7 d.除CK1、CK2外,每盆栽幼苗10株.试验期间,田间持水量维持在50%(称重补水).各处理重复5次.种植70 d后整株采样,根、茎叶分离,冲洗干净后,冷冻干燥,研磨过 1.0 mm筛, -20℃下低温保存,钵中土样混匀后,四分法采集,风干,过20目筛,低温保存,待分析.
1.3 样品测定
PAHs的提取、净化方法参照文献[4]中相关方法,HPLC测定,DAD检测器,甲醇加水(83∶17)为流动相,菲、芘检测波长分别为246、235 nm.依照此条件,菲、芘检测限分别为42.6、54.2 pg·L-1,土样中菲、芘回收率(外标法,下同)分别为96.78%(n=7, RSD<5.52%)、94.93%(n=7,RSD<5.82%),植物样为95.36%(n=7,RSD<4.28%)、94.11%(n=7, RSD<5.06%).
1.4 数据处理
数据处理采用SPSS13.0进行Duncan’s多重比较(Duncan’s Multiple Range Test).PAHs去除率(R)计算式为,

其中,C0为土壤中PAHs初始浓度,Ct为取样时残留浓度.
2 结果与分析
2.1 高羊茅的修复作用
2.1.1 菲、芘污染对高羊茅生长的影响.
生长70 d后,不同污染水平下高羊茅的生长状况如表2所示.表2数据显示:菲污染土壤中,单株生物量、株高、根冠比、根面积(亚甲基兰吸附法测定)与对照组(T0组)间差异不显著(n=25,P>0.05),但根冠比、根面积均大于 T0组,高污染(T5)环境中,株高、生物量表现出受抑制趋势,但差异不显著(n=25,P>0.05);芘污染土壤中,高羊茅的生长状况与菲污染时相似.实验数据说明,在试验浓度范围内,菲、芘污染对高羊茅生长影响较小.
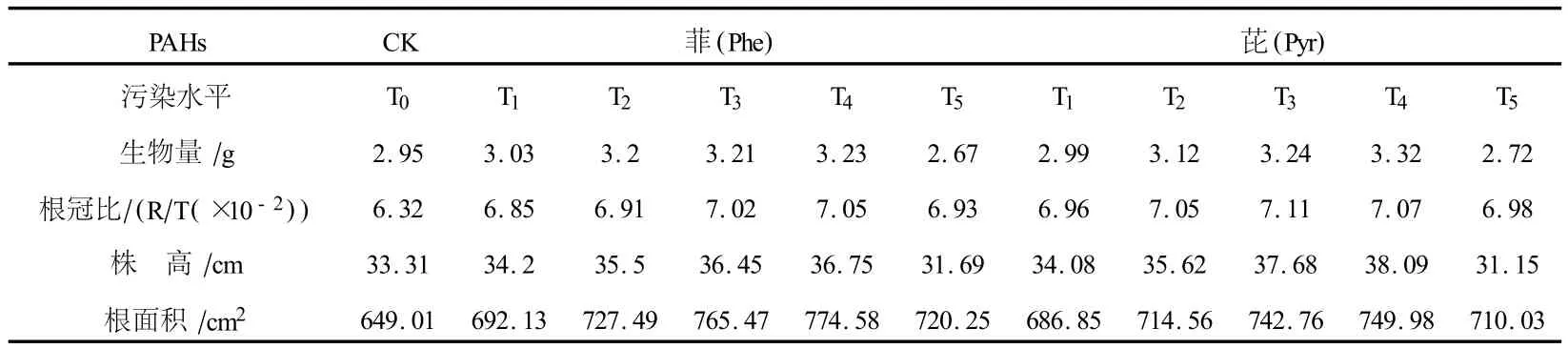
表2 不同污染水平下高羊茅的生长状况
2.1.2 高羊茅对土壤中菲、芘的去除作用.
试验末期,不同处理土壤中PAHs残留量如表3所示.表3数据显示:随着添加浓度的增加,土壤中菲、芘浓度也逐渐增大;相同添加浓度下,残留浓度的高低顺序为,CK1>TR3>CK2>TR4,除CK1、TR3外,不同处理间差异显著(n=5,p<0.05);4个处理中,TR4所在土壤的PAHs残留量最低,与其他处理间差异极显著(n=5,p<0.01).

表3 不同处理条件下土壤中PAHs的残留量差异
在去除效果上,植物—微生物处理系统(TR4)中,菲的去除率为 52.82%~83.28%,平均为68.16%;CK1、CK2、TR3处理菲的去除率分别为3.32%~6.65%、14.73%~30.08%、4.43%~ 13.3%,平均去除率分别比 TR4处理土壤低63.06%、45.59%、59.35%.芘的情况与菲类似,TR4中芘的去除率为47.27%~75.39%,平均为60.04%;CK1、CK2、TR3中芘的去除率分别为1.82%~3.21%、12.28%~24.23%、3.96%~13.44%,平均去除率分别比 TR4处理低 57.48%、41.8%、52.22%.相同条件下,芘的残留浓度高于菲,可能与芘的分子量大、难降解,在土壤中滞留性更强有关[5].4种处理中TR4的菲、芘的去除率最高,说明利用高羊茅修复菲、芘污染土壤在理论上是可行的. 2.1.3 高羊茅对菲、芘的富积作用.
添加在土壤中的 PAHs除部分残留在土壤中外,也有相当一部分被植物体吸收、积累,积累量的多少与污染物的性质、浓度以及植物自身的生理特征等因素密切相关.70 d后,不同污染水平下土壤中PAHs残留浓度、植物体内累积浓度间的对应关系如图1所示.

注:CR、CS为PAHs在根系、茎叶内积累浓度;R-BCFs、S-BCFs为根系、茎叶内生物浓缩系数;括号内数值为PAHs残留浓度.图1 高羊茅对菲、芘的积累作用
从图1中可以看出:随着PAHs添加浓度的增加,土壤残留浓度逐渐增大,植物体内积累浓度也明显升高,且积累浓度与添加浓度成正相关.植物不同部位的菲、芘积累浓度也不一样,相同处理条件下茎叶中菲、芘含量远小于根.在供试浓度范围内,土壤中菲的残留浓度为3.55~151.95 mg·kg-1,高羊茅根部、茎叶中菲的积累浓度分别为9.86~36.84、3.14~12.9 mg·kg-1;芘的残留浓度为4.98~169.48 mg·kg-1,根、茎叶中芘的积累浓度分别为57.72~237.8、18.57~112.35 mg·kg-1.有学者研究认为:PAHs在植物体内不同部位积累差异可能与自身脂肪含量的不均匀性有关(高羊茅根部、茎叶部脂肪含量分别为0.77%、0.16%).在相似添加浓度下,高羊茅根、茎叶中芘含量大于菲,根对土壤芘的吸收量也明显大于菲,这可能与芘的logK ow较大有关(菲、芘的logK ow分别为4.46、4.88)[6].
分析高羊茅对土壤中菲、芘的生物浓缩系数(bioconcentration factors,BCFs)结果表明,BCFs随土壤中PAHs残留浓度的增大而减小,且芘大于菲.图1还显示:植物不同部位对PAHs的BCFs也不一样,如高羊茅根部菲、芘的BCFs分别为0.24~2.78、1.4~11.59,茎叶部菲、芘的BCFs分别为0.08~0.89、0.66~3.73,相同环境浓度下,根部的BCFs大于茎叶部.因其根冠比较小(见表2),茎叶仍然是高羊茅富集菲、芘的主要部位.
2.2 植物修复机制分析
土样中PAHs的去除主要源于各种非生物因子(如渗滤、吸附、光解、挥发等)和生物因子(如植物代谢、积累、微生物降解、植物—微生物交互作用等)的共同作用.本试验中,CK1中PAHs的去除主要源于各种非生物损失;CK2中PAHs的去除源于非生物降解、微生物降解;TR3中PAHs的去除则是非生物损失、植物代谢及植物积累;TR4中PAHs的去除主要是非生物降解、植物、微生物的共同作用.在不考虑因子间交互作用的情况下,各处理土壤中PAHs的表观去除率可用以下公式表述:
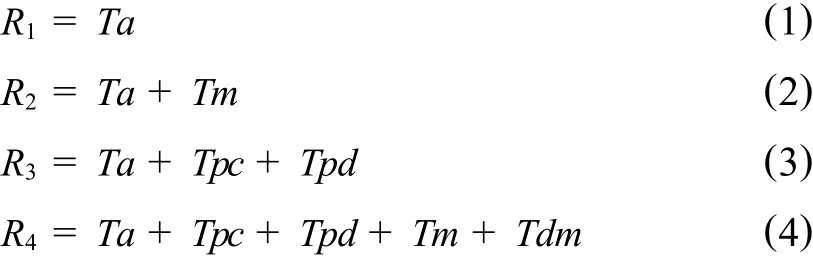
式中,R1、R2、R3、R4分别为 CK1、CK2、TR3、TR4中菲、芘的去除率;Ta、Tpc、Tpd、Tm、Tdm分别代表非生物性损失、植物积累、植物代谢、微生物降解、植物—微生物交互作用在PAHs去除过程中的贡献率.分析各处理渗滤液、土样、植物样中菲、芘含量,得到各因子在PAHs修复过程中的表观贡献率如表4所示.
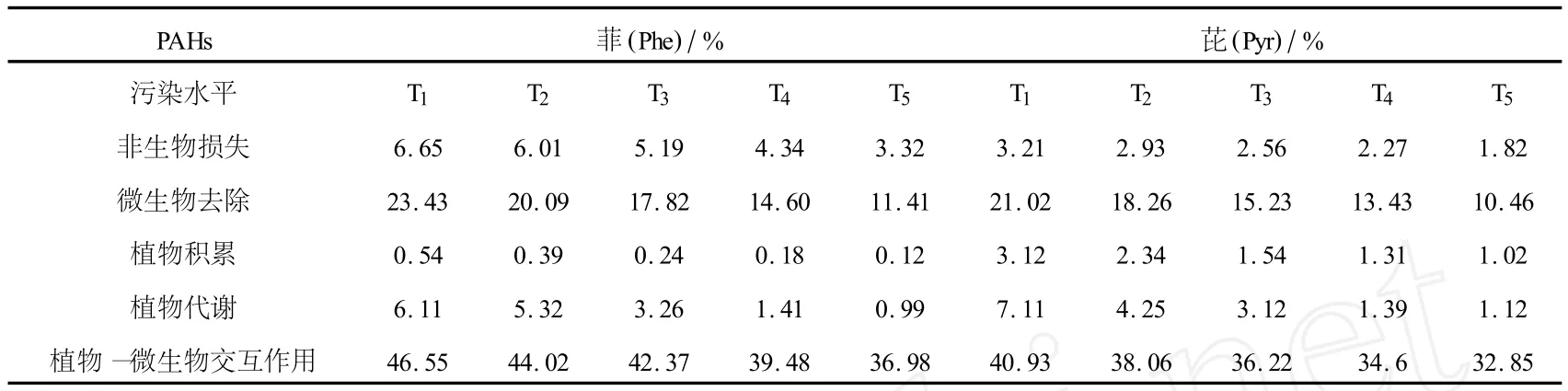
表4 生物、非生物因子在修复PAHs污染土壤过程中的贡献率
本试验中,CK1中菲、芘降解率分别为3.32%~6.65%(平均值m=5.1%)、1.82%~3.21%(m= 2.56%),说明非生物性损失不是PAHs去除的主要途径.植物积累部分占菲、芘总量的0.12%~0.54% (m=0.29%)、1.02%~3.12%(m=1.87%);代谢部分占菲、芘总量的0.99%~6.11%(m=3.42%)、1.12%~7.11%(m=3.4%),说明植物吸收(包括植物代谢、积累)也不是PAHs去除的主要途径.相比之下,微生物降解、植物—微生物交互作用对PAHs去除的贡献较大.具体而言,微生物降解去除11.41%~23.43%(m=17.53%)的菲,10.46%~21.02%(m=15.68%)的芘,植物—微生物交互作用去除36.98%~46.55%(m=41.88%)的菲,36.54%~40.93%(m=36.54%)的芘.
3 讨 论
植物的吸收、积累或根际矿化作用是植物—微生物系统中PAHs的去除途径之一.植物可以吸收、积累部分PAHs,吸收速率与植物自身的生理适应性、PAHs的生物有效性呈正相关[7].同时,在氧化还原酶、水解酶等胞外酶的作用下,部分PAHs转化为能被植物细胞直接吸收的小分子物质[8],部分以原始状态积聚在植物体内.本研究表明:在PAHs去除过程中,仅3.71%的菲、5.27%的芘被植物直接积累或代谢.由此可见,植物的积累或代谢作用并不是土壤中PAHs去除的主要原因.
微生物降解是PAHs去除的另一途径,其降解能力与微生物种类、数量及其生理活性密切相关[9,10].本研究中,当CK1微生物活性被抑制后,两对照组(CK2、CK1)中菲、芘残留量差异(即微生物降解部分)分别占其添加总量的17.53%、15.68%,说明土壤(土著微生物)对PAHs污染具有一定的自净能力,但与菲、芘的总去除率(68.16%、60.04%)相比,微生物降解也不是PAHs去除的主要原因.
在根际环境中,根系分泌物、胞外酶有时能提高根际微生物活性,促进生物转化[11].植物的存在不仅能增强微生物活性,扩大根际微生物区系的活动范围,也能改善根际土壤的理化性质,提高土壤酶活性,促进PAHs去除[12].植物—微生物间的交相互作用有时还能降解植物或根际微生物单独作用所不能去除的污染物[13].本研究中,植物—微生物交互作用去除的菲、芘量分别占其总添加量的41.88%、36.54%,占被去除菲、芘总量的61.44%、60.86%,其作用超过非生物降解、微生物降解、植物直接作用等因子的去除作用之和.可见,植物的存在明显促进了土壤中菲、芘的降解.此外,土壤酶活性的监测结果也显示:植物—微生物系统中多酚氧化酶、脲酶、脱氢酶活性明显高于同污染水平的其他处理,呈现TR4>CK2>TR3>CK1的变化趋势,例如T3污染水平下,70 d后,脱氢酶在TR4、CK2、TR3、CK1菲污染土壤中酶活性依次为0.185、0.124、0.087、0.075 μL·μg-1,在芘污染土样中的酶活性依次为0.175、0.116、0.079、0.067μL·μg-1.此说明植物的存在强化了根际微生物的活性,植物—微生物交互作用是提高PAHs去除的根本原因.
PAHs在土壤与植物间分配富集关系可用生物浓缩系数进行评估,BCFs越大表明植物对污染物的富集能力越强[14].本研究中,植物体内PAHs的积累量随土壤中初始添加量的增加而增大,而根系、茎叶内BCFs随PAHs添加量增大而减小.不同组织内PAHs积累量差异较大,根部大于茎叶部,芘的要大于菲.这可能与生物浓缩系数和PAHs溶解度、K ow间存在一定相关性有关,即随PAHs溶解度的增加而增大,随K ow值的增大而减小[15].植物组织中高浓度脂溶性物质的存在能提高PAHs的溶解度,进而加剧PAHs的积累.
4 结 论
(1)在试验浓度(0~322mg·kg-1)范围内,高羊茅能够在菲、芘污染土壤中正常生长,表现出较好的生长适应性,植物根面积、根冠比均大于对照组.
(2)高羊茅对菲、芘具有较强的修复作用.种植70 d后,植物—微生物系统所在土壤中菲的去除率为52.82%~83.28%,平均为68.16%;芘的去除率为47.27%~75.39%,平均为60.04%,修复效果明显.
(3)高羊茅对菲、芘的积累量与土壤中PAHs添加浓度正相关,BCFs则与添加浓度负相关.
(4)试验期间,植物—微生物交互作用去除了41.88%的菲、36.54%的芘,占被去除菲、芘总量的61.44%、60.86%,这是高羊茅修复菲、芘污染的最根本原因.
[1]Li X H,Ma L L,Liu S F,et al.Polycyclic aromatic hydrocarbon in urban soil from Beijing,China[J].Journal of Environmental Sciences,2006,18(5):944-950.
[2]Gao Y Z,Zhu L Z.Plant uptake,accumulation and translocation of phenanthrene and pyrene in soils[J].Chemosphere,2004,55 (1):1169-1178.
[3]Kan A T,Fu GM,Hunter M A.Irreversible adsorption of naphthalene and tetrachorobiphenyl to lulu and surrogate sediment[J]. Environmental Science and Technology,1997,31(8):2176-2185.
[4]Pan S W,Wei SQ,Yuan X,et al.The Removal and Remediation of Phenanthrene and Pyrene in Soil by Mixed Cropping of Alfalfa and Rape[J].Agricultural Sciences in China,2008,7(11):1355-1364.
[5]Zhu L Z,Cao Y Z.Prediction of phenanthrene uptake by plants with a partition-limited model[J].Environmental Pollution, 2004,131(1):505-508.
[6]Beath J M.Consider phytoremediation for waste site cleanup[J]. Chemical Engineering Progress,2000,96(7):61-69.
[7]Xu S Y,Chen Y X,Wu W X,et al.Enhanced dissipation of phenanthrene and pyrene in spiked soils by combined plants cultivation[J].Science of the T otal Environment,2006,363(1):206 -215.
[8]Liliana G,Maria A R.Potential of extra cellular enzymes in remediation of polluted soils:a review[J].Enzyme and Microbial Technology,2004,35(4):339-354.
[9]T oner E J,Lceyval C.Rhizosphere gradients of Polycyclic Aromatic Hydrocarbons dissipation in two industrial soil and the impact of arhuscular mycorrhiza[J].Environmental Science and Technology,2003,37(1):2371-2375.
[10]Chen YC,Katherinebanks M,Paulschwab A.Pyrene degradation in the rhizosphere of tall Fescue(Festuca arundinacea)and switchgrass(panicum virgatum)[J].Environmental Science and Technology,2003,37(1):5778-5782.
[11]Y i H,Crowley D E.Biostimulation of PAH degradation with plants containing high concentrations of linoleic acid[J].Environmental Science and Technology,2007,41(12):4382-4388.
[12]WangJ,Zhang Z Z,Su YM,et al.Phytoremediation of petroleum polluted soil[J].Petroleum Science,2008,5(2):167-171.
[13]Maila M P,Randima P,Cloete T E.Multispecies and monoculture rhizoremediation of polycyclic aromatic hydrocarbons (PAHs)from the soil[J].International Journal of Phytoremedition,2005,7(2):87-98.
[14]Jon A,Arnot,Frank A P C.A review of bioconcentration factor (BCF)and bioaccumulation factor(BAF)assessments for organic chemicals in aquatic organisms[J].Environmental Reviews,2006,14(4):257-297.
[15]Tao S,Jiao X C,Chen S H.Accumulation and distribution of polycyclic aromatic hydrocarbons in rice(Oryza sativa)[J].Environmental Pollution,2006,140(3):406-415.
Repair Mechanism Research on Pollution of Phenanthrene and Pyrene by Tall Fescue in Soil
PAN Shengwang1,2,WEI Shiqiang2
(1.Institute of Environment Science and Engineering,Chengdu University,Chengdu,610106,China; 2.School of Resources and Environment,Southwest University,Chongqing 400716,China)
Micropot experiments were carried out to investigate the mechanisms of the removal and accumulation of phenanthrene(Phe)and pyrene(Pyr)by tall fescue(Festuca arundinacea).The results show that the growth of tall fescue is not affected by Phe or Pyr at their initial concentrations of 0 to 322 mg·kg-1in soils and it can significantly remove polycyclic aromatic hydrocarbons(PAHs)from soils.After 10 weeksplantation,the extractable PAHs are lower in planted soils than those in unplanted soils.52.82%~83.28%of Phe or 47.27%~75.39%of Pyr are removed from the soils,respectively.Tall fescue removes averagely 63.04%of Phe or 57. 48%of Pyr from the soils as compared to CK1(with addition of 0.1%NaN3),and 45.59%of Phe or 41.8%of Pyr as compared to CK2(without NaN3).Tall fescue shows some ability to accumulate PAHs from the soils,the contents of PAHs in its root and shoot increase with the increase of PAHs concentrations in the soils.The bioconcentration factors(BCFs) for PAHs tend to decrease with increasing concentrations of these contaminants in soil,the BCFs for Pyr are higher than those for Phe,and the BCFs for Phe(0.08~0.89)or Pyr(0.66~3.73)in shoots are much lower than those in roots (0.24~2.78 and 1.4~11.59)at same treatment.Despite the plantation of tall fescue evidently enhanced the remediation of PAHs in soils,contributions of biotic and abiotic factors to phytoremediation process display distinct diversity. Abiotic loss,plant accumulation,phytodegredation and microbial degradation account for 5.1%,0.29%,3.42%and 17. 47%of the total removal of Phe,and 2.56%,1.87%,3.4%and 15.68%of Pyr from soils,respectively.In contrast, 41.88%of the total removal of Phe or 36.54%of Pyr is attributed to the contributions of plant-microbial interactions. Thus plant-microbial interactions are the main mechanisms for the remediation of soil PAHs pollution.
phytoremediation;polycyclic aromatic hydrocarbons;Festuca arundinacea;soil
X53
:A
1004-5422(2010)02-0107-05
2010-03-15.
国家科技支撑计划基金资助项目(2007BAD87B10-05);国家“863计划”基金资助项目(2006AA10Z427).
潘声旺(1973—),男,博士,从事污染生态学研究.
