乳腺动态增强MRI参数与肿瘤血管的相关性及其鉴别诊断价值
2010-09-19李功杰曾亚伟张建忠
李 敏,金 真*,李功杰,张 磊,曾亚伟,李 科,崔 彦,张建忠
随着乳腺磁共振扫描技术的快速发展,动态增强磁共振成像(dynamic contrast-enhanced MR imaging, DCE-MRI)已成为敏感度最高的检查手段之一,它不仅能够提供清晰的图像,反映乳腺病变的形态学特征,而且能够通过图像后处理得到多个定量或半定量参数,用于临床良、恶性病变的诊断和鉴别诊断[1-3]。而肿瘤的发生、发展及转归与肿瘤的血管生成密切相关,微血管密度(microvessel density,MVD)和血管内皮生长因子(vascular endothelial growth factor, VEGF)是反映肿瘤血管生成最重要的生物因子[4,5]。探讨DCE-MRI的各项定量参数与MVD、VEGF的相关性,对于深入理解参数的生物学基础和诊断价值,具有重要的意义。
1 资料与方法
1.1 研究对象
2007年12月-2009年4月在解放军第306医院普外科住院治疗的女性乳腺疾病患者52例,年龄18~73岁,平均44岁。所有患者术前接受DCE-MRI检查,检查后1周内进行手术治疗。对手术切除组织进行常规病理和免疫组化检查,观察MVD及VEGF的表达。对DCE-MRI多项参数与免疫组化结果进行相关性分析。病理报告证实52例患者中乳腺癌22例(浸润性导管癌16例、髓样癌2例、导管内乳头状癌1例、浸润性小叶癌2例、浸润性微乳头状癌1例),共26个病灶;良性病变30例(纤维腺瘤12例、乳腺炎2例、乳腺囊肿1例、导管内乳头状瘤1例、良性叶状肿瘤1例、脂肪瘤2例、错构瘤1例、乳腺导管内瘤变(DIN)Ⅰ~Ⅲ级4例、其他增生类病变6例),共38个病灶。
1.2 扫描方法
DCE-MRI扫描采用德国SIEMENS公司的3.0 T Trioa Tim 32通道全身磁共振扫描仪,专用乳腺相控阵线圈。患者取头先进俯卧位,双侧乳腺充分暴露,自然下垂,双臂置于头两侧。采用快速小角度激发扰相梯度回波三维成像序列进行轴位扫描,加SPAIR脂肪抑制;TR=4.26 ms,TE=1.8 ms,层厚1 mm(连续无间断扫描),视野348 mm×340 mm,矩阵448×318。对比剂采用先灵公司的钆喷酸葡胺(Gd-DTPA),剂量0.1 mmol/kg,高压注射器以2 ml/s的速度注入。增强前扫描一次,注入对比剂后20 s连续扫描5次,共6 min 10 s。
1.3 图像后处理
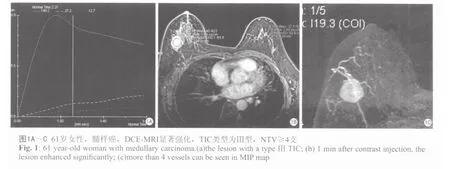
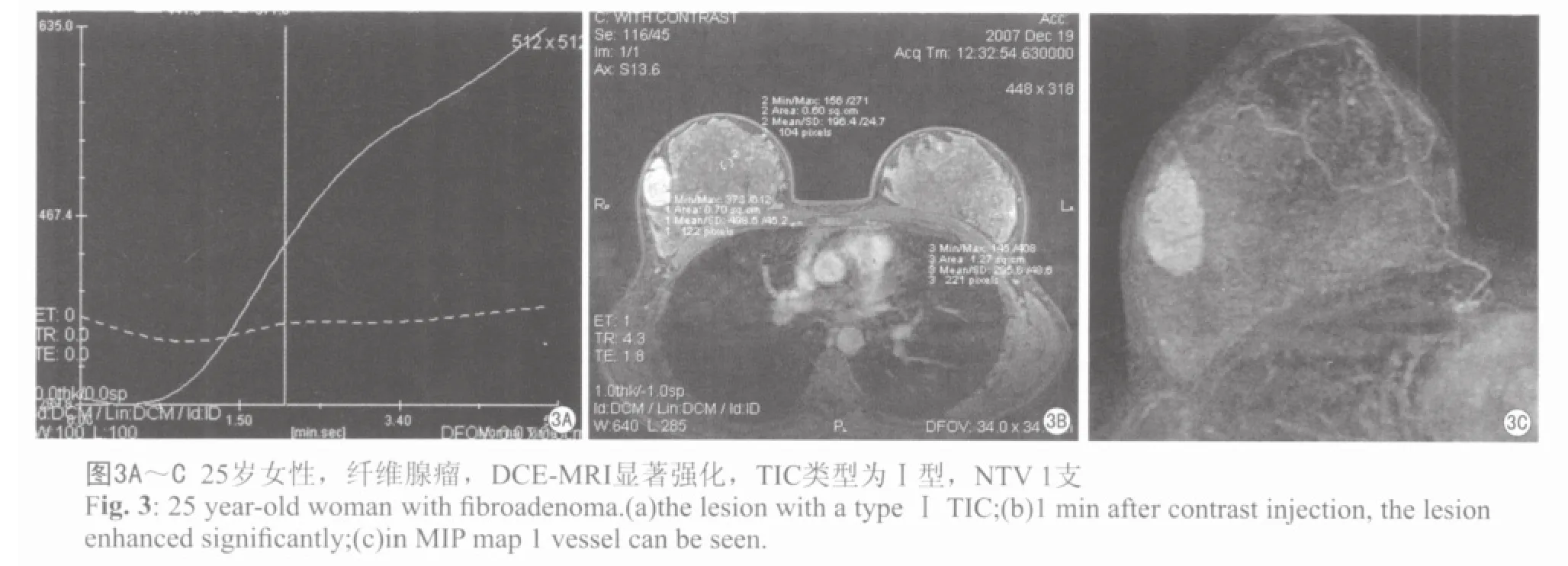
通过MEAN CURVE软件,在病变部位选取适当的感兴趣区(ROI),ROI不宜过大,选择病灶最大层面,避开坏死、出血、囊变或钙化区域,绘制病灶的TIC曲线,按其形态分为三型:Ⅰ型:流入型(在动态观察时间内呈持续线性上升);Ⅱ型:平台型(早期信号强度逐渐增加,中晚期强度变化在10%之内):Ⅲ型:流出型(对比剂呈快进快出型,中晚期信号强度明显减低)。 取注入对比剂后1 min的图像与增强前图像做减影和最大强度投影(MIP)三维重建,在MIP图上计数肿瘤血管数目(NTV):0支,1支,2支 ,3支,≥4支计为4。通过TIC曲线测量计算下列参数:强化峰值(SImax)、达峰时间(Tpeak)、早期增强率(early-phase enhancement rate, EER)=(SI1min-SI0)/SI0×100%、最大线性斜率,即曲线上升阶段的线性斜率(slope)=(SIpost-SI0)×100%/SI0×(Tpost-T0)。SIpost及Tpost指曲线快速上升阶段最高点的信号强度及时间。
1.4 病理分析
52例患者均经手术获得大体标本,在标本最大层面切开取材,厚3 μm,经10%福尔马林固定,石蜡包埋切片,按即用性快捷免疫组化试剂盒MaxVisionTM说明步骤进行免疫组化。主要试剂:鼠抗人VEGF单克隆抗体(产品编号:MAB-0243,克隆号:VG1)、鼠抗人CD34单克隆抗体(产品编号:MAB-0034,克隆号:QBEnd/10)及即用性快捷免疫组化MaxVisionTM试剂盒,均购自福州迈新生物技术开发公司。
结果判定:VEGF为胞浆表达,阳性者表现为胞浆出现棕黄色颗粒。阳性细胞<50%为(+);阳性细胞>50%为(++);胞浆不出现棕黄色颗粒者为(-)。MVD计数:在光学显微镜下先行低倍镜下(40倍)进行观察,分别在肿瘤边缘及中心寻找微血管最多区域,再在200倍镜下计数5个视野的微血管数,并求其平均数。分别测量肿瘤边缘(mMVD)及中心区(cMVD)的微血管密度。
1.5 统计学方法
应用SPSS 10.0软件进行统计分析。计量资料用t检验(双侧α=0.05),组内采用方差分析;两变量相关分析用直线相关分析或Spearman等级相关分析(双侧α=0.05),P<0.005为有统计学意义。
2 结果
2.1 乳腺良、恶性病变各动态增强参数及TIC类型比较
由表1可以看出,各组动态强化参数中EER、SImax、Tpeak及NTV在良、恶性病变间有显著差异,恶性病变的EER和NTV显著高于良性病变,Tpeak及SImax低于良性病变。Slope在良、恶性病变间无显著性统计学差异。
由表2可见,乳腺癌的TIC类型为:Ⅱ、Ⅲ型;而乳腺良性病变TIC类型为:Ⅰ、Ⅱ型;其中Ⅰ型均为良性病变,而Ⅲ型均为恶性病变。Ⅱ型曲线中45.5%为恶性病变,54.5%为良性病变。
表1 乳腺良、恶性病变各动态强化参数的比较()Tab.1 Comparison of DCE MRI parameters between benign and malignant breast lesions

表1 乳腺良、恶性病变各动态强化参数的比较()Tab.1 Comparison of DCE MRI parameters between benign and malignant breast lesions
参数parameter恶 性(n=22)malignant良 性(n=30)benign t 值t P值P EER 140.35±43.92% 96.08±56.32% 3.06 <0.005 Slope 75.99±22.46% 67.33±32.27% 1.08 >0.10 SImax 621.95±142.99 744.41+170.74 -2.72 <0.005 Tpeak 2.93±1.03 4.66±0.79 -6.78 <0.005 NTV 2.23±1.17 0.77±0.68 6.03 <0.005

表2 乳腺良恶性病变 TIC曲线类型的比较Tab.2 Comparison of TIC type between benign and malignant breast lesions
表3 乳腺良恶性病变的MVD及VEGF比较()Tab.3 The comparison of MVD and VEGF between benign and malignant breast lesions

表3 乳腺良恶性病变的MVD及VEGF比较()Tab.3 The comparison of MVD and VEGF between benign and malignant breast lesions
注:VEGF为(-)记为0,(+)记为1,(++)记为2Note: VEGF (-) =0, VEGF (+)=1, VEGF (++)=2
参数parameter恶 性(n=22)malignant良 性(n=30)benign t值t P值P mMVD 92.77±25.58 53.70±34.12 4.516 <0.005 cMVD 47.36±19.05 22.40±10.03 6.127 <0.005 VEGF 1.82 ±0.39 0.97±0.72 5.023 <0.005
2.2 乳腺良、恶性病变的DCE-MRI表现
图1~3分别为乳腺髓样癌、乳腺浸润性导管癌、乳腺纤维腺瘤的DCE-MRI表现。
2.3 乳腺良、恶性病变MVD及VEGF的结果分析
由表3可见,乳腺癌的mMVD、cMVD、VEGF表达均明显高于良性病变,P<0.005,两组比较统计学差异有显著性。
图4~7所示为乳腺良、恶性病变的CD34及VEGF免疫组化染色结果。
2.4 MVD、VEGF与各组动态强化参数间的直线回归分析
由表4可见,乳腺良、恶性病变的mMVD、VEGF与TIC类型、Tpeak、MIP血管计数有相关性;其中TIC类型与mMVD的关系最密切(r=0.669,P<0.001);TIC Ⅰ型,mMVD 48.41±20.84;Ⅱ型,mMVD 66.14±26.16;Ⅲ型,mMVD 97.08±28.89;两两比较,P<0.001,均有显著统计学差异。1例慢性炎症及1例纤维腺瘤的mMVD较高(>100/hp)。而Tpeak与VEGF的关系最密切(r=0.508,P<0.001)。乳腺癌中无1例为VEGF阴性;有3例纤维腺瘤、1例错构瘤、1例DIN Ⅲ级的VEGF表达为(++)。而EER、Slope、SImax与mMVD及VEGF之间无明显相关性。各参数与cMVD之间无线性关系。

表4 DCE-MRI多参数与MVD及VEGF的相关性分析Tab.4 Correlations between DCE MRI parameters and MVD, VEGF.
MVD、VEGF与TIC、Tpeak的相关性见图8。
3 讨论

3.1 DCE-MRI诊断乳腺良、恶性病变的多参数比较分析
动态增强成像是是一种结合形态学和血流动力学改变的检查方法。应用的基础主要为:乳腺癌新生的肿瘤血管、微血管密度增加,肿瘤血管对大分子对比剂通透性增加和乳腺癌组织内增大的细胞外间隙[1-5]。而TIC曲线反映了病灶血液灌注和廓清情况,是对比剂在病变组织内分布变化的直观描述,可间接揭示病变组织的血流动力学情况。普遍认为对比剂快进快出是恶性病变的显著特征,呈现出Ⅲ型曲线;而良性病变则主要呈逐渐流入的Ⅰ型曲线;还有部分良恶性病变呈无明显流入或流出趋势的Ⅱ型平台曲线。在本组研究中:Ⅰ型均为良性病变,Ⅲ型均为乳腺癌;Ⅱ型曲线:乳腺癌10/22,良性病变12/22。因此Ⅱ型曲线需进一步结合其他动态扫描参数进行鉴别诊断。这与其他学者的研究结果基本一致[6,7]。因恶性肿瘤生长快,通常有多支供血血管,血管粗大或多支密集供血,因此对比剂可以快速到达高峰,支持本组的研究结果,即乳腺癌的EER及MIP血管计数明显高于良性病变;而Tpeak明显低于良性病变。但少数学者的研究表明EER的特异性较差[8]。恶性肿瘤血供丰富,但毛细血管增生不良,存在大量动静脉吻合,因此对比剂不能持续充盈,会很快开始廓清,由此可以解释乳腺癌组的最大强化率SImax小于良性病变组的原因。
3.2 乳腺良、恶性病变间MVD及VEGF的分析比较
乳腺癌瘤体的生长与癌组织内的血管生长密切相关。丰富的血管为其快速的细胞增殖、侵袭和转移提供必要的物质条件。肿瘤内的MVD是影响肿瘤生物学的一个重要因素。Tse[9]等发现肿瘤进展的加速与肿瘤的MVD值增高密切相关,血管密度最高区可见于肿瘤组织内的任何区域,但以肿瘤组织与正常组织交界处最多见。本组研究中肿瘤边缘MVD(70.23±36.21)明显高于肿瘤中心区MVD(32.96±19.02),恶性组不论边缘或中心区的MVD均显著高于良性组;因此可以解释恶性肿瘤边缘血供丰富,但由于其血管生长快且结构不成熟,造成毛细血管渗透性强,增加其侵袭性,在动态强化中出现向周边浸润的毛刺征和环形强化;而瘤体中心的血管生成不能满足其快速生长的需要,往往形成中心区坏死;因此研究肿瘤边缘MVD更有价值。
肿瘤血管的生成依赖于多种相关因子的诱导和调节,其中VEGF被认为是促进血管生成的主要因素之一[10],它是一种分子量为34~50 kDa的蛋白,广泛分布于各种组织中的血管内皮中,能够刺激血管内皮细胞分裂、增殖,并诱导产生蛋白水解酶、间质胶原酶和组织因子来促进血管形成,同时还可提高血管通透性,促进纤维蛋白原外渗导致肿瘤间质水肿,为肿瘤浸润及转移提供合适的基础。许羽[11]等的研究认为VEGF的表达与肿块大小有关,VEGF的高表达可以促使肿瘤快速生长,肿块变大。本组研究中VEGF的阳性表达率为84.6%,强阳性率为48.1%,恶性组内未出现阴性表达,而良性组中有3例纤维腺瘤、1例错构瘤、1例DIN Ⅲ级、2例增生性病变的VEGF表达为(++),其中2例肿块直径>40 mm。经统计,病变的VEGF表达与患者年龄及肿块大小无显著相关性。
3.3 动态强化参数与MVD、VEGF的相关性分析
DCE-MRI不仅可以显示乳腺肿瘤的形态学变化,如环形强化及毛刺征,还可以通过TIC曲线、EER、MIP血管计数及Tpeak等参数客观地反映病变的血流动力学改变。动态增强扫描时,病灶强化的时间和程度主要取决于肿瘤的血管化程度、血管壁对对比剂的渗透性及肿瘤间质内压力三方面的因素,影响对比剂摄取的主要因素是肿瘤血管发生,不仅与肿瘤血管的灌注和血流量相关,血管内皮通透性也很重要。前者通过MVD衡量,后者与VEGF相关。Gilles[12]等研究了34例呈早期快速强化的乳腺导管原位癌(DCIS),病理组织学显示在病变导管的周围有丰富的微血管,而未强化的2例DCIS则微血管稀少。Buadu[13]等发现乳腺病变的MRI动态强化特征与MVD明显相关。笔者研究发现乳腺病变的Tpeak、MIP血管计数及TIC曲线类型与mMVD相关,即病变边缘微血管越丰富,病变强化越快、越早,减影后可见的血管也越多。其中TIC曲线类型与mMVD关系最密切,随着mMVD的增高,TIC曲线由流入型(Ⅰ型) 逐渐向平台型(Ⅱ型)至流出型(Ⅲ型)过渡,这表明乳腺病变的强化方式与血管生长程度有关,根据病变的动态强化参数及TIC曲线类型,可以评估乳腺病变边缘的微血管生成情况。
VEGF的作用主要表现在刺激血管内皮细胞生长和增加血管通透性两方面,Knopp[14]等认为VEGF的表达是MR强化的基础。本组研究结果显示,乳腺病变的Tpeak、MIP血管计数及TIC曲线类型与VEGF的表达有线性关系,即VEGF表达越高,肿瘤血管越丰富,强化后更容易表现为快进快出的流出型曲线。而其中Tpeak与VEGF关系最密切,本组中VEGF(-)的患者Tpeak为4.59±0.75 min,明显长于VEGF(++)的患者3.34±1.18 min;可以推断VEGF高表达的病灶,在VEGF作用下的肿瘤血管通透性强且灌注迅速,摄取对比剂较快,故峰值时间较短,与Learn[15]等的研究相符。
很多研究表明MVD及VEGF是预测乳腺癌转移、复发和预后的可靠指标[16-18]。 Coskun[19]等研究发现,VEGF高表达的乳腺癌易转移复发,预后差。
综上,MVD及VEGF不仅作为促肿瘤血管生成的重要生物学因子,与肿瘤发生、发展密切相关,还可以作为可靠的乳腺癌预后指标;而DCE-MRI作为有效的影像检查手段,其提供的多项参数:TIC曲线、MIP血管计数、Tpeak可以不同程度地反映乳腺病变的MVD和VEGF,帮助我们通过影像检查客观地揭示肿瘤内部的血管生成情况,预测其可能的转归及预后,进而为个性化治疗提供病理依据。作为无创性的检查,通过观察DCE-MRI多项参数(达峰时间、MIP血管计数及TIC曲线类型等)的变化来监测及评估目前临床上开展的乳腺癌新辅助化疗[20]及生物靶向治疗的疗效,DCE-MRI必然能够提供其他检查手段无法替代的更科学、可靠的判断依据。


4 存在的问题
乳腺病变病理类型多样,而本组研究样本量较小,未能包含全部乳腺病变,且忽略了女性生理周期对各项数据的影响,有待进一步深入研究。另外,虽然在研究中对选择ROI以及免疫组织化学标本取材部位等因素给予了足够的注意,但仍难免存在操作误差。本组中,少数良、恶性病变的DCEMRI参数及MVD、VEGF有部分重叠性,表明多血管学说尚不能完全解释乳腺病变的信号改变。Kuhl[21]等的研究发现病变的早期快速强化不但与MVD有关,还与血管大小、通透性、血流及间质的多少有关,但目前尚没有方法来区分这些因素的作用。这有待更多学者作进一步的研究。
[1]Kuhl CK, Jost P, Morakkabati N, et al.Contrast-enhanced MR imaging of the breast at 3.0T and 1.5T in the same patients.Radiology, 2006, 239(6):666-676.
[2]Beatty JD, Porter BA.Contrast-enhanced breast magnetic resonance imaging: the surgical perspective.Am J Surg,2007, 193(1): 600-605.
[3]周长玉,李苏建,卢光明,等.动态增强磁共振成像对乳腺癌的诊断.医学影像学杂志,2004,14(2): 132-135.Zhou CY, Li SJ, Lu GM, et al.The diagnosis of dynamic enhanced MRI for breast carcinoma.J Med Imaging,2004,14(2): 132-135.
[4]刘书政,黄韬.磁共振成像动态增强对乳腺癌血管生成的研究.中国肿瘤临床,2005,32(9):516-519.Liu SZ, Huang T.Angiogenesis and dynamic contrast enhanced MRI of breast cancer: preliminary results.Chin J Clin Oncol, 2005,32(9):516-519.
[5]马涛,谷俊朝.血管内皮生长因子与乳腺癌的临床研究进展.国外医学外科学分册,2005, 32(1):66-70.Ma T, Gu JC.Development of clinical study in vascular endothelial growth factor and breast cancer.Surg Foreign Med Sci,2005, 32(1):66-70.
[6]欧阳翼,谢传淼,伍尧泮,等.动态增强MRI定量参数及最大线性斜率比值对鉴别乳腺良恶性疾病的价值.中华放射学杂志, 2008,42(6):569-572.Ouyang Y, Xie CM, Wu YP, et al.The value of quantitative parameters of dynamic-enhanced MRI and the significance of the maximum linearity slope ratio in the differential diagnosis of benign and malignant breast lesions.Chin J Radiol, 2008,42(6):569-572.
[7]罗建东,叶泳松,张雪林,等.MRI三维动态增强减影技术鉴别乳腺良恶性病变的研究.实用放射学杂志,2007,23(5):688-692.Luo JD, Ye YS, Zhang XL, et al.Differential diagnosis of breast benign and malignant lesions with three dimensional dynamic contrast and digital subtraction MR imaging.J Pract Radiol, 2007, 23(5): 688-692.
[8]郭勇,蔡祖龙,蔡幼铨,等.动态增强MRI鉴别乳腺良恶性病变的前瞻性研究.中华放射学杂志,2001,35(9):671-675.Guo Y, Cai ZL, Cai YQ, et al.A prospective study of 3D dynamic MRI on differential diagnosis of breast lesions.Chin J Radiol,2001,35(9):671-675.
[9]Tse GM, MA TK, Chan FK, et al.Increased microvessel density in malignant and borderline mammary Phyllodes tumors.Histopathology, 2001,38 (6):567-570.
[10]Toi H, Hoshinga S, Takayanagi T, et al.Association of vascular endothelial factor expression with tumor angiogenesis and with early relapse in primary breast cancer.J Cancer Res, 1994,85:1045-1049.
[11]许羽,何瑞婵,黄桂睿,等.乳腺癌联合检测VEGF和MVD的临床意义.医药世界, 2007,20(2):20-21.Xu Y, He RC, Huang GR, et al.Clinical significance of combination measurement of VEGF and MVD in breast cancer.Med World,2007,20(2):20-21.
[12]Gilles R, Guinebretiere JM, Toussaint C, et al. Locally advanced breast cancer: contrast-enhanced subtraction MR imaging of response to preoperative chemotherapy.Radiology, 1994,191(6):633-638.
[13]Buadu Ld, Murakami J, Murayama S ,et al .Breast lesions: correlation of contrast medium enhancement patterns of MR images with histopathologic findings and tumor angiogenesis.Radiology,1996,200(9):639-649.
[14]Knopp MV ,Weiss E, Sinn HP, et al.Pathophysiologic basis of contrast enhancement in breast tumors.J Magnetic Resonance Imaging,1999,10(3):260-266.
[15]Learn PA, Yehi T, Nuttm M, et al.HER-2 expressing as a predictor of response to neoadjuvant docetaxel in patient with operable breast carcinoma.Cancer, 2005, 103(11):2252-2260.
[16]陈公琰,洪璇.血管内皮生长因子与肺癌的关系.中华肿瘤杂志,2005,27(8):449-451.Chen GY, Hong X.Relationship of vascular endothelial growth factor and lung neoplasms.Chin J Oncol,2005,27(8):449-451.
[17]吴鑫琦.分子预后指标在乳腺癌治疗中的作用.现代实用医学,2007,19(11):922-925.Wu XQ.Effect of molecular prognostic factors in treatment of breast cancer.Mod Pract Med,2007,19(11):922-925.
[18]彭和平,关浩,肖和龙,等.乳腺癌和癌旁组织中p53、VEGF与MVD的差异表达及其临床意义.中国医师杂志,2004,6(10):1297-1230.Peng HP, Guan H, Xiao HL, et al.Differential expression of p53, VEGF and MVD between breast cancer and peri-cancer tissue and its clincal significance.J Chin Physician,2004,6(10):1297-1230.
[19]Coskun U, Gunel N, Sancak B, et al.Significance of serum vascular endothelial growth factor, insulin-like growth factor-I levels and nitric oxide activity in breast cancer patients.Breast, 2003,12(2):104-110.
[20]Claudette E.Loo,H.Jelle Teertstra.Dynamic contrastenhanced MRI for prediction of breast cancer response to neoadjuvant chemotherapy: Initial results.AJR,2008,19(11):1331-1338.
[21]Kuhl CK, Bieling H, Gieseke J,et al.Breast neoplasm:T2* susceptibility-contrast, first-pass perfusion MR imaging.Radiology,1997,202(1):87-95.
