磁共振成像评价急性胰腺炎的严重程度与肝功能的相关性研究
2010-09-19张小明黄小华曾南林翟昭华
唐 伟,张小明,黄小华,肖 波,曾南林,翟昭华
急性胰腺炎(acute pancreatitis, AP)引起体内细胞因子及炎性因子释放,常常导致多器官的异常病理生理改变。由于胰腺和肝脏、胆囊在解剖位置、生理功能和血流动力学方面的特殊关系,AP常首先累及肝脏,可能会引起肝功能异常[1]。肝脏功能受损不仅能加重AP的病情,而且能直接影响预后。AP导致肝脏损害的病理改变包括肝细胞变性、细胞内空泡形成、充血等炎性浸润[2]。AP严重程度与肝损害发生率及肝细胞损害程度呈正相关性,重症AP患者都有可能出现不同程度的肝脏功能受损[3]。CT、MRI等影像手段对AP严重程度的评价发挥着重要的作用。MRI具有无辐射、显示轻度急性胰腺炎较CT敏感以及MRI对比剂几乎无不良反应等优点[4,5],MRI在应用于AP严重程度的判断受到临床上高度重视。因此,我们用MRI对AP严重程度进行评价,并与肝功能进行相关性分析。
1 材料与方法
1.1 研究对象
收集我院2008-2009年64例急性胰腺炎患者的磁共振影像资料,其中男30例,女34例,年龄23~76岁,平均年龄49±18岁。所有病例满足如下标准:①典型上腹部疼痛病史,血清淀粉酶、脂肪酶升高3倍以上,排除其他原因引起酶的升高;②首次发病;③无MRI扫描禁忌证,发病与MRI检查间隔时间在72小时之内;④所有病例入院前无慢性病毒性肝炎、肝硬化等肝脏疾病史。
1.2 扫描技术
扫描机型为GE Signa Excite 1.5 T超导全身磁共振机,相控阵列线圈(phased array coil)。MRI扫描序列包括横断面脂肪抑制梯度回波T1加权(gradientecho T1-weighted image, GRE T1WI),横断面快速恢复快速自旋回波呼吸门控T2加权(respiratorytriggered axial fast recovery fast spin-echo T2-weighted image, FRFSE T2WI)加脂肪抑制,冠状面和横断面单次激发快速自旋回波T2加权(single shot fast spinecho T2-weighted image, SSFSE T2WI),单次激发快速自旋回波MR胰胆管成像(MRCP),脂肪抑制3D FSPGR T1WI Gd-DTPA动态增强。
横断面GRE T1WI的扫描参数为TR 150 ms,TE 2.7 ms,翻转角为80°,层厚5~8 mm,间隔0.5~1.0 mm。FRFSE T2WI的扫描参数为TR 10000~12000 ms(由呼吸频率决定),TE 90~100 ms,层厚5 mm,间隔0.5 mm。冠状面和横断面SSFSE T2WI的参数为TR 2500~3500 ms,TE 80~100 ms,层厚5 mm,间隔0.5 mm。3D FSPGR T1WI的扫描参数为TR 6.1 ms,TE 2.1 ms,翻转角15~20°,矩阵256×128,0.5次信号平均,层厚5 mm,重叠2.5 mm,视野32 cm×24 cm,频率选择性脂肪抑制。SSFSE MRCP以胆总管下端为中心,多层多角度扫描,TR 6000 ms,TE 830~1100 ms,层厚40~50 mm。上述序列全部采用屏气扫描。
上述序列完成后,再做Gd-DTPA动态增强成像。增强扫描包括:增强前、增强后动脉期、静脉期和平衡期。增强时动脉期的采集用GE Smartprep 11.0 软件,自动跟踪触发采集,以保证动脉期的准确时相。动态增强用对比剂为马根维显(广州先灵),剂量0.2 mmol/kg,约20 ml。使用美国Medrad公司磁共振专用双管高压注射器经前臂静脉注射,速度3.5 ml/s,一般在5~7 s注射完毕,20 ml生理盐水灌洗。每一时相采集时间13~18 s。
1.3 图像观察
由两位有经验的腹部放射科医师盲法阅片,判断急性胰腺炎有无坏死,并进行磁共振严重程度指数(MR severity index, MRSI)评分,对判断有分歧的病例,协商解决,最后达成一致。MRSI评分参照Balthazar标准(表1)[6]。按照MRSI分值,将急性胰腺炎分为轻、中、重度:0~3分为轻度,4~6分为中度,7~10分为重度胰腺炎[7]。

表1 急性胰腺炎磁共振严重指数评分系统
在MRI上判断胰腺组织坏死的标准为:平扫表现为边界清晰的异常信号区(相对于正常胰腺组织),并且增强扫描表现为与之相对应的无强化区域[8,9]。
1.4 肝功能指标观察
入院后24小时内采集空腹静脉血,应用全自动生化分析仪(Backman CX800)测定血清肝功能指标。选取反映肝功能受损的主要指标:丙氨酸氨基转移酶(alanine aminotransferase, ALT)和血清天冬氨酸氨基转移酶(aspartate aminotransferase, AST)进行分析,ALT或AST指标升高(ALT>40 U/L,AST>40 U/L )认为肝功能指标异常[10,11]。
1.5 统计学处理
计算水肿型、坏死型AP以及轻、中、重度AP各组的ALT、AST异常发生率,用卡方检验或Fisher确切概率法进行检验水肿型和坏死型之间,以及轻、中、重度两两之间ALT、AST异常发生率的差异,P<0.05具有统计学意义。
2 结果
2.1 AP严重程度MRI评价
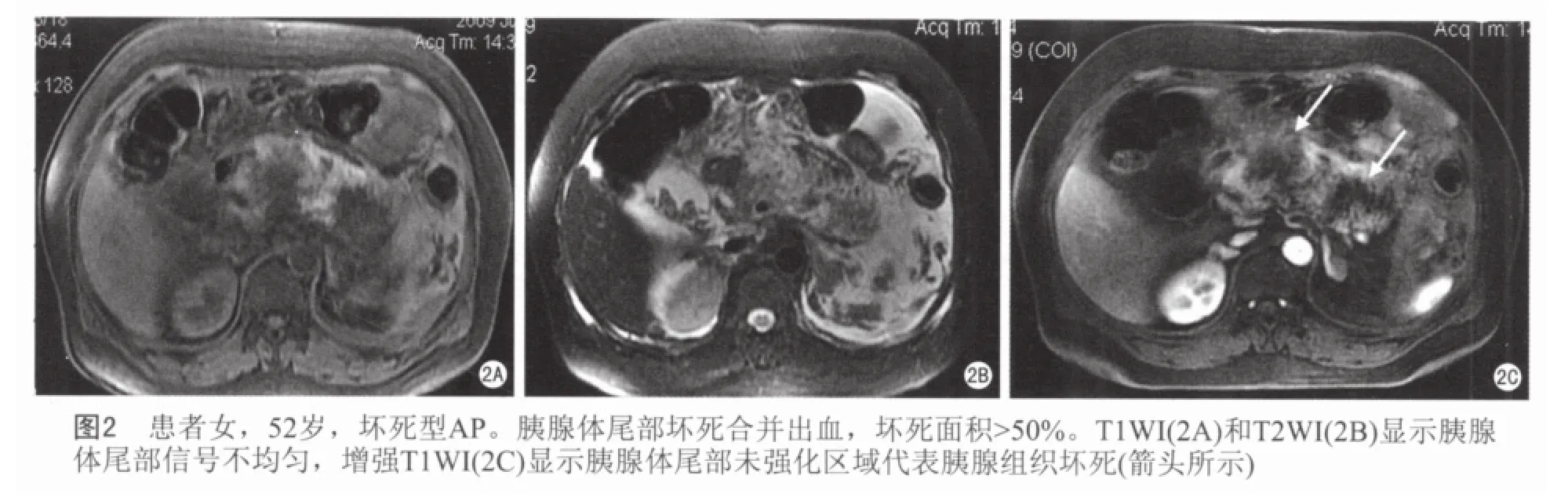
在64例AP病例中,56例为水肿型,8例为坏死型。在8例坏死型AP中,6例胰腺组织坏死面积<30%(图1),1例在30%~50%之间,1例>50%(图2)。43例(67.2%)为轻度AP,19例(29.7%)为中度AP,2例(3.1%)为重度AP。
2.2 AP的严重程度与肝功能损害的相关性
在56例水肿型AP中,34例(60.7%)发现ALT或AST异常升高,其中ALT升高为31例(55.4%),AST升高为34例(60.7%)。8例坏死型AP都出现ALT、AST升高(100%)。坏死型AP肝功能指标ALT、AST升高发生率高于水肿型AP,差异具有统计学意义(分别为P=0.014,P=0.027)。
在43例轻度AP中,23例(53.5%)发现ALT或AST升高,其中ALT升高为21例(48.8%),AST升高为23例(53.5%);在19例中度急性胰腺炎中,15例(78.9%)发现ALT或AST升高,其中ALT升高为14例(73.7%),AST升高为15例(78.9%);2例重度AP均有ALT、AST升高(100%)。虽然肝功能指标ALT、AST升高发生率在重度AP最高,其次为中度AP,轻度AP最低,但是经统计学处理,ALT、AST升高发生率在轻度与中度(P=0.069>0.05, P=0.058>0.05)、中度与重度(P=0.571>0.05, P=0.648>0.05)、轻度与重度(P=0.256>0.05, P=0.303>0.05)之间差异无统计学意义。
3 讨论

AP肝脏损害发病机制较复杂,病因众多。AP肝脏损害主要病理学特征为散在的肝细胞变性、坏死[2]。肝脏是胰腺血液回流的第一站,AP释放大量的炎性因子和酶对肝脏的损害发生一定的作用,Chen[12]等实验表明胰酶可能通过影响肝脏的微循环而对肝脏功能产生影响。此外,一些导致胰腺炎的病因本身对肝脏也有损害作用[13]。
肝脏是含酶丰富的器官,当肝脏发生病变,可引起血清酶活性的改变。常规生化检查通常测定血清中的ALT、AST及其他肝酶来判断肝脏病情,其中ALT、AST是临床中应用最广泛的反应肝脏损害的指标[10,11]。ALT主要存在肝细胞胞浆内,而AST主要存在肝细胞线粒体内,只有少数存在肝细胞胞浆内。当肝细胞变性、细胞膜通透性增加时,从细胞内主要溢出的是ALT;当肝细胞严重变性、坏死时,线粒体内AST便释放出来。因此,在本次研究中,我们只选取ALT、AST指标来进行分析。
AP严重程度与肝脏损害发生率及肝细胞的受损程度呈正相关性[3],因此,AP严重程度的判断对肝脏损害的发生具有预测作用。AP严重程度的判断包括CT、MRI、APACHE以及Ranson等评分系统[4,5,14]。影像学方法在AP严重程度及其预后的判断发挥着重要的作用,CT曾被认为是判断AP严重程度的金标准,但是,CT具有辐射性以及碘离子对比剂可能加重AP的病情。相对于CT,MRI具有无辐射、优越的软组织分辨力、MR对比剂几乎无不良反应,以及对轻度AP的评估较CT敏感的优点[4,5]。因此,MRI在AP严重程度及其预后的判断应用越来越广泛。
在本研究中,我们用MRI对64例AP分别按照传统病理标准(水肿型、坏死型)和Balthalzar评分标准(MRSI)进行严重程度的判断,并与反映肝功能受损的指标ALT、AST进行相关性分析。以传统病理标准,笔者发现坏死型AP ALT、AST升高发生率均显著高于水肿型AP。因此,笔者认为坏死型AP发生肝脏损伤的可能性最大。
按照MRSI评分标准,笔者发现重度AP(MRSI:7~10分)ALT、AST升高发生率为100%,高于中度AP(MRSI:4~6分)73.7%(ALT)、78.9%(AST)的升高发生率和轻度AP(MRSI:0~3分)48.8%(ALT)、53.5%(AST)的升高发生率。虽然MRSI分值越大,ALT、AST升高发生率越高,但是,轻、中、重度AP之间ALT、AST升高发生率差异无统计学意义。因此,以MRSI评分标准,将AP分为轻、中、重度尚不能预测AP发生肝脏功能受损。事实上,多数国内外学者认为MRSI评分可以作为预测AP发生局部并发症的指标,而不能作为预测AP发生系统并发症的指标[15]。我们的研究结果与文献报道一致。
AP发生肝功能异常临床较为多见,不仅可加重患者病情,而且能直接影响预后。通过MRI对AP严重程度进行评价,可以在一定程度上预测AP发生肝脏受损。
[1]Jaffray C, Yang J, Norman J.Elastase mimics pancreatitisinduced hepatic injury via inflammatory mediators.J Surg Res, 2000, 90(2): 95-101.
[2]Isogai M, Yamaguchi A, Hori A, et al. Hepatic histopathological changes in biliary pancreatitis.Am J Gastroenterol, 1995, 90(3): 449-454.
[3]Armbruster C, Kriwanek S.Multicentre audit of death from acute pancreatitis.Br J Surg, 1994, 81(6): 890-893.
[4]Arvanitakis M, Koustiani G, Gantzarou A, et al.Staging of severity and prognosis of acute pancreatitis by computed tomography and magnetic resonance imaging a comparative study.Dig Liver Dis, 2007, 39(5): 473-482.
[5]Kim YK, Ko SW, Kim CS, et al.Effectiveness of MR imaging for diagnosing the mild forms of acute pancreatitis: comparison with MDCT.J Magn Reson Imaging, 2006, 24(6): 1342-1349.
[6]Balthazar EJ, Robinson DL, Megibow AJ, et al.Acute pancreatitis: value of CT in establishing prognosis.Radiology, 1990, 174(2): 331-336.
[7]Vriens PW, van de Linde P, Slotema ET, et al.Computed tomography severity index is an early prognostic tool for acute pancreatitis.J Am Coll Surg, 2005, 201(4): 497-502.
[8]Viremouneix L, Monneuse O, Gautier G, et al.Prospective evaluation of nonenhanced MR imaging in acute pancreatitis.J Magn Reson Imaging, 2007, 26(2): 331-338.
[9]Stimac D, Miletic D, Radic M, et al.The role of nonenhanced magnetic resonance imaging in the early assessment of acute pancreatitis.Am J Gastroenterol,2007, 102(5): 997-1004.
[10]Dholakia K, Pitchumoni CS, Agarwal N.How often are liver function tests normal in acute biliary pancreatitis? J Clin Gastroenterol, 2004, 38(1): 81-83.
[11]孙志强,毛远丽.肝病酶学指标及临床应用进展.中华医学检验杂志,2005,28(6):659-662.Sun ZQ, Mao YL.Liver function enzyme index and its clinical application.Chin J Lab Med, 2005, 28(6): 659-662.
[12]Chen HM, Hwang TL, Chen MF.The effect of gabexate mesilate on pancreatic and hepatic m icrocirculation inacute pancreatitis in rats.J Surg Res, 1996, 66 (2): 147-153.
[13]Cohen ME, Slezak L, Wells CK, et al.Prediction of bile duct stones and complications in gallstone pancreatitis using early laboratory trends.Am J Gastroenterol, 2001,96(12): 3305-3311.
[14]Taylor SL, Morgan DL, Denson KD, et al.A comparison of the Ranson, Glasgow, and APACHE II scoring systems to a multiple organ system score in predicting patient outcome in pancreatitis.Am J Surg, 2005, 189(2): 219-222.
[15]Arvanitakis M, Delhaye M, De Maertelaere V, et al.Computed tomography and magnetic resonance imaging in the assessment of acute pancreatitis.Gastroenterology,2004, 126(3): 715-723.
