鸢尾属药用植物总DNA提取方法的比较研究
2010-09-18肖婷婷叶波平金国虔秦民坚
肖婷婷,朱 艳,叶波平,金国虔,秦民坚*
(1.中国药科大学中药资源学研究室,江苏南京211198;2.教育部现代中药研究重点实验室,江苏南京,210009;3.中国药科大学生命科学与技术学院,江苏 南京,210009)
鸢尾属药用植物总DNA提取方法的比较研究
肖婷婷1,2,朱 艳1,2,叶波平3,金国虔1,2,秦民坚1,2*
(1.中国药科大学中药资源学研究室,江苏南京211198;2.教育部现代中药研究重点实验室,江苏南京,210009;3.中国药科大学生命科学与技术学院,江苏 南京,210009)
以鸢尾属(Iris L.)药用植物鸢尾Iris tectorum Maxim.叶片为材料,分别采用CTAB法、高盐低pH法、SDS法和试剂盒法四种方法提取植物总DNA,并通过琼脂糖凝胶电泳、紫外分光光度计、ISSR和RAPD四种方法对所提取的DNA样品进行检测。结果表明,用SDS-Ⅰ法提取的植物总DNA纯度、浓度和完整性都很高,从经济角度考虑优于用试剂盒提取,从提取效果考虑不亚于用CTAB法和高盐低pH法提取,是比较适合鸢尾属植物总DNA提取的方法。
鸢尾属;鸢尾;DNA提取;方法
鸢尾属(Iris L.)是鸢尾科(Iridaceae)中最大的一个属,全世界约有250余种,我国约产60个种、13个变种及5个变型,主要分布于西北、西南及东北等地[1]。鸢尾属植物因其大多具有既可观花又可观叶的价值而被广泛用于切花、盆栽及园林绿化等。鸢尾属植物还具有重要的药用价值,如鸢尾和射干是常用的中药,其内所含的主要化学成分均为黄酮类化合物,具有良好的清热解毒、利咽消痰、消积、泻下等作用。中国有较丰富的鸢尾属野生资源,而野生资源往往蕴藏着更为丰富优良的基因,是品种改良及种质创新等重要的基因来源。但由于品质繁多且在形态上比较相似,极易混淆和误用,从而影响了药材的质量和效果。因此建立一种科学、可靠、方便的鉴定方法成了当务之急。随着分子生物学技术的发展,DNA分子标记技术不仅在农业上对植物选种、育种和改良等方面的应用稳步增长,而且在中药资源、鉴定、栽培等方面也有着很好的发展前景。其中,如何有效地提取高质量的植物DNA已成为药用植物种质资源研究的一个重要方面。植物DNA的有效提取,它是进行任何分子生物学工作的前提和基础,也是最关键的一步[2]。鸢尾属药用植物总DNA提取方法的比较研究在国内外未有相关报道,本文就如何提取高质量的植物总DNA为目的,主要探索鸢尾属植物总DNA的提取方法,为进一步展开鸢尾属药用植物种质资源方面的研究奠定基础。
1 材料和方法
1.1 实验材料与试剂
试验材料选用鸢尾属植物鸢尾(Iris tectorum Maxim.),采自中国药科大学药用植物园,经作者鉴定,秦民坚教授复核。
DNA提取缓冲液的配制:提取缓冲液A:称取NaCl 2.92 g,PVP 2 g,SDS 1.4 g,无水醋酸钠 0.82 g,溶于 60 mL dd H2O 中,加 0.5 mol/L EDTA 10 mL,用冰醋酸调pH值至5.51,加 dd H2O定容至100 mL。
提取缓冲液 B:取1 mol/L Tris-HCl 2.5 mL,0.5 mol/L EDTA 10 mL,10%SDS 5mL,加 dd H2O定容至100 mL。
提取缓冲液 C:称取 CTAB 2 g,PVP 1 g,NaCl 8.182 g,加入 70 mL dd H2O,加热溶解,再加入1 mol/L Tris-HCl 10 mL,0.5 mol/L EDTA 4 mL,然后加dd H2O定容至100 mL。
提取缓冲液D:称取NaCl 8.182 g,加入1 mol/L Tris-HCl 10 mL,0.5 mol/L EDTA 4 mL,然后加 dd H2O定容至100 mL。(用前加2%CTAB 2 g,2%PVP 2 g)
PCR分析用Taq DNA聚合酶,dNTPs和引物均购自上海生物技术有限公司,所用仪器为PE-9600 PCR扩增仪。
1.2 实验方法
各提取缓冲液用前均加入0.2% β-巯基乙醇。
在装有材料的每管离心管中加入65℃ 预热的1~1.5 mL的提取缓冲液,于65℃水浴中保温。用CTAB提取液提取的保温1 h,用SDS或高盐低pH提取液提取的保温30~60 min,保温期间不时摇动。然后,以下述方法分别进行提取。
1.2.1 高盐低pH法[3]
采用提取缓冲液A进行提取。然后10000 r/min离心10 min,取上清液加入2/3体积2.5 mol/L KAc(pH 4.8),-20℃放置30 min后,10000 r/min离心10 min,取上清液加入等体积的氯仿∶异戊醇(24∶1),10000 r/min 离心 10 min,反复抽提至中间层无白色沉淀。上清液加入等体积的异丙醇,置-20℃过夜。15000 r/min离心15 min,沉淀用75%乙醇洗两次,吹干后加适量TE溶解,-20℃保存。
1.2.2 SDS法
采用提取缓冲液B进行提取。8000 r/min离心5 min。分别以下述两种方法进行提取。
①上清液加入1/10体积的5 mol/L KAc,混匀后-20℃放置30 min,13000 r/min离心15 min,上清液加入2/3体积的异丙醇,置 -20℃过夜。12000 r/min离心10 min,沉淀用75%乙醇洗两次,吹干后加适量TE溶解,-20℃保存。
②上清液加入等体积的氯仿∶异戊醇(24∶1),10000 r/min离心10 min,反复抽提至中间层无白色沉淀。上清液加入2/3体积的异丙醇,置-20℃过夜。12000 r/min离心10 min,沉淀用75%乙醇洗两次,吹干后加适量TE溶解,-20℃保存。
1.2.3 CTAB法
分别采用提取缓冲液C,提取缓冲液D进行提取。
上清液加入等体积的氯仿∶异戊醇(24∶1),10000 r/min离心10 min,反复抽提至中间层无白色沉淀。上清液加入2/3体积的异丙醇,置-20℃过夜(或采用加入1/10体积3 mol/L NaAc和2倍体积无水乙醇沉淀DNA过夜)。12000 r/min离心10 min,沉淀用75%乙醇洗2次,吹干后加适量TE溶解,-20℃ 保存。
1.2.4 试剂盒法
采用AXYGEN AxyPrep基因组DNA小量制备试剂盒按说明书操作步骤进行提取DNA。
2 结果与分析
2.1 电泳检测
以上各方法得到的DNA取3~5 μL于1%琼脂糖凝胶电泳,电压80V,电泳40 min左右,在凝胶成像系统下检测DNA条带情况。

图1 1%琼脂糖凝胶电泳检测DNA样品M:λ -Hind Ⅲ Digest;1,2:试剂盒法

图2 1%琼脂糖凝胶电泳检测DNA样品M:λ-HindⅢ Digest;1-4:CTAB法

图3 1%琼脂糖凝胶电泳检测DNA样品M:λ -HindⅢ Digest;1,2:高盐低 pH 法;3-5:SDS-Ⅰ法

图4 1%琼脂糖凝胶电泳检测DNA样品M:λ-HindⅢ Digest;1-3:SDS-Ⅰ法;4-9:SDS-Ⅱ法
从提取所得到的DNA外观上看,用高盐低pH法和CTAB法所得到的DNA均为乳白色,吹干后呈透明状,而用SDS法所得到的DNA少数略带褐色,大多数也为乳白色。从DNA电泳检测结果看,如图1-4,由试剂盒法、高盐低 pH法、SDS-Ⅰ法和CTAB法得到的DNA条带清晰无拖尾,表明所提的DNA纯度和完整性都很好,由SDS-Ⅱ法得到的DNA条带颜色暗淡且略有拖尾,点样孔处略有发亮,表明所提的DNA纯度和完整性与其他几种方法所提的DNA相比较差。
2.2 DNA纯度检测
取10 μL DNA溶液稀释100倍后,用紫外分光光度计分别测定波长230 nm、260 nm及280 nm的光吸收值。计算A260/280、A260/230的比值。当2>A260/280≥1.8,A260/230≥2,表明 DNA 为纯,此时DNA中蛋白质、酚类及色素、RNA等杂质含量较少,DNA质量符合要求。部分结果见表1,可知,由试剂盒法、高盐低pH法、SDS-Ⅰ法和CTAB法得到的DNA质量都很好,其中,试剂盒法的A260/280约为1.80,说明DNA很纯,几乎没有其他杂质的污染,SDS-Ⅰ法和CTAB法(用提取缓冲液D):1.9>A260/280≥1.8,说明DNA也较纯,DNA中蛋白质、酚类及色素、RNA等杂质含量较少,高盐低pH法和CTAB法(用提取缓冲液C)的A260/280>1.9,说明有少量RNA污染,SDS-Ⅱ法得到的DNA质量较差,A260/280<1.6,说明有蛋白质或酚污染,其A260/230<2,说明有残存的盐和小分子杂质[4]。
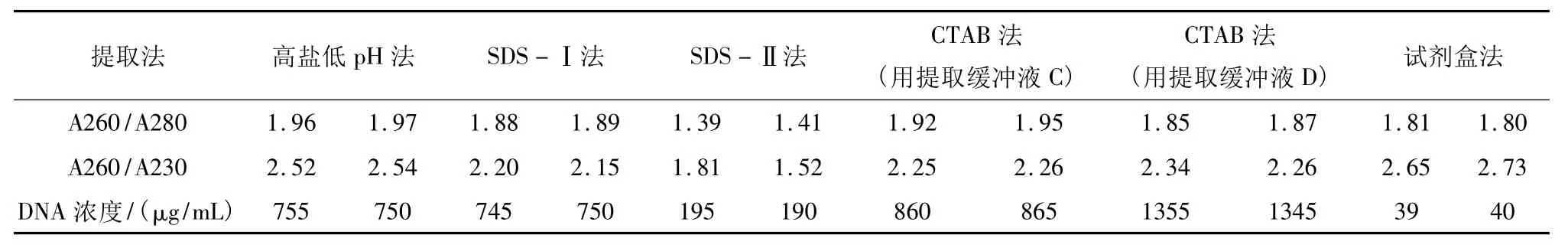
表1 6种提取方法所得DNA样品的纯度
2.3 PCR扩增反应检测
将不同提取方法提取出来的DNA进行PCR扩增反应。
2.3.1 ISSR反应
ISSR反应引物:(AG)8TT。ISSR扩增反应总体积为 20 μL,其中包括 1U Taq DNA聚合酶,2.0 μL 10 × PCR buffer,1.6μL 25 mmol· L-1MgCl2,0.5 μL 10 mmol·L-1dNTPs,0.6μL 10mmol·L-1引物和40 ng DNA模板。PCR反应程序为:94℃ 预变性3 min;然后进行40个循环反应,反应条件为94℃变性45 s,56℃ ~60℃退火30 s,72℃延伸1.5 min;最后于72℃延伸5 min。
2.3.2 RAPD反应
RAPD反应引物:GACCGCTTGT。RAPD扩增反应总体积为20 μL,其中包括1U Taq DNA聚合酶,2.0 μL 10 × PCR buffer,1.6μL 25 mmol·L-1MgCl2,0.5 μL 10 mmol·L-1dNTPs,1 μL 4 mmol·L-1引物和20 ng DNA模板。PCR反应程序为:94℃ 预变性5 min;然后进行40个循环反应,反应条件为94℃变性1 min,38℃退火1 min,72℃延伸2 min;最后于72℃延伸7 min。
ISSR和RAPD扩增产物均4℃保存备用。RAPD和ISSR扩增产物分别在1%琼脂糖电泳,结果如图5,6。由图可以看出,由试剂盒法、高盐低pH法、SDS-Ⅰ法和CTAB法得到的DNA能很好的进行扩增反应,扩增条带清晰且没有缺失,而由SDS-Ⅱ法得到的DNA进行扩增反应时会出现条带扩增不稳定,会出现条带的缺失,说明DNA本身的质量不好,受其他杂质的污染严重。

图5 1%琼脂糖凝胶电泳检测以样品DNA为模板进行ISSR反应的产物1,7,8,9:SDS - Ⅱ法;2:CTAB 法;3:高盐低 pH 法;4,5:SDS - Ⅰ法;6:试剂盒法

图6 1%琼脂糖凝胶电泳检测以样品DNA为模板进行RAPD反应的产物1,6,7:SDS - Ⅱ法;2:试剂盒法;3:CTAB 法;4:高盐低 pH 法;5:SDS-Ⅰ法
3 讨论
CTAB是一种阳离子去污剂,既能有效裂解植物细胞壁,又能去除多糖类物质,对于含糖较高的材料可优先采用,改良后效果更佳。一般来说,CTAB缓冲液比较适合草本植物和不含酚类或含酚类较少的植物DNA提取。但对木本植物和酚类含量丰富的植物,适当提高CTAB的浓度也可以得到质量较高的 DNA[5]。CTAB法对许多新鲜植物基因组DNA的提取是较为适用的,但对于干品中药材的DNA的提取纯度不高[6]。SDS缓冲液在植物基因组DNA的提取应用中较少,主要应用于对模板DNA质量要求不太严的RAPD分析[7],本身多糖含量不高的材料或其含量不致影响后续实验分析的样品[8]。但有时SDS缓冲液或经过改进的SDS缓冲液的处理效果等同于或更甚于CTAB的处理效果[9-12]。高盐低pH值法中的提取介质能有效防止组织破碎及沉淀大量材料时电离化作用及酚化合物进一步氧化[13],所得的DNA纯度高,无须进一步纯化,可直接进行后续反应(如PCR扩增)。鸢尾属叶片主要含黄酮类物质,含较少的酚类及多糖类物质,对比图1可看出,由试剂盒法、高盐低pH法、SDS-Ⅰ法和CTAB法得到的DNA纯度和完整性都很好,SDS-Ⅱ法得到的DNA纯度和完整性较差。
CTAB提取缓冲液中PVP的含量会影响DNA的提取效果。PVP是酚的络合物,能与多酚形成一种不溶的络合物质,能有效的去除多酚,减少DNA中酚的污染,同时也能和多糖结合,有效去除多糖。由图5和表1可以看出,含2%PVP比1%PVP的提取缓冲液提取所得到的DNA更纯,浓度更高。

图7 1%琼脂糖凝胶电泳检测DNA样品M:λ-HindⅢ Digest;1,2:CTAB法(用提取缓冲液C);3-5:CTAB法(用提取缓冲液D)
用异丙醇沉淀DNA过夜与用加入1/10体积3 mol/L NaAc和2倍体积无水乙醇沉淀DNA过夜效果相当(如图7中,1和2做比较,4和5做比较),且所用试剂量少,种类少,减少试剂和操作步骤不必要的污染,减少损失DNA,有利于提高DNA的得率和DNA的纯度。
本实验没有加入RNase去除RNA,也没有进行DNA的浓缩和纯化等步骤,但已经取得了纯度、完整性和浓度都较高的DNA,如果有需要更高质量的DNA,建议可以用RNase消化RNA,使用有机溶剂抽提或氯化铯梯度离心等方法进一步纯化DNA[14]。
DNA提取过程中,影响提取效果的因素很多,如叶片研磨的充分与否、吸取上清液时有无吸出蛋白层,DNA溶液暴露于空气中被氧化的程度以及旋转速度等。本实验用液氮研磨叶片时,粉末研得越细越好,且转移入离心管保存时应迅速,以免造成DNA的降解。用氯仿∶异戊醇(24∶1)进行抽提离心后,在转移含有DNA的上清液时均采用剪去端部的吸头,减少吸头吸取时的剪切力,能有效避免吸入中间层的白色沉淀及减少DNA受到的机械损伤,保证了DNA的纯度及完整性。用氯仿∶异戊醇(24∶1)进行抽提时,在离心前增加氯仿∶异戊醇(24∶1)和提取缓冲液的接触时间,能让杂质更好地被分离,减少用氯仿∶异戊醇(24∶1)的抽提次数,因为在抽提的操作中抽提次数的重复并不一定改善DNA的纯度,有时负面作用反而增加[15],从而能有效地避免操作过程中DNA的污染。本实验的结果是在尽量使得各影响因素最下的情况下取得的,因此,要想获得纯度高、质量好的DNA,除了提取方法上的选择之外,还需要操作技术上的严格。
综上所述,由高盐低pH法和CTAB法得到的DNA纯度高,含量多,适用于大多数材料DNA的提取,但比较费时,操作步骤繁琐且使用有机溶剂,有损于操作者的健康。试剂盒法适用于多个样品同时操作,快速、准确、方便,无需酚、氯仿或SDS抽提且不含PCR反应抑制药及其他酶反应抑制药,可被各种限制性内切酶完全降解[2],提取得到的DNA纯度也高,但价格昂贵,适用于微量或珍贵稀有材料DNA的提取。醋酸钾是有效的蛋白质沉淀剂,比起用氯仿:异戊醇分层反复抽提去蛋白质,操作方便、省时,从经济角度和提取效果考虑,SDS-Ⅰ法所需的试剂只是无机盐和异丙醇,不需要使用氯仿∶异戊醇(24∶1)反复抽提,操作简单、温和,省时省力也避免了DNA不必要的污染或损失,相比较CTAB法试剂的昂贵和有毒性及高盐低pH值法试剂的有毒性,SDS-Ⅰ法有明显的优势,比较适用于鸢尾属植物总DNA提取。
[1] 赵毓堂.中国植物志[M].北京:科学出版社,1985:133-197.
[2] 刘塔斯,林丽美,龚力民,等.分子标记中植物DNA提取方法的研究进展[J].Central South Pharmacy,2005,3(6):370 -373.
[3] 张 英,柏干荣,黄明辉,等.植物基因组DNA提取方法学评析与验证[J].Drug evaluation,2004,1(4):292 -297.
[4] 陈明媚.鲜切果蔗生理生化特性及贮藏保鲜技术研究[D].南宁:广西师范大学,2005.
[5] 黄晓丹,张云贵,应铁进.高质量植物基因组DNA的提取[J]. 植物生理学通讯,2006,42(2):311 -314.
[6] 曹 晖,毕培曦,邵鹏柱,等.中药材苦地胆的DNA指纹鉴定[J].中药材,1996(12):610.
[7] 陶 玲,刘志学,何兴东,等.用于RAPD分析的沙拐枣DNA提取方法[J].中国沙漠,2001,9:300-302.
[8] 邹喻萍,汪小全,雷一丁,等.几种濒危植物及其近缘类群总DNA的提取与鉴定[J].植物学报,1994,36(7):529-532.
[9] 巩艳红,刘 军.毛豹皮樟叶总DNA的提取[J].四川林业科技,2003,6:47-50.
[10] 丁晓东,吕柳新.从顽拗植物荔枝中提取基因组DNA技术的研究[J].应用与环境生物学报,2003,6(2):142-145.
[11] 郭安平,周 鹏,彭世清,等.苎麻属植物RAPD反应体系影响因子的研究[J].热带作物学报,2001,9:64-69.
[12] 李 晶,沙 伟,曹 同.苔藓植物总DNA提取方法和条件的研究[J].齐齐哈尔大学学报,2003,9:1-5.
[13] 邹喻苹,汪小全,雷一丁,等.几种濒危植物及其近缘类群总DNA的提取与鉴定[J].植物学报,1994(7):529.
[14] 马 轩,杜雄明.提取棉花基因组DNA的一点探讨[J].棉花学报,2004,16(1):40-43.
[15] 李树华,何 军,杨淑琴,等.野生稻、野燕麦、枸杞DNA的提取方法[J].干旱地区农业研究,2005,23(3):166-168.
Comparison of Methods of DNA Extraction from Iris L.
Xiao Tingting1,2,Zhu Yan1,2,Ye Boping3,Jin Guoqian1,2,Qin Minjian1,2
(1.Department of Resources Science of Traditional Chinese Medicines,China Pharmaceutical University,Nanjing 211198,China;2.Key Laboratory of Modern Traditional Chinese Medicines of Ministry of Education,China Pharmaceutical University,Nanjing 210009,China;3.College of Life Science and Technology,China Pharmaceutical University,Nanjing 210009,China)
Using the leaves of Iris L.as test material,the effects of DNA extraction were comparatively analyzed among the CTAB method,high salt method,SDS method and DNA Minprep kit method by means of agarose gel electrophoresis,UV,ISSR and RAPD.The experiment results showed that the SDS-Ⅰmethod was the best DNA extraction for Iris L..
Iris L.;Iris tectorum Maxim.;DNA extraction;Method
Q523
A
1006-9690(2010)03-0046-05
10.3969/j.issn.1006- 9690.2010.03.011
2009-10-18
国家科技基础条件平台工作项目(2005DKA21004)
肖婷婷(1984-),女,研究生,主要从事药用植物种质资源及其质量评价的研究。
* 通讯作者。E-mail:minjianqin@163.com
