针药结合对乳腺增生大鼠血清及乳腺VEGF、bFGF含量的影响
2010-09-17段彦苍杜惠兰靳亚慈
段彦苍, 杜惠兰, 靳亚慈
(河北医科大学中西医结合学院,河北石家庄050091)
乳腺增生病隶属于中医学的“乳中结核”、“乳疬”等范畴。乳腺增生病在病理方面除了表现在上皮细胞、间质细胞、腺泡、导管等组织的增生外,亦存在着血管的增生[1]。目前血管内皮生长因子(VEGF)和碱性成纤维细胞生成因子(bFGF)被认为是乳腺癌特异性最强的两种血管因子。我们推测乳腺增生中血管的生成可能与VEGF和bFGF密切相关。因此我们采用肌注外源性激素的方法复制乳腺增生大鼠模型,应用放免和免疫组织化学技术探讨乳腺增生病变与血清、乳腺VEGF和bFGF的关系以及针药协同作用对血清、乳腺VEGF和bFGF的调节治疗机制。
材料和方法
1 动物
选用健康清洁级♀性Wistar大鼠60只,75~85日龄,体重(220±20)g,由河北医科大学试验动物中心提供,合格证号:602089。
2 药物和试验试剂
试验所用中药(柴胡、郁金、赤芍、白芍、川楝子、丹参、丹皮、橘核、王不留行、夏枯草、牡蛎、荔枝核、山慈菇)采用传统的煎煮方法,过滤,离心,浓缩制成水煎液,每毫升约含生药2.75 g,密封分装,4℃放置备用。
苯甲酸雌二醇注射液、黄体酮注射液均由天津金耀氨基酸有限公司生产。枸橼酸他莫昔芬由上海医药集团有限公司华联制药厂生产。
VEGF和bFGF酶联免疫试剂盒,购于美国R-D公司。E2、P放免试剂盒购于美国DSL公司。PRL放免试剂盒购于天津九鼎医学生物工程有限公司。
3 试验方法
3.1 动物分组
综上所述,Hp阴性萎缩性胃炎患者应用替普瑞酮治疗的临床效果更加显著,不仅可以减轻胃黏膜病变程度,改善临床症状,还可以减少不良反应的发生。
大鼠适应性喂养2周后,按随机数字表法将其分为6组,每组10只:即正常组、模型组、模型+针刺组(简称“针刺组”)、模型+中药组(简称“中药组”)、模型+针刺+中药组(简称“针药组”)、模型+TAM阳性对照组(简称“对照组”)。
3.2 复制模型
除正常组大鼠常规喂养外,其余组参照张璐[2]等造模方法,大鼠腹腔注射苯甲酸雌二醇0.5 mg/(kg/d),连续25 d,然后注射黄体酮5 mg/(kg/d),连续5 d,建立大鼠乳腺增生模型。
3.3 治疗方法
从第31天开始,各组分别治疗。针刺组:根据《中国兽医针灸学》结合人体穴位,选取屋翳、合谷、膻中、足三里,每日1次,9次为一疗程,疗程间休息1 d,共30 d。中药组:按25g/(kg/d)灌服中药,30 d。针药组:针刺操作同针刺组,同时灌服中药,剂量同中药组,30 d。对照组:TAM 1.9 mg/(kg/d),相当于临床等效剂量,30 d。正常组和模型组灌服同体积蒸馏水,30 d。
4 标本制备和检测方法
末次治疗5 h后,用游标卡尺测量第2对乳房的直径。断头取血,制备血清,置-70℃保存,用放射免疫法测定血清E2、P和PRL含量,酶联免疫法测定血清VEGF和bFGF含量。切取第2对乳房,甲醛固定,常规石蜡包埋切片(4 μm),免疫组织化学染色(按ABC试剂盒操作指南进行)。
美国IPP(Image-proplus)分析软件对免疫组化染色切片进行图像分析,每个切片采集5个视野,得出度量物质含量信息的灰度等级,将所得灰度值取平均数作为统计指标。平均灰度与阳性表达强弱成反比,灰度值越小,阳性染色越强,蛋白表达越多。
所有数据用均数±标准差表示。用SPSS12.0统计软件进行统计处理,对所测定结果进行正态性及方差齐性检验,组间比较用单因素方差分析,检验以P<0.05为有统计学意义。
结果
1 大鼠乳头直径的变化(见表1)
乳腺增生模型组大鼠的乳头竖起,较坚实,充血,增高2~3 mm。正常组的乳头形态与试验开始时一样,隔毛看不见乳头位置,将毛分开后,仅见乳头呈小米样,紧贴在皮肤上,苍白、柔软、个别稍隆起1 mm左右。针刺组、中药组、对照组和针药组乳头直径均减小,其中对照组和针药组乳头直径明显减小,与模型组相比有显著性差异。
表1 各组大鼠乳头的直径变化比较(±s)
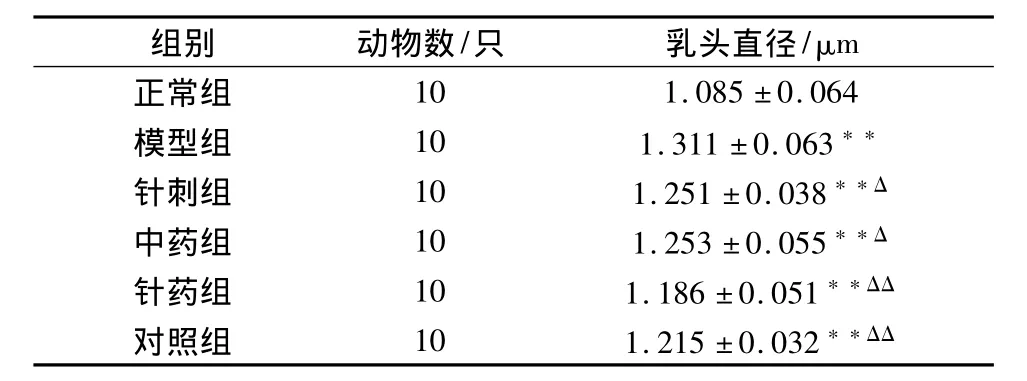
表1 各组大鼠乳头的直径变化比较(±s)
注:与正常组比较*P<0.05,**P<0.01;与模型组比较ΔP<0.05,ΔΔP<0.01。
组别 动物数/只 乳头直径/μm正常组10 1.085±0.064模型组 10 1.311±0.063**针刺组 10 1.251±0.038**Δ中药组 10 1.253±0.055**Δ针药组 10 1.186±0.051**ΔΔ对照组 10 1.215±0.032**ΔΔ
2 血清生殖激素变化(见表2)
治疗后与模型组相比,针刺组和中药组大鼠血清E2水平降低(P<0.05),针药组和对照组大鼠血清E2水平明显降低(P<0.01);针药组血清 PRL含量水平降低(P<0.05);针药组血清中P的含量升高(P<0.01),和正常组无统计学差异。
表2 各组大鼠血清E2、P、PRL变化比较(±s)
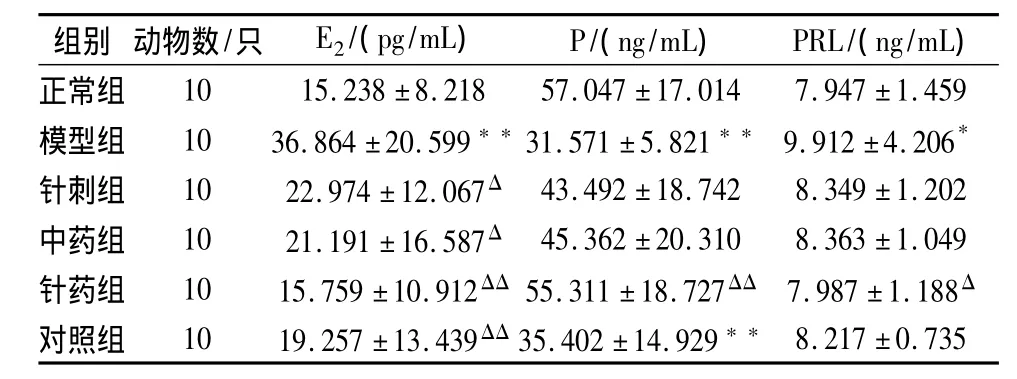
表2 各组大鼠血清E2、P、PRL变化比较(±s)
注:与正常组比较*P<0.05,**P<0.01;与模型组比较ΔP<0.05,ΔΔP<0.01。
组别 动物数/只 E2/(pg/mL) P/(ng/mL) PRL/(ng/mL)正常组10 15.238±8.218 57.047±17.014 7.947±1.459模型组 10 36.864±20.599**31.571±5.821** 9.912±4.206*针刺组 10 22.974±12.067Δ 43.492±18.742 8.349±1.202中药组 10 21.191±16.587Δ 45.362±20.310 8.363±1.049针药组 10 15.759±10.912ΔΔ 55.311±18.727ΔΔ 7.987±1.188Δ对照组 10 19.257±13.439ΔΔ35.402±14.929**8.217±0.735
3 血清VEGF、bFGF的变化(见表3)
与正常组相比,模型组大鼠血清中VEGF和bFGF的含量明显升高,其它组含量均降低,尤其针药组降低明显(P<0.01)。
表3 各组大鼠血清VEGF、bFGF的变化比较(±s)
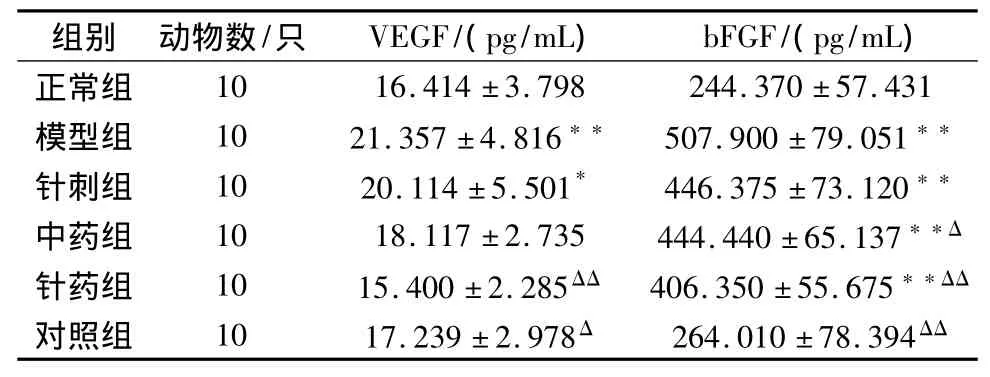
表3 各组大鼠血清VEGF、bFGF的变化比较(±s)
注:与正常组比较*P<0.05,**P<0.01;与模型组比较ΔP<0.05,ΔΔP<0.01。
组别 动物数/只 VEGF/(pg/mL) bFGF/(pg/mL)正常组10 16.414±3.798 244.370±57.431模型组 10 21.357±4.816** 507.900±79.051**针刺组 10 20.114±5.501* 446.375±73.120**中药组 10 18.117±2.735 444.440±65.137**Δ针药组 10 15.400±2.285ΔΔ 406.350±55.675**ΔΔ对照组 10 17.239±2.978Δ 264.010±78.394ΔΔ
4 乳腺组织VEGF、bFGF的表达
VEGF、bFGF的阳性表达定位于细胞浆内,为棕黄色染色。与正常组相比,模型组大鼠乳腺组织中VEGF、bFGF的表达增强(P<0.01)。治疗后,针刺组、中药组和针药组VEGF、bFGF的表达均明显低于模型组(均P<0.01);对照组与模型组比较有降低的趋势,但两组之间比较无统计学意义(P>0.05)。(表 4、图 1,2)
表4 各组大鼠VEGF、bFGF表达平均灰度比较(±s)

表4 各组大鼠VEGF、bFGF表达平均灰度比较(±s)
注:与正常组比较*P<0.05;**P<0.01;与模型组比较ΔP<0.05,ΔΔP<0.01。
组别 动物数/只VEGF bFGF正常组10 84.76±8.30 102.00±4.90模型组 10 62.89±8.05** 77.61±5.08**针刺组 10 71.09±6.28**ΔΔ 86.24±3.30**ΔΔ中药组 10 75.13±2.80**ΔΔ 87.29±5.24**ΔΔ针药组 10 88.25±6.57ΔΔ 100.05±8.42ΔΔ对照组 10 64.96±7.24** 80.45±4.95**
讨论
乳腺增生是女性常见病,多数学者认为乳腺增生病的发生与内分泌紊乱、卵巢功能失调造成体内长时间的P不足、E2绝对或相对增多有关。乳腺增生病被认为是乳腺癌癌前的一种良性病变,血管增生在乳腺肿瘤的生长过程中起到了重要作用。VEGF在健康成人组织中维持正常的血管密度和基本的渗透功能,以利于营养物质的运输,但表达水平极低,是机体内皮细胞特异性的分裂原和血管增生因子,对血管生成和血管通透性增加有重要的调节功能[3]。VEGF通过刺激血管新生促进肿瘤细胞的生长和转移,是目前所知的作用最强,选择性最高的内皮细胞丝裂原,是肿瘤血管生成过程中的重要调节因子[4]。VEGF及其受体通过旁分泌途径联合调控内皮细胞分化、血管生成[5];又通过自分泌调节功能协调其功能的完成。在血管形成的调控中,bFGF起着关键作用。bFGF能促进表皮、内皮细胞再生,促进血管内皮细胞分裂,诱导其从基膜中分离出来,以刺激内皮细胞向肿瘤组织趋化运动,并形成管状结构,还可提高组织中血纤维蛋白溶解酶原激活因子类(PAs),诱导内皮细胞产生其他蛋白酶,是血管形成较为直接的诱导物质。bFGF亦能通过自分泌和旁分泌形式促进肿瘤的生长与转移[6]。
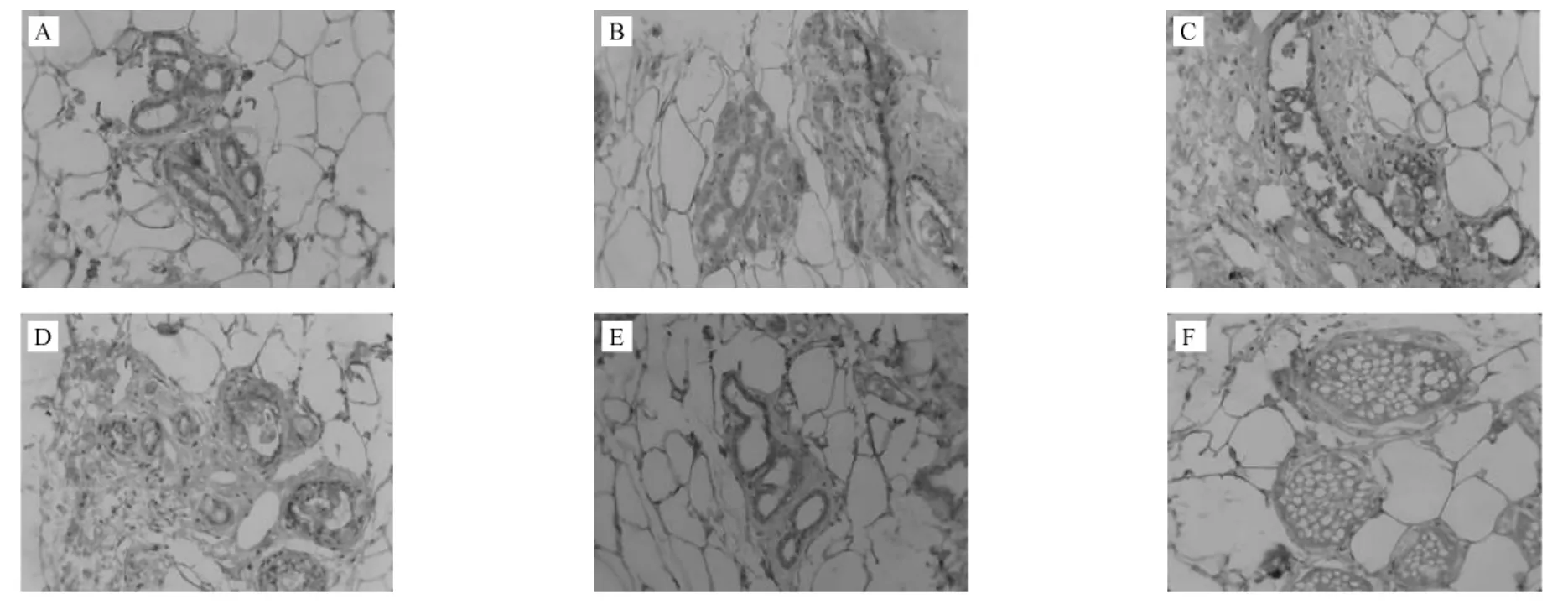
图1 VEGF在各组乳腺的表达(×200)
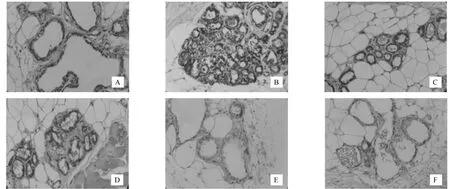
图2 bFGF在各组乳腺的表达(×200)
在乳腺增生模型大鼠的血清中,存在着VEGF和bFGF的高含量,在局部组织中存在着VEGF和bFGF的高表达,我们认为在乳腺增生模型大鼠中存在着血管增生,乳房局部已经存在微循环障碍。VEGF和bFGF可能通过一定的途径被激活后,通过某种共同的机制促使乳腺组织局部的增生。针药结合可能通过下调VEGF和bFGF,减少病变区域的血流信号,加快血流速度,以改善乳腺组织的微循环、改变乳腺组织的血管数目和形状,从而达到治疗目的。同时提示我们针药结合的治疗方法,与单纯服用中药、单纯应用针灸以及西药三苯氧胺(TAM)相比较,疗效显著,作用广泛。这为中医药干预治疗乳腺增生病提供了实验依据。
[1]刘胜春,吴凯南,历江元.血管生成在乳腺非典型增生及癌变过程中的作用[J].中国肿瘤临床,1998,23(6):421-424.
[2]张 璐,乌兰·格日乐,乔国芬,等.中药乳腺丸对鼠乳腺增生的影响[J].中国中西医结合外科杂志,2003,9(1):39-41.
[3]Kroll J,Waltenberger J.Regulation of the endothelial function and angiogenesis by vascular endothelial growth factor-A(VEGF-A)[J].Z Kardiol,2000;89(3):206-218.
[4]Ferra N.Vascular endothelial growth factor:molecular and biological aspects[J].Curr Top Microbiol Immunol,1999;237:1-30.
[5]Gerwins P,Sloidenberg E,Claesson W L.Function of fibroblast growth fact and VEGF and their receptors in angiogenesis[J].Crit Rev Oncol Hematol,2000;34(3):185-194.
[6]易文君,唐中华,杨竹林,等.青年和绝经女性乳腺癌VEGF、bFGF及其受体表达的差异[J].中华肿瘤杂志,2003,25(2):141-144.
