拉米夫定对慢性乙型肝炎患者外周血Th1/Th2细胞因子和肝纤维化指标的影响
2010-09-17钟水清楼克忻
钟水清,楼克忻
(浙江省松阳县人民医院感染科,浙江 丽水 323400)
目前研究认为,病毒和机体免疫状态是乙型肝炎病毒(HBV)感染人体后病情发展方向的决定因素,而Th应答类型与机体的免疫状态密切相关[1]。正常情况下Th1/Th2处于动态平衡中,Th1/Th2的不平衡激活可造成疾病的不同病理状态,Th1/Th2比例是否失衡是制约机体能否有效清除病毒和病毒感染细胞的主要因素之一[2],而干扰素-γ(IFN-γ)和白细胞介素-4(IL-4)是维持Th1/Th2细胞比例的关键分子。拉米夫定是一种能强烈抑制HBV复制的双脱氧核苷类药物,是目前广泛应用的抗HBV药物,Th1/Th2的平衡失调可能是拉米夫定长期应用易发生变异、停药后易发生反跳的原因[3]。本研究观察了拉米夫定对慢性乙型肝炎患者外周血Th1/Th2细胞因子、HBV-DNA含量及肝纤维化指标的影响,以探讨其治疗慢性乙型肝炎的疗效及作用机制,现报道如下。
1 资料与方法
1.1 一般资料
选择2008年1月至2009年6月在我院感染科门诊或住院治疗的轻中度慢性乙型肝炎患者50例作为治疗组,其中男34例,女16例;年龄20~59岁,平均(35.7±9.2)岁;诊断参照2000年中华医学会制订的病毒性肝炎诊断标准[4],治疗前HBV-DNA均阳性,排除其他类型肝炎病毒重叠感染。以正常健康体检者30例作为对照组,其中男20例,女10例;年龄18~60岁,平均(34.8±9.7)岁。两组患者的性别、年龄比较无统计学差异(P>0.05),具有可比性。
1.2 治疗方法
治疗组患者给予拉米夫定片(葛兰素制药有限公司)100 mg,每日1次,疗程为6个月。
1.3 观察指标
分别在治疗前和治疗6个月后检测治疗组患者外周血Th1和Th2细胞因子、HBV-DNA及肝纤维化指标的变化,而对照组只测定1次。抽取静脉血4 mL,置乙二胺四乙酸(EDTA)抗凝管中,常规分离外周血单核细胞(PBMC),以磷酸盐缓冲液(PBS)冲洗3次,10%FCS-1640培养液调细胞浓度为2×106/mL,接种入24孔细胞培养板,每孔1 mL,做3个复孔,用植物血凝素(PHA)诱导其增殖,终质量浓度为200 μg/mL,置37℃及5%CO2孵箱中培养48 h,收集上清液,置-80℃备检。采用双抗体夹心酶联免疫吸附法(ELISA)检测上清液中IL-4和IFN-γ含量,试剂盒购于深圳晶美生物工程有限公司。采用荧光探针聚合酶链反应(PCR)法检测HBV-DNA,试剂盒购自上海复星生物技术有限公司。采用放免分析法检测肝纤维化指标如透明质酸(HA)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(Ⅳ-C)、层黏蛋白(LN),试剂由上海海军医学研究所提供。
1.4 统计学方法
2 结果
两组观察指标比较见表1。可见,与对照组比较,治疗组患者外周血培养上清液PBMC中IFN-γ水平明显下降(P<0.01),而IL-4水平明显上升(P<0.01);经拉米夫定治疗6个月后,IFN-γ水平明显上升(P<0.05),而IL-4水平(P<0.05)和HBV-DNA含量明显下降(P<0.01)。经拉米夫定治疗6个月后,治疗组患者肝纤维化指标均较治疗前明显下降(P<0.05)。
表1 两组观察指标比较(±s)
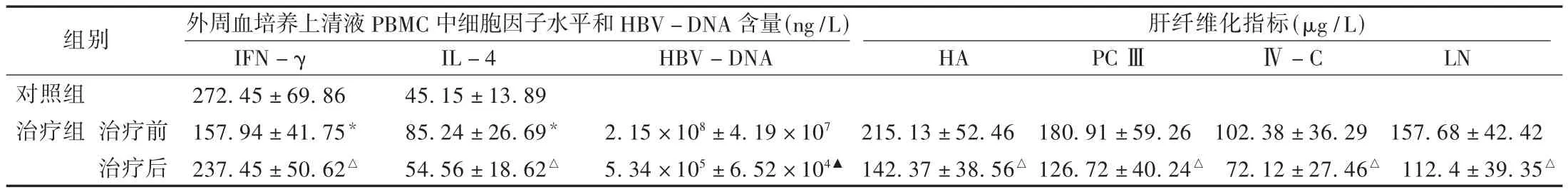
表1 两组观察指标比较(±s)
注:与对照组比较,*P <0.01;与治疗前比较,△P <0.05,▲P <0.01。
组别 外周血培养上清液PBMC中细胞因子水平和HBV-DNA含量(ng/L) 肝纤维化指标(μg/L)HA IL-4 45.15±13.89 85.24±26.69*54.56±18.62△IFN-γ 272.45±69.86 157.94±41.75*237.45±50.62△HBV-DNA PCⅢ Ⅳ-C LN对照组治疗组 治疗前治疗后2.15×108±4.19×107 5.34×105±6.52×104▲215.13±52.46 142.37±38.56△180.91±59.26 126.72±40.24△102.38±36.29 72.12±27.46△157.68±42.42 112.4±39.35△
3 讨论
拉米夫定是第1个在我国和全球被批准用于治疗慢性乙型肝炎的口服药。其作用机制通过抑制HBV-DNA多聚酶的活性而发挥生物学效应,可迅速抑制HBV-DNA复制,降低HBV-DNA水平,而且能重建HBV特异性细胞免疫[5]。徐立新等[6]研究发现,拉米夫定治疗乙型肝炎病毒e抗原(HBeAg)阳性轻度慢性乙型肝炎,抑制了HBV的复制,调节了患者的细胞免疫功能,减轻了肝脏的炎症反应及纤维化,有利于病毒的清除。何登明等[3]研究发现,拉米夫定治疗慢性乙型肝炎,可以促进机体生成更多的IFN-γ,以促进抗HBV免疫恢复,Th1/Th2平衡在拉米夫定疗程中的变化可以作为疗效评价指标。
特定免疫应答及其效应机制主要由分泌不同细胞因子的Th亚群细胞调节,Th1细胞主要分泌白细胞介素-2(IL-2)、白细胞介素 -12(IL-12)、IFN-γ和肿瘤坏死因子 -α(TNF-α),介导细胞免疫应答,在抵御胞内病原微生物方面起着重要作用;Th2主要分泌IL-4、白细胞介素-5(IL-5)、白细胞介素-6(IL-6)和白细胞介素-10(IL-10),调节体液免疫反应,在抵御胞外病原微生物感染方面发挥作用。抗病毒是慢性HBV感染治疗的一个重要手段,机体清除HBV的关键是健全的特异性免疫功能,抗病毒治疗则可强化机体的清除病毒能力,最终清除病毒还需机体的特异性免疫功能,因此细胞免疫在抗HBV感染中起着核心作用。Th1/Th2细胞的平衡被打破在慢性HBV感染中的作用,日益受到人们关注。Th2细胞因子与HBV感染的慢性化有关,Th1型细胞因子与肝组织的炎症活动相关,并有利于病毒的清除[7]。如果Th1细胞亚群占优势,将促进细胞免疫反应,增强CD8+T细胞的活性,从而清除细胞内病毒,同时加重肝细胞的损伤;如果Th2细胞亚群占优势,将促进体液免疫反应,并抑制细胞免疫反应,使细胞毒性T淋巴细胞(CTL)细胞活性减弱,肝细胞损伤减轻。在慢性乙型肝炎中,以Th2应答为主,但随着炎症活动的加剧,Th1型细胞因子比例增加。Th1/Th2类细胞失衡与乙型肝炎的慢性化有关[2]。
本研究发现,慢性乙型肝炎患者存在Th1/Th2平衡失调,Th2细胞因子增多,Th1细胞因子减少,免疫状态由Th1向Th2“克隆漂移”,这是造成HBV持续感染的主要原因。另外研究还发现,拉米夫定既能抑制HBV-DNA复制,又能调节Th1/Th2细胞因子比例平衡,使免疫反应由Th2型向Th1型逆转。其作用机制可能是,拉米夫定可促进Th1细胞发育,抑制Th2细胞发育,进而促进IFN-γ等Th1细胞因子的分泌,抑制IL-4等Th2细胞因子的分泌,提高细胞免疫反应,抑制体液免疫反应,增强CD8+T细胞的活性,从而清除细胞内病毒,降低血清HBV-DNA的含量。
肝纤维化是许多慢性肝病的共同病理特征。其实质是肝脏的损伤与愈合反应过程,结果是肝脏的细胞外基质(ECM)的产生超过其降解,从而使过多的ECM沉积于肝脏组织,导致肝脏正常结构的破坏、重构及肝功能的损伤[8]。反映肝细胞ECM代谢的血清学指标有HA,LN,PCⅢ,Ⅳ-C等。近年来对肝组织学和血清肝纤维化指标相关性的研究结果表明,血清肝纤维化指标和肝组织纤维化程度有良好的相关性,并与肝组织纤维化发展的阶段性一致[9]。因此,检测血清肝纤维化指标ECM产物的含量可客观地推测肝细胞损伤及纤维化程度。本研究结果提示,拉米夫定能抑制肝内ECM和胶原的合成,对肝纤维化有一定疗效,与胡冰等[10]的报道一致。
综上所述,慢性乙型肝炎患者存在Th1/Th2平衡失调,拉米夫定通过调节Th1/Th2细胞的平衡,可有效抑制HBV的复制,降低患者血清中肝纤维化指标的水平,从而达到清除细胞内病毒、防治肝纤维化的目的。
[1]Jiang R,Feng X,Guo Y,et al.T helper cells in patients with chronic hepatitis B virus infection[J].Chin Med J(Engl),2002,115(3):422-424.
[2]Priimiagi LS,Tefanova VT,Tallo TG,et al.Immune-regulating Th1-and Th2-cytokines in chronic infections caused by hepatitis B and C viruses[J].Vopr Virusol,2003,48(4):37-40.
[3]何登明,毛 青.拉米夫定治疗对漫性乙型肝炎患者Th1/Th2平衡的影响及意义[J].中华肝脏病杂志,2004,12(8):495-496.
[4]中华医学会传染病与寄生虫病学分会、肝病学分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8(5):342.
[5]Boni C,Penna A,Ogg GS,et al.Lamivudine treatment can overcome totoxic T-cell hyporesponsiveness in chronic hepatitis B:new perspectives for immune therapy[J].Hepatology,2001,33(4):963-971.
[6]徐立新.拉米夫定治疗慢性乙型肝炎T细胞亚群及血清HA、TGF-β1的变化[J].临床肝胆病杂志,2008,24(2):911-912.
[7]Beckebaum S,Cicinnati VR,Zhang X,et al.Hepatitis B virus-induced defect of monocyte-derived dendritic cells leads to impaired T helper type1 response in vitro:mechanismsforviralimmune escape[J].Immunology,2003,109(4):487-495.
[8]王吉耀.重视肝纤维化的基础与临床研究[J].中华医学杂志,2005,85(15):1 009-1 010.
[9]薛爱玲,胡益民,高宗玲.病毒性肝炎病人血清纤维化标志检测及其意义[J].中国基层医药,2004,11(4):453-454.
[10]胡 冰,刘春玲.拉米夫定治疗慢性乙型肝炎对肝纤维化指标的影响[J].中华传染病杂志,2003,21(1):62-63.
