杜氏盐藻葡萄糖-6-磷酸异构酶重组蛋白的纯化及其多克隆抗体制备*
2010-09-17崔柳青刘红涛薛乐勋
张 磊,崔柳青,李 杰,刘红涛,薛乐勋
郑州大学生物工程系细胞生物学研究室郑州 450001
杜氏盐藻葡萄糖-6-磷酸异构酶重组蛋白的纯化及其多克隆抗体制备*
张 磊,崔柳青,李 杰,刘红涛,薛乐勋#
郑州大学生物工程系细胞生物学研究室郑州 450001
#通讯作者,男,1944年 2月生,本科,教授,研究员,研究方向:肿瘤标志物与基因工程,E-mail:xuelx@371.net
葡萄糖-6-磷酸异构酶;原核表达;抗体制备;杜氏盐藻
目的:纯化杜氏盐藻葡萄糖-6-磷酸异构酶 (GPI)重组蛋白,制备多克隆抗体。方法:PCR扩增得到两端分别添加 NdeⅠ和 EcoRⅠ酶切位点的 GPI基因,双酶切后插入原核表达载体 pET28a(+),得到重组载体 pET28a-GPI,经鉴定正确后,用该重组载体转化大肠杆菌BL21(DE3),IPTG诱导表达后用镍离子柱纯化目的蛋白并免疫新西兰白兔,间接 EL ISA和Western blot法检测抗体的效价和特异性。结果:杜氏盐藻 GPI基因在大肠杆菌 BL21(DE3)中得到高效表达,占总蛋白的 41.6%。以高纯度的目标蛋白作为抗原免疫新西兰白兔,得到抗 GPI的抗血清。间接 EL ISA检测抗血清效价达到 1∶512 000,Western blot检测证实抗血清能与目的蛋白特异性结合。结论:成功纯化了杜氏盐藻 GPI重组蛋白并制备了特异性的 GPI多克隆抗体。
葡萄糖-6-磷酸异构酶 (glucose-6-phosphate isomerase,GPI)普遍存在于真核及原核生物中,其催化葡萄糖-6-磷酸与果糖-6-磷酸之间的相互转化,在糖代谢中起到重要的作用[1]。近年来的研究结果显示,GPI作为非常保守的酶[2],不仅参与糖代谢,而且还具有一些其他作用[3-4],如在动物细胞中作为自分泌运动因子 (AMF)促进肿瘤细胞增殖浸润,刺激 T、B淋巴细胞移动和生长[5-6]。杜氏盐藻是一种极其耐盐的单细胞真核绿藻,具有双鞭毛,可以游动,具有较强的光合作用[7]。但是目前关于杜氏盐藻 GPI的研究仍是空白,并且没有针对杜氏盐藻 GPI的商业化抗体出售,也不能检测其在蛋白水平的表达情况。该研究构建了杜氏盐藻 GPI的重组原核表达载体 pET28a-GPI,诱导其在大肠杆菌 BL21(DE3)中表达,经纯化获得高纯度的重组蛋白,通过免疫新西兰白兔,获得了兔抗杜氏盐藻 GPI的特异性多克隆抗体,为杜氏盐藻 GPI蛋白水平的研究提供了材料。
1 材料与方法
1.1 材料
1.1.1 藻株、菌株与质粒 杜氏盐藻购自美国德克萨斯州大学,大肠杆菌 DH5α、BL21(DE3)工程菌及pET28a(+)表达载体为郑州大学生物工程系细胞生物学研究室保存。
1.1.2 工具酶及主要试剂 LA Taq DNA聚合酶,限制性内切酶EcoRⅠ和N deⅠ,反转录试剂盒,质粒提取试剂盒和凝胶回收试剂盒均购自大连宝生物公司;T4 DNA连接酶购自 Promega公司;相对分子质量 Marker购自加拿大 MB I公司 ;异丙基 -β-D-硫代半乳糖苷 (IPTG)和山羊抗兔 IgG购自郑州宝信生物工程公司;蛋白纯化试剂盒购自 Novagen公司;PCR特异性引物由北京博尚生物技术公司合成;RNA提取试剂 Trizol购自美国 Invitrogen公司。
1.1.3 动物来源 体质量约 2 kg的雌性新西兰白兔 2只,购自河南省农业科学院。
1.2 盐藻细胞的培养 盐藻常规接种到改良的Ben-Amotz盐藻培养液中,置 23℃光照培养箱中进行培养,光照强度为 4 500 Lux,明暗周期为 12 h∶12 h。
1.3 引物的设计 根据 GenBank报道的杜氏盐藻GPI的基因序列 (GenBank登录号 FJ210719)设计合成引物。上游引物 UF:5’-CGCCATATGATGTTGTC CAACTTCAAGCAGG-3’;下 游 引物 UR:5’-CCG GAATTCTCATGGCAGCGAATCCACAG-3’。上、下游引物近 5’端分别引入N deⅠ和EcoRⅠ酶切位点。
1.4 杜氏盐藻总 RNA的提取 取对数生长期的盐藻细胞,用 Trizol试剂提取盐藻细胞总 RNA。通过 10 g/L琼脂糖凝胶电泳判断 RNA的完整性,通过测定A(260 nm)/A(280 nm)判断 RNA的纯度。
1.5 PCR扩增杜氏盐藻 GPI cDNA序列 取 1μg RNA作逆转录模板,随机引物作逆转录引物,总反应体积为 20μL。变性 70℃5min后迅速冰浴,依次加入 4μL反应缓冲液、1μL RNase抑制剂和 2μL dNTP混合物,37℃5min后加 1μL M-MLV逆转录酶,37℃60min,70℃10min结束反应。取上述反转录的 cDNA为模板用特异性引物 UF和 UR进行 PCR扩增。反应体系 (50μL)包括:cDNA模板 1μL,10×Buffer 5μL,dNTP 4μL,上游引物 UF 1μL,下游引物 UR 1μL,LA Taq DNA聚合酶 0.5μL及无菌水 37.5μL。反应条件为:94℃预变性 5min;94℃变性 30 s,60℃退火 30 s,72℃延伸 2min;30个循环后 72℃延伸 5min。扩增完毕后置 4℃终止反应。
1.6 杜氏盐藻 GPI原核表达载体的构建EcoRⅠ、NdeⅠ双酶切杜氏盐藻 GPI PCR产物和 pET28a(+)原核表达载体,经 10 g/L琼脂糖凝胶电泳鉴定酶切结果,胶回收、纯化,分别得到含有相同黏性末端的 GPI基因片段和 pET28a(+)线性载体片段,经16℃过夜连接、转化大肠杆菌 DH5α和筛选阳性克隆后,将初步鉴定正确的菌株送北京博尚生物技术公司测序以确定读码框是否正确。
1.7 pET28a-GPI在 BL21(DE3)中的诱导表达用经测序确认正确的 pET28a-GPI重组质粒转化感受态 BL21(DE3)工程菌,之后涂于含有卡那霉素的琼脂平板上,37℃过夜培养,挑取克隆接种于含有100 mg/L卡那霉素的溶菌肉汤 (LB)液体培养基中,37℃振荡培养,经吸光度 (A)检测,至A(600 nm)约为 0.6时,加入 IPTG继续振荡培养,取 1 mL菌液,离心收集菌体,弃上清,沉淀用 100μL的 1×SDS上样缓冲液重悬,100℃煮沸 5min,取 20μL上样于 120 g/L SDS-PAGE进行不连续蛋白电泳。以未转化 BL21(DE3)菌株作为对照。分别将 IPTG诱导时间设定为 1、2、3、4和 5 h,根据蛋白表达量的多少确定最佳诱导时间;之后分别将 IPTG诱导浓度设定为 0.5、1.0、2.0、3.0和 4.0 mmol/L,在最佳诱导时间诱导,确定最佳诱导浓度。
1.8 目标蛋白的纯化 在优化条件下诱导表达菌大量扩增 (800 mL),5 000 r/min离心 10min收集菌体,PBS洗涤 2次,80 mL裂解缓冲液 (PBS,10 mg/L溶菌酶,体积分数 1%Triton X-100,pH 8.0)重悬菌体,4℃放置过夜。待菌液变得黏稠后,超声破碎进一步裂解细菌,超声破碎后的悬浊液 7 500 r/min离心 20min,分别取少量上清和沉淀进行SDS-PAGE电泳,确定目的蛋白的表达形式主要是不可溶的包涵体,故弃上清。包涵体沉淀经洗涤液(PBS,8 mol/L尿素,体积分数 1%Triton X-100)多次洗涤后用包涵体溶解液 (PBS,6 mol/L尿素,质量分数 0.01%β-巯基乙醇)4℃过夜溶解,经 0.45 μm微孔滤膜过滤,上样于已平衡的组氨酸标签纯化树脂 (Ni2+-NTA-Resin)柱上,经过结合和洗涤缓冲液洗柱,最终以洗脱缓冲液 (6 mol/L尿素,4 mol/L NaCl,0.5 mmol/L Tris-HCl,100 mmol/L咪唑,pH 8.0)洗脱目的蛋白。目的蛋白溶液经含 2 mol/L尿素的 PBS缓冲液 4℃透析 48 h后,进行 SDS-PAGE蛋白电泳,分析纯度。
1.9 GPI多克隆抗体的制备及抗体效价、特异性测定 将透析好的杜氏盐藻 GPI重组蛋白溶液定量后,分别与弗氏完全佐剂和弗氏不完全佐剂等体积混匀,超声波法使其完全乳化,皮下多点免疫新西兰白兔,每只免疫蛋白量为 1 mg。首次免疫采用弗氏完全佐剂乳化的抗原,以后均采用弗氏不完全佐剂乳化的抗原。间隔 14 d进行第 2次免疫,抗原量减半。以后每隔 7 d加强免疫 1次,共加强免疫 5次。末次免疫 8 d后,颈动脉插管取血,分离血清,稀释1 000倍,依次倍比稀释,按照间接 EL ISA方法测定抗体效价。以制备的兔抗 GPI多克隆抗体为一抗,1∶2 000稀释后进行Western blot,检测抗体特异性。
2 结果
2.1 杜氏盐藻总 RNA的提取和 PCR扩增杜氏盐藻 GPI cDNA序列 用 Trizol试剂从杜氏盐藻细胞中提取总 RNA,纯度和完整性符合 RT-PCR要求。以杜氏盐藻总 RNA为模板进行 RT-PCR,扩增出约2 000 bp的特异条带与 NCB I登录的杜氏盐藻 GPI cDNA长度基本一致 (图1)。
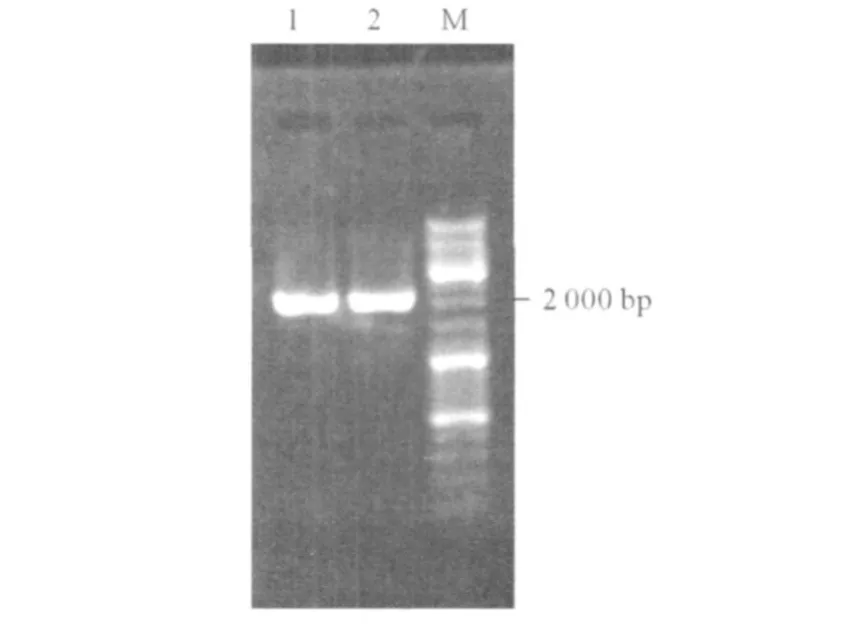
图1 杜氏盐藻 GPI的 RT-PCR电泳图1,2:杜氏盐藻 GPIRT-PCR结果;M:DNA Marker。
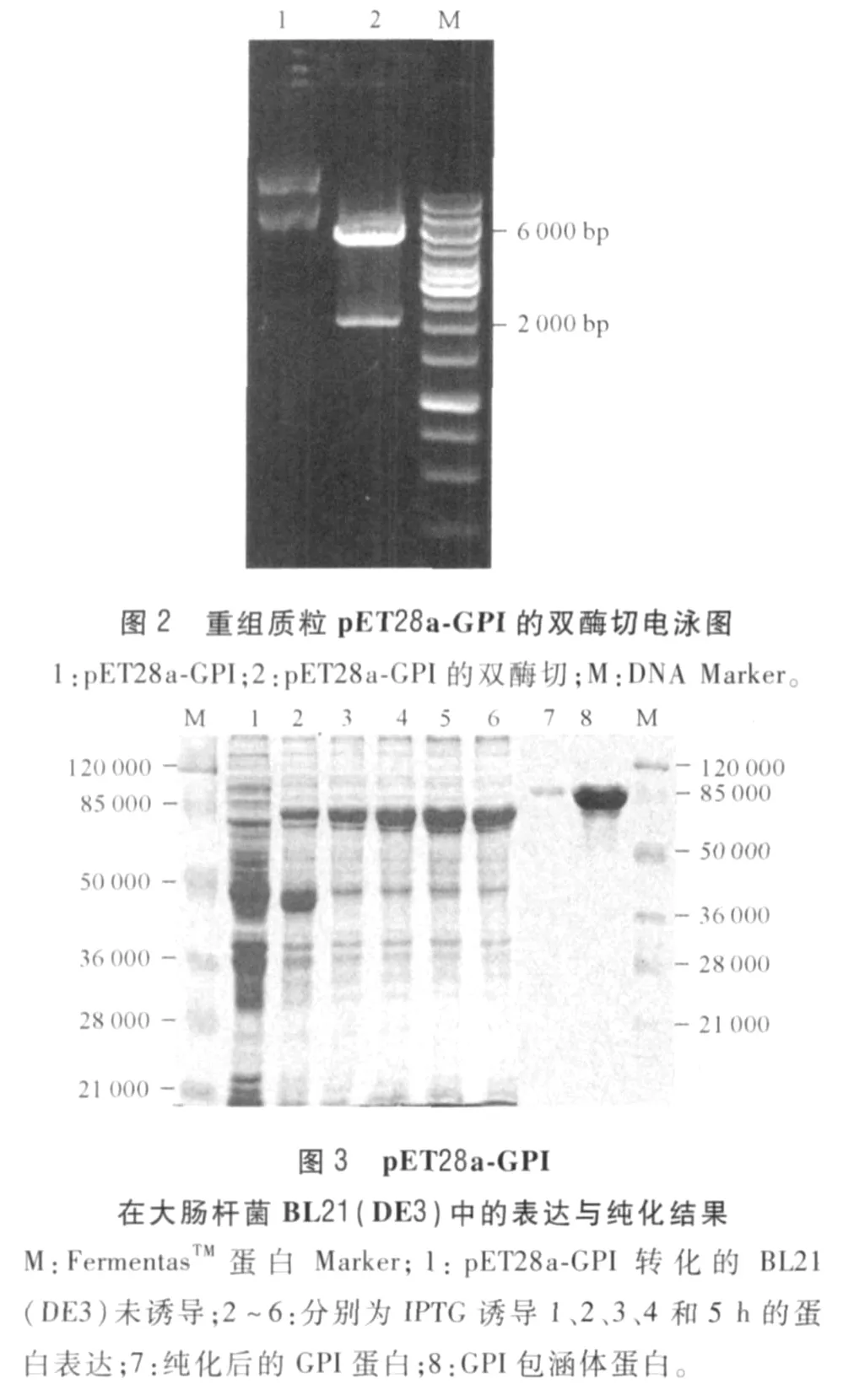
2.2 原核表达载体 pET28a-GPI的鉴定 重组原核表达载体 pET28a-GPI经EcoRⅠ和NdeⅠ双酶切后出现约 2 000 bp的 DNA条带 (图2)。经测序,插入片段长 1 980 bp,编码 659个氨基酸,且读码框正确。
2.3 重组质粒在大肠杆菌 BL21(DE3)中的表达与纯化 SDS-PAGE结果显示表达菌在相对分子质量为 75 000处有一新条带,而对照菌株没有 (图3)。蛋白表达量在诱导 4 h后无明显增加。在不同IPTG浓度诱导下,GPI的表达量有差异。优化诱导条件为 3 mmol/L IPTG 37℃下连续诱导 4 h,目的蛋白表达量最高可达 41.6%。纯化后 GPI纯度达到 96%,符合进一步免疫动物的抗原纯度要求。
2.4 GPI多克隆抗体的效价和特异性 间接EL ISA结果显示所制备的兔抗杜氏盐藻 GPI多克隆抗体滴度为 1∶512 000。以制备的多克隆抗体为一抗,1∶2 000进行抗体特异性检测,Western blot结果显示抗体具有较高的特异性 (图4),能够用于在蛋白水平检测杜氏盐藻 GPI的表达。
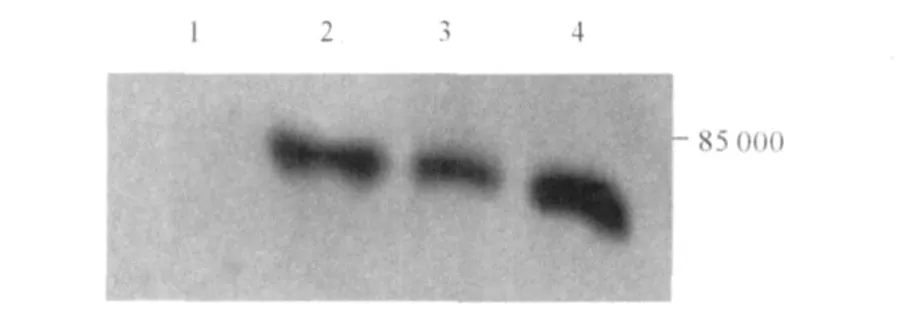
图4 兔抗 GPI多克隆抗体的W estern blot结果1:pET28a(+)转化的 BL21;2~4:分别为 IPTG诱导 1、2和3 h的 GPI蛋白。
3 讨论
GPI基因序列已经在多种生物中得到克隆,除了在糖酵解和糖异生等糖代谢过程中具有重要作用外,它还具有的一些新作用正逐渐被发现。在动物细胞中,GPI作为 AMF与细胞表面的受体 (AMFR)结合后能够促进肿瘤细胞的增殖和转移[8]。杜氏盐藻作为一种单细胞真核绿藻,其 GPI除了参与基本的糖代谢作用外,其他的功能尚不清楚。目前对杜氏盐藻 GPI的检测仍处于基因水平,缺少特异性的抗体成为制约对其研究的瓶颈。该研究通过制备杜氏盐藻 GPI多克隆抗体使在蛋白水平上研究杜氏盐藻 GPI的表达成为了可能,同时也为通过免疫共沉淀技术寻找杜氏盐藻细胞内能够与 GPI相互作用的潜在受体蛋白奠定了物质基础。
由于 GPI天然蛋白表达量低,缺少合适的纯化标签,因而利用天然蛋白作为抗原制备抗体缺乏可行性。但是,以大肠杆菌为代表的原核表达系统则具有高效、快捷、成本低及周期短等特点,而且使用携带纯化标签的商业化载体,使目标蛋白的纯化简单易行,因此成为制备蛋白抗原的最佳选择。
该研究将杜氏盐藻 GPI基因按照正确的阅读框架定向插入到原核表达载体pET28a(+)中,经IPTG诱导使两端分别具有 6个组氨酸标签的重组蛋白高效表达,表达量约占菌体总蛋白的 41.6%,为后续的分离纯化提供了良好的条件。
由于 GPI蛋白相对分子质量高达 75 000,并且具有 3对二硫键,所以无论降低诱导温度还是诱导物浓度,目标蛋白均以包涵体形式表达。包涵体蛋白纯度较高,易于分离纯化,使制备的抗原纯度较高,增加了所制备抗体的特异性。
蛋白的免疫原性与其相对分子质量成正比,杜氏盐藻 GPI蛋白相对分子质量高达 75 000,容易引起动物免疫反应。为了提高动物的免疫应答,在第1次免疫后每隔 3 d给新西兰白兔注射 2 mL聚肌胞,共注射 4次,以增强抗体形成,刺激巨噬细胞的吞噬作用[9],并且在最后 2次加强免疫中加倍了抗原量,大大促进了抗体的形成。
总之,该抗体的制备为在蛋白水平检测杜氏盐藻 GPI的表达提供了重要工具。对杜氏盐藻 GPI蛋白水平的研究将更进一步揭示其潜在的功能。
[1]Grauvogel C,Brinkmann H,Petersen J,et al.Evolution of the glucose-6-phosphate isomerase:the plasticity of primarymetabolism in photosynthetic eukaryotes[J].MolBiol Evol,2007,24(8):1 611
[2]KatzLA.Transkingdom transfer of the phosphoglucoseisomerase gene[J].J Mol Evol,1996,43(5):453
[3]MunjralN,GuptaAK,KaurN.Studieson glucose-metabolizing enzymes in cytosolic and bacteroidal fractions of mungbean(Vigna radiata L.)and lentil(Lens culinaris L.)nodules[J].Indian J Biochem Biophys,2007,44(3):186
[4]Wang R,OkamotoM,Xing X,et al.Microarray analysis of the nitrate response in Arabidopsis roots and shoots reveals over 1 000 rapidly responding genes and new linkages to glucose,trehalose-6-phosphate,iron,and sulfate metabolis m[J].Plant Physiol,2003,132(2):556
[5]Chiu CG,St-Pierre P,Nabi IR,et al.Autocrine motility factor receptor:a clinical review[J].Expert Rev Anticancer Ther,2008,8(2):207
[6]Funasaka T,RazA.The role of autocrinemotility factor in tumor and tumormicroenvironment[J].CancerMetastasis Rev,2007,26(3/4):725
[7]冯英才,王天云,王鹏举,等.杜氏盐藻核基质附着区结合蛋白基因的克隆及原核表达[J].郑州大学学报:医学版,2008,43(6):1 120
[8]Yanagawa T,Funasaka T,Tsutsumi S,et al.Novel roles of the autocrinemotility factor/phosphoglucose isomerase in tumor malignancy[J]. Endocr Relat Cancer,2004,11(4):749
[9]王磊,莫菲,万荣峰,等.聚肌胞注射液对罗曼蛋鸡免疫机能的影响[J].南京农业大学学报,2008,31(4):119
(2010-01-07收稿 责任编辑姜春霞)
Purification ofDunaliella salinaglucose-6-phosphate isomerase recombinant proteins in engineering bacteria and preparation of their polyclonal antibody
ZHANG Lei,CU I L iuqing,L I Jie,L IU Hongtao,XUE Lexun
Laboratory for Cell B iology,Departm ent of B ioengineering,Zhengzhou University,Zhengzhou 450001
glucose-6-phosphate isomerase;prokaryotic expression;preparation of polyclonal antibody;Dunaliella salina
A im:To purifyDunaliella salinaglucose-6-phosphate isomerase(GPI)recombinant proteins in engineering bacteria and to prepare their polyclonal antibody.Methods:A recombinant prokaryotic expression vector pET28a-GPI was constructed after the GPI gene fragmentswere successfully inserted into theNdeⅠ-EcoRⅠ sites of pET28a(+).The total proteins ofE.coliBL21(DE3)transfor med with pET28a-GPIwere analyzed by SDS-PAGE after induction of IPTG.The recombinant proteins purified byNi2+-NTA-Resin were used to immunize 2 New Zealand rabbits,and the specificity and sensitivity of anti-sera were characterized by Western blot and EL ISA,respectively.Results:The GPI gene was expressed effectively inE.coliBL21(DE3).The recombinant proteins were up to 41.6%of the total expressed proteins.Western blot showed that the anti-sera from the immunized New Zealand rabbits bound specificly to target proteins and the titer of anti-sera was 1∶512 000 by EL ISA.Conclusion:Polyclonal antibody against GPIwith high specificity and sensitivity has been prepared using purified GPI as antigens.
Q786
*科技部国际科技合作基金资助项目 2007DFA01240;国家自然科学基金资助项目 30700014