绳状青霉菌发酵产右旋糖酐酶的条件研究
2010-09-15朱慧霞王雅洁邓胜松姚日生张洪斌
朱慧霞,王雅洁,邓胜松,姚日生,*,张洪斌
绳状青霉菌发酵产右旋糖酐酶的条件研究
朱慧霞1,王雅洁2,邓胜松1,姚日生1,*,张洪斌1
(1.合肥工业大学化学工程学院,农产品生物化工教育部工程研究中心,安徽 合肥 230009;2.安徽医学高等专科学校药学系,安徽 合肥 230601)
研究绳状青霉菌(Penicillium funiculosum)发酵培养产右旋糖酐酶的条件。研究碳源、氮源对绳状青霉菌产右旋糖酐酶的影响,结果表明最适合发酵产酶的碳源、氮源分别是右旋糖酐和蛋白胨。采用正交试验对绳状青霉菌产右旋糖酐酶的发酵条件进行优化,结果表明最适条件为:发酵瓶装液量为80mL/250mL,发酵培养基的初始pH值为5.5,培养温度为28℃,在该条件下,右旋糖酐酶的酶活力为18.963U/mL。
右旋糖酐酶;绳状青霉菌;正交试验
右旋糖酐酶(endodextranase,dextranase,α-D-1, 6-glucan 6-D-glucanohydrolase,EC 3.2.1.11)是专一性地裂解右旋糖酐(dextran)分子中的α-1,6-葡萄糖糖苷键的水解酶[1-2]。右旋糖酐酶的产生菌[3-4]比较多,最常见的有青霉菌。右旋糖酐酶是诱导酶,主要的诱导物有:右旋糖酐、改良的底物酮基右旋糖酐和改良的产物异麦芽糖棕榈酸单酯或二酯[5]。目前,右旋糖酐酶的应用非常广泛[6-10],主要应用于以下3个方面:制糖业中防止蔗糖转化、改变口腔中的葡聚糖成分预防龋齿、分解大分子右旋糖酐生产药用右旋糖酐。
有很多微生物都可以作为右旋糖酐酶的产生菌,但在目前的研究中,最有研究价值的右旋糖酐酶产生菌是青霉菌和拟青霉菌[11-12],因为青霉菌、拟青霉菌所产生的右旋糖酐酶能耐受50℃的高温。本研究选用绳状青霉菌(Penicillium funiculosum),对其产右旋糖酐酶的发酵条件进行研究,以期为右旋糖酐酶的工业化生产和应用提供依据。
1 材料与方法
1.1 材料
右旋糖酐(分子质量约40000D) 安徽朝阳制药厂。
1.2 菌种与培养基
绳状青霉菌(Penicillium funiculosum),购于广东微生物研究所。
斜面培养基:普通的察氏琼脂培养基;发酵培养基:右旋糖酐1.5g、蛋白胨0.5g、K2HPO40.4g、MgSO40.02g、KCl 0.02g、FeSO40.001g,水100mL,pH6.0~7.0,0.1MPa灭菌20min。
1.3 仪器与设备
Waters系列高效液相色谱仪(配有2414型示差折光检测器、Breeze色谱工作站)、UltrahydrogelTM500凝胶色谱柱(7.8mm×300mm)、UltrahydrogelTM120凝胶色谱柱(7.8mm×300mm) 美国Waters公司。
1.4 菌种培养[5]
将菌种接入察氏平板培养基中,28℃培养6~8d。发酵培养是在28℃、200r/min振荡培养。
1.5 粗酶液制备
从摇瓶中取发酵液,经0.45μm的微孔滤膜过滤除去菌体,即得粗酶液。
1.6 右旋糖酐酶酶活力测定[13]
右旋糖酐酶的酶活是用分解底物右旋糖酐产生的还原糖量来表示。在40℃、0.2mol/L的醋酸缓冲液(pH5.1)中,每小时生成1mg还原糖,定义为一个酶活单位。采用3,5-二硝基水杨酸试剂法测定还原糖的量(DNS比色法)[14-15]。所有的实验均是重复3次取平均值进行分析。
1.6.1 葡萄糖标准溶液的配制
准确称取80℃烘至质量恒定的分析纯葡萄糖100mg,置于烧杯中,加少量蒸馏水溶解后,转移到100mL容量瓶中,用蒸馏水定容至100mL,即得1mg/mL的葡萄糖标准溶液。
1.6.2 DNS试剂的配制
甲液:溶解6.9g结晶酚于15.2mL 10g/100mL氢氧化钠溶液中,用水稀释至69mL,在此溶液中加6.9g亚硫酸氢钠。乙液:称取255g酒石酸钾钠加到300mL 10g/100mL氢氧化钠溶液中,再加入880mL 1g/100mL 3,5-二硝基水杨酸溶液。将甲乙二液相混合即得到黄色试剂,贮于棕色瓶中,室温放置7~10d以后使用。
1.6.3 葡萄糖标准曲线的制作
取7支20mL具塞刻度试管并编号,分别加入质量浓度为1mg/mL的葡萄糖标准液、蒸馏水和3,5-二硝基水杨酸(DNS)试剂,配成不同葡萄糖质量浓度的反应液。将各管摇匀,在沸水浴中加热5min取出,冷却至室温,用蒸馏水定容至20mL并摇匀,于波长540nm处测定吸光度。以吸光度为纵坐标、葡萄糖含量(mg)为横坐标作图即得葡萄糖的标准曲线。
1.6.4 发酵液中右旋糖酐酶酶活力测定
取两支20mL具塞刻度试管,分别加入4mL含1.5g/100mL右旋糖酐的0.2mol/L醋酸缓冲溶液中(pH5.1)后置于40℃水浴保温10min。一支加入粗酶液1mL后准确反应10min后加入DNS试剂灭活,另一支先加入DNS试剂,后加入粗酶液作为对照。加热、定容和比色等其余操作与制作标准曲线相同。利用酶促反应生成的还原糖吸光度的平均值,在标准曲线上查出相应的还原糖毫克数,计算出酶活力。
1.7 正交试验设计
在单因素结果基础上,选定各个因素的水平范围进行正交试验,考察各因素对绳状青霉菌发酵产右旋糖酐酶的影响,以期获得绳状青霉菌发酵产酶的最适条件。
1.8 总糖测定[16]
采用蒽酮法测定。
1.9 右旋糖酐分子质量测定
[17]检测。
2 结果与分析
2.1 培养时间对右旋糖酐酶酶活力的影响

图1 培养时间对右旋糖酐酶酶活力的影响Fig.1 Effect of fermentation time on dextranase production

图2 培养时间对发酵液pH值、总糖含量的影响Fig.2 Effect of fermentation time on pH value and total sugar content
由图1可知,在第6天绳状青霉菌开始产生右旋糖酐酶,随着培养时间的延长,酶活力逐渐增大,在第8天酶活力达到峰值(4.316U/mL),但较低,从图2可以看出,菌体生长较缓慢,这可能是由于种子液中菌浓度偏低,不利于产酶研究,在后面的实验中适当提高菌浓度。在之后的研究中绳状青霉菌的培养时间就选取8d,然后将发酵液过滤除菌后制得粗酶液,测定酶活力。
2.2 培养基成分对右旋糖酐酶酶活力的影响
将发酵培养基配方中的碳源右旋糖酐分别更换成葡萄糖、蔗糖、果糖、麦芽糖和可溶性淀粉,其他成分不变,考察不同碳源对绳状青霉菌产右旋糖酐酶的影响,结果见图3。

图3 不同碳源的产酶结果Fig.3 Effect of carbon kind on dextranase production
由图3可知,3种还原糖(葡萄糖、果糖和麦芽糖)作为碳源时均不产生右旋糖酐酶,说明它们不能作为绳状青霉菌发酵产右旋糖酐酶的碳源,也进一步验证了右旋糖酐酶是诱导酶,需要有诱导物的存在才会产生。而3种非还原糖(右旋糖酐、蔗糖和可溶性淀粉)作为碳源供菌体生长时,菌体能产生右旋糖酐酶但酶活力都不高,其中蔗糖作为碳源时酶活力最小,可溶性淀粉作为碳源产生的酶活力比右旋糖酐略小。可溶性淀粉是D-葡萄糖由α-1,4糖苷键连接而成,与右旋糖酐结构相似,也可诱导右旋糖酐酶的产生,但从酶的专一性考虑,最适碳源为右旋糖酐。
将发酵培养基配方中的氮源蛋白胨分别更换成牛肉浸膏、酵母浸膏、硫酸铵和柠檬酸三铵,其他成分不变,考察不同氮源对绳状青霉菌产右旋糖酐酶的影响,结果见图4。
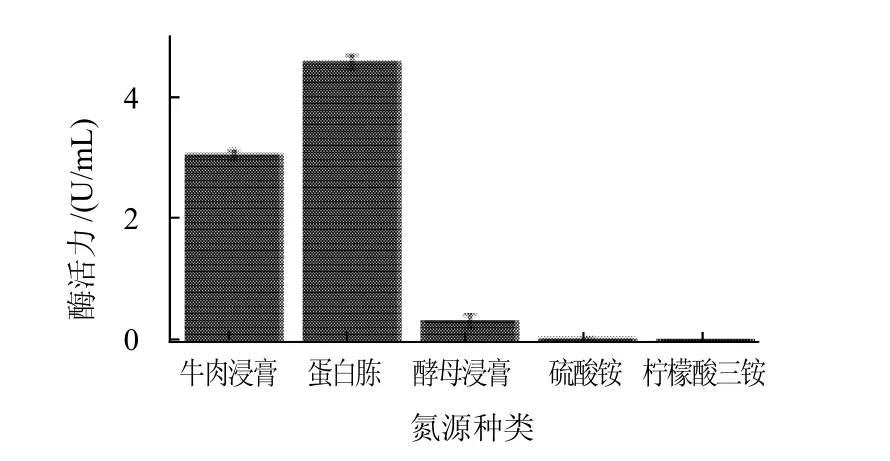
图4 不同氮源的产酶结果Fig.4 Effect of nitrogen kind on dextranase production
由图4可知,无机氮源(硫酸铵和柠檬酸三铵)供绳状青霉菌生长时不产生右旋糖酐酶、不适合作为绳状青霉菌发酵产酶的氮源。只有3种有机氮源供菌体生长时才能产生右旋糖酐酶,其中以蛋白胨为氮源时产生的右旋糖酐酶酶活力最高,这与程秀兰等[5]报道一致。因此,蛋白胨是绳状青霉菌发酵产酶的最适氮源。
2.3 产右旋糖酐酶的发酵条件优化
为了提高绳状青霉菌产右旋糖酐酶的发酵能力,需对其产酶的发酵条件进行优化。结合预试验结果[2],表明发酵液初始pH值、菌种培养温度以及摇瓶装液量这3个因素对该菌产酶的影响比较大,故对这3个因素进行正交试验,以获得最适的绳状青霉菌产酶条件。各因素的水平设计见表1。结果见表2。

表1 产右旋糖酐酶的发酵条件正交试验表Table 1 Factors and levels in the orthogonal array design

表2 正交试验结果Table 2 Orthogonal array desiyn layout and experimental results
由表2的极差R可知,3个因素对发酵产右旋糖酐酶的影响程度大小为A>B>C,即发酵液的初始pH值对发酵产酶的影响最大,其次是反应温度,装液量则相对最小。因此在以后的研究中将重点考察发酵液的初始pH值,把初始pH值的考察范围扩大些,可能会大幅度提高右旋糖酐酶的酶活力。另外,以右旋糖酐酶的酶活力为指标进行考察,最优组合是A2B3C2,由于表2中没有A2B3C2试验组合,故需进行验证实验,在A2B3C2的条件下,右旋糖酐酶的酶活力为18.963U/mL,较表2中的酶活力高,因此确定绳状青霉菌发酵产酶的最适条件为发酵液初始pH值为5.5、摇瓶装液量为80mL/250mL,在28℃条件下进行培养。
2.4 右旋糖酐分子质量测定

图5 右旋糖酐的HPLC图谱Fig.5 Chromatogram of dextran
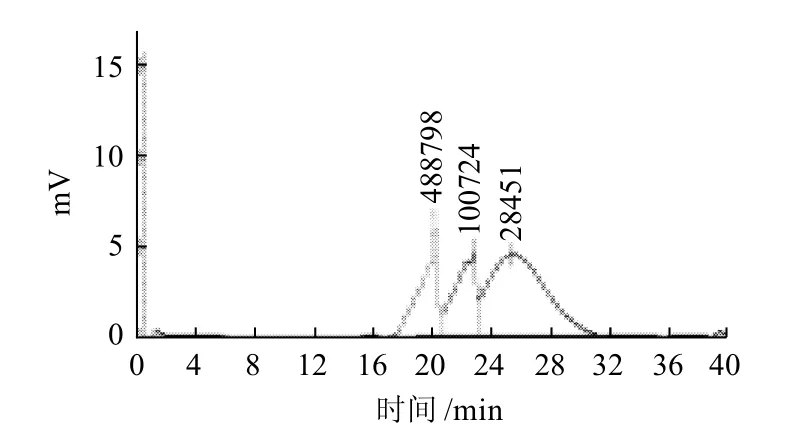
图6 发酵液的HPLC图谱Fig.6 Chromatogram of fermentation broth
利用HPLC检测发酵液中右旋糖酐的分子质量,可验证前面的研究结果。图5是右旋糖酐的HPLC图谱,其中右旋糖酐的洗脱体积为14.944mL,对应的右旋糖酐分子质量为33051D。图6是发酵液样品的HPLC图谱,与图5相比,右旋糖酐的分子质量有所下降,洗脱体积为15.148mL,对应的右旋糖酐分子质量为28451D,表明产生了右旋糖酐酶并且已使发酵液中的右旋糖酐被降解。从图6还可看出,发酵液中也有相对分子质量更大的右旋糖酐生成,洗脱体积分别为11.931mL和13.547mL,对应的右旋糖酐分子质量分别为488798D和100724D,这表明发酵液中除生成了右旋糖酐酶之外,还有能使右旋糖酐聚合的酶生成。该结果将在今后的实验中进一步探索研究。
3 结 论
本实验中的绳状青霉菌可以发酵产生右旋糖酐酶,已经通过HPLC检测右旋糖酐的相对分子质量进行了验证。通过研究表明:不同的碳源和氮源、发酵液初始pH值、培养温度、装液量对绳状青霉菌产右旋糖酐酶有不同程度的影响。结果得出绳状青霉菌在摇瓶培养时其发酵产酶最适碳源、氮源分别为右旋糖酐和蛋白胨,最适产酶条件为:装液量为80mL/250mL,发酵液初始pH值为5.5,培养温度为28℃,在该条件下,右旋糖酐酶的酶活力为18.963U/mL。
参考文献:
[1]KANG H K, KIM S H, PARK J Y, et al. Cloning and characterization of a dextranase gene from Lipomyces starkeyi and its expression in Saccharomyces cerevisiae[J]. Yeast, 2005, 22(15): 1239-1248.
[2]PONS T, CHINEA G, OLMEA O, et al. Structural model of Dex protein from Penicillium minioluteum and its implications in the mechanism of catalysis[J]. Proteins: Structure, Function, and Bioinformatics, 1998, 31(4): 345-354.
[3]BAILEY R W, CLARKE R T J. A bacterial dextranase[J]. Bioch, 1959, 72(9): 49-54.
[4]FINNEGAN P M, BRUMBLEY S M, O SHEA M G, et al. Diverse dextranase genes from Paenibacillus species[J]. Arch Microbiol, 2005, 183(2): 140-147.
[5]程秀兰, 孙晋武, 杨敬, 等. 淡紫拟青霉右旋糖酐酶的形成条件[J].微生物学报, 1992, 32(5): 334-339.
[6]CUDDIHY J A, RAUH J J. Dextranse in sugar production: factory experience[J]. Journal American Society of Sugar Cane Technologists, 2000, 20: 95-103.
[7]STAAT R H, SCHACHTELE C F. Characterization of a dextranase produced by an oral strain of Actinomyces israelii[J]. Infection and immunity, 1975, 12(3): 556-563.
[8]蒋丹, 仇元新, 胡涛, 等. 口腔链球菌右旋糖酐酶分子结构和功能的研究进展[J]. 国际口腔医学杂志, 2008, 35(3): 249-251.
[9]李良铸, 李明晔. 最新生化药物制备技术[M]. 北京: 中国医药科技出版社, 2003: 299-301.
[10]KHALIKOVA E, SUSI P, USANOV N, et al. Purification and properties of extracellular dextranase from a Bacillus sp.[J]. Journal of Chromatography B, 2003, 796(2): 315-326.
[11]BAAKZA A, VALA A K, DAVE B P, et al. A comparative study of siderophore production by fungi from marine and terrestrial habitats [J]. Journal of Experimental Marine Biology and Ecology, 2004, 311 (1): 1-9.
[12]ISMAIL M S, ABDEL-FATTAH A M, ABDEL-FATTAH A F. Preparation and some properties of immobilized Penicillium funiculosum 258 dextranase[J]. Process Biochemistry, 1999, 34(4): 391-398.
[13]EGGLESTON G, MONGE A. Optimization of sugarcane factory application of commercial dextranases[J]. Process Biochemistry, 2005, 40(5): 1881-1894.
[14]程秀兰, 孙晋武, 王海燕, 等. 焦曲霉右旋糖酐酶的纯化和性质[J].微生物学报, 1992, 32(3): 218-226.
[15]张龙翔, 张庭芳, 李令媛. 生化实验方法和技术[M]. 2版. 北京: 高等教育出版社, 1997: 1-3.
[16]文数基. 基础生物化学实验指导[M]. 西安: 陕西科学技术出版社, 1994: 11-14.
[17]姚日生, 董明辉, 朱慧霞. 酶法合成右旋糖酐相对分子质量的控制[J]. 精细化工, 2007, 24(10): 964-967.
Optimizing the Fermentation Conditions of Penicillium funiculosum for Producing Dextranase
ZHU Hui-xia1,WANG Ya-jie2,DENG Sheng-song1,YAO Ri-sheng1,*,ZHANG Hong-bin1
(1. Engineering Research Center of Bioprocess, Ministry of Education, School of Chemical Engineering, Hefei University of Technology, Hefei 230009, China;2. Pharmacy Department, Anhui Medical College, Hefei 230601, China)
This study aimed at investigating the optimal fermentation conditions of Penicillium funiculosum for producing dextranase. The optimal carbon and nitrogen sources were dextran and peptone, respectively. The orthogonal array optimization showed that the optimal fermentation conditions of Penicillium funiculosum were as follows: the volume of the medium contained in a 250 mL Erlenmeyer flask 80 mL; medium initial pH 5.5; and fermentation temperature 28 ℃, and the resultant dextranase was 18.963 U/mL under these conditions.
dextranase;Penicillium funiculosum;orthogonal array design
Q936
A
1002-6630(2010)19-0288-04
2010-06-28
安徽高校省级自然科学研究重点项目(KJ2008A067)
朱慧霞(1977—),女,讲师,博士研究生,主要从事生物发酵与酶工程研究。E-mail:zhx777888@163.com *通信作者:姚日生(1962—),男,教授,博士,主要从事精细化工和药用高分子材料研究。E-mail:yaors@163.com
