裂殖壶菌鲨烯合酶基因的克隆及在大肠杆菌中的表达
2010-09-15朱路英朱清华张学成
朱路英,朱清华,张学成*
裂殖壶菌鲨烯合酶基因的克隆及在大肠杆菌中的表达
朱路英1,2,朱清华3,2,张学成2,*
(1.鲁东大学生命科学学院,山东 烟台 264025;2.中国海洋大学海洋生命学院,山东 青岛 266003;3.德州学院生物系,山东 德州 253023)
为探讨裂殖壶菌烯合酶基因的克隆,以及在大肠杆菌中的表达。采用简并引物与RACE相结合的方法从裂殖壶菌(Schizochytrium limacinum)中克隆出鲨烯合酶基因。分析表明该基因的cDNA全长包括1672个核苷酸,编码一个含446个氨基酸的开放阅读框;在裂殖壶菌中以单拷贝的形式存在。同源分析显示裂殖壶菌鲨烯合酶的氨基酸序列中含有5个保守基序。将裂殖壶菌鲨烯合酶的cDNA序列连接到原核表达载体pGEX-4T-3上构建融合表达载体,并在大肠杆菌BL21中进行IPTG诱导表达,SDS-PAGE及Western blotting分析结果显示,诱导表达出的融合蛋白主要以包涵体的形式存在,其相对分子质量与预期相符;且融合蛋白具有一定的免疫原性。
裂殖壶菌;鲨烯合酶;cDNA克隆;原核表达
鲨烯合酶(squalene synthase,SQS,EC 2.5.1.21)是生物体合成鲨烯的关键酶,催化两分子的法尼基二磷酸缩合产生鲨烯,鲨烯通常再由2,3-氧化鲨烯环化酶催化生成2,3-环氧化鲨烯,然后再进入不同的分枝途径最终生成甾醇或其他三萜化合物[1]。SQS是类异戊二烯途径中合成甾醇类化合物的一种关键的分枝酶,因此,被认为是一种可以控制甾醇类化合物合成的调控位点,从而吸引研究者的兴趣。对鲨烯合酶基因的研究已有一些报道[2-7],但主要局限在几种模式生物及药用植物上;而对微生物,特别是海洋微生物鲨烯合酶基因的研究还不多见。裂殖壶菌(Schizochytrium limacinum)是一类富含DHA的海洋真菌,有研究发现,在某些种的裂殖壶菌体内还存在一定数量的角鲨烯和类胡萝卜素[8],这一研究结果进一步提高了裂殖壶菌的开发应用价值。到目前为止,尚未见殖壶菌鲨烯合酶基因的报导。本研究通过简并引物及RACE法克隆裂殖壶菌鲨烯合酶基因的cDNA序列,并对其在大肠杆菌中的表达进行研究,以期为进一步研究该基因在微生物甾醇合成调控中的作用提供参考。
1 材料与方法
1.1 菌株
裂殖壶菌菌株OUC88、大肠杆菌JM109、表达宿主菌BL21 本实验室保存。
1.2 试剂与仪器
限制性内切酶、DNA连接试剂盒、pMD18-T Takara公司;Taq酶、DNA通用纯化试剂盒、RNA提取试剂盒和逆转录试剂盒 Sangon公司;SMART RACE克隆试剂盒 Clotech公司;pGEX-4T-3 Amersham Pharmacia Biotech公司;DIG-High Prime Kit、DIG Nucleic Acid Detection Kit Roche公司。
K640基因扩增仪 杭州晶格科学仪器有限公司;S.SW-CJ-2FD超净工作台 上海跃进医疗器械厂;HZ100型恒温摇床 武汉瑞华仪器设备有限公司。
1.3 总RNA提取及cDNA第一链合成
取培养2d的裂殖壶菌菌体适量,液氮研磨后加入Trizol,用针筒匀浆,再加入氯仿剧烈振荡,4℃、8000r/min离心5min后取上清加入无水乙醇,混匀后转入UNIQ-10柱中,离心弃废液后,用RPE溶液洗柱两次,最后加入DEPC-H2O将吸附于柱上的RNA洗脱,电泳分析RNA质量。
取总RNA 5μg和Oligo-dT引物混合在cDNA合成Buffer中,70℃变性5min后,加入dNTP和RNA反转录酶,然后37℃温育1h,这样得到cDNA第一链作为模板,进行PCR反应。
1.4 引物设计与RT-PCR
根据已发表的人、酵母等物种的SQS基因序列,设计一对简并引物,序列如下:P1:5'-TA(T/C)TG(T/C) CA(T/C)TA(T/C)GT(T/C/A/G)GC-3';P2:5'-AC(T/C)TG (G/A/T/C)GG(G/A/T)AT(G/A/T/C)GC(G/A)CA(G/A)AA-3'。
利用CLOTECH SMART RACE克隆试剂盒,通过5'-RACE和3'-RACE来获得裂殖壶菌SQS cDNA序列的两个末端,应用的特异序列PCR引物如下:正义引物:5'-TACTGCCCTGCTGACCTTGTGA-3';反义引物:5'-GGAAAGCGAACAGACAGGGTG-3'。
1.5 Southern杂交分析SQS基因的拷贝数
采用CTAB法提取裂殖壶菌基因组DNA,分别用EcoRⅠ、HindⅢ、SalⅠ和XbaⅠ酶切20μg裂殖壶菌基因组DNA,酶切产物经1%琼脂糖凝胶电泳后转移至硝酸纤维素膜上;按照DIG-High Prime Kit操作说明书标记SQS cDNA的402bp片段为探针;Southern杂交和显色按照DIG Nucleic Acid Detection Kit 进行。
1.6 裂殖壶菌SQS与同族其他蛋白的比对和进化分析
采用CLUSTALX和PHYLIP软件对裂殖壶菌SQS cDNA进行序列比对和进化分析。
1.7 原核表达载体的构建
根据已测序确定的裂殖壶菌SQS cDNA进行引物设计,扩增出SQS的编码区全长序列,纯化后连接到融合表达载体pGEX-4T-3的多克隆位点上,构建融合表达载体pGEX-SQS;转化感受态大肠杆菌BL21,PCR筛选重组子,测序鉴定插入DNA片段的基因序列及插入方向。
1.8 融合蛋白的诱导表达和SDS-PAGE电泳分析
含裂殖壶菌SQS cDNA重组质粒的BL21菌株接种于含有氨苄青霉素的培养基中,37℃振荡培养过夜,次日按1:100扩大培养至OD600nm值为0.5,加入IPTG至终浓度为2.0mmol/L继续培养3~4h。离心收集细菌,按萨姆布鲁克等[9]的方法进行SDS-PAGE电泳检测表达情况。
1.9 表达产物的Western blotting分析
按照GST标签纯化树脂说明书中的方法,将表达的重组蛋白进行纯化,按文献[10-11]制备多克隆抗体。取适量经IPTG诱导表达的pGEX-SQS菌体,进行SDS-PAGE蛋白电泳后,转移至硝酸纤维素膜上,用5g/100mL脱脂奶粉封闭过夜。用制备的多克隆抗体做一抗,室温作用1h,PBS洗涤两次;以HRP标记的羊抗鼠IgG作为二抗,室温作用1h,PBS洗涤两次,以DAB显色,观察表达产物。
2 结果与分析
2.1 裂殖壶菌SQS基因全长cDNA序列的克隆

图1 裂殖壶菌鲨烯合酶基因全长cDNA序列及推导的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequence of S.limacinum SQS cDNA
利用简并引物从裂殖壶菌的cDNA中扩增出来一条约400bp的片段,把它连接到pMD18-T载体上进行测序。测序结果通过BLAST比对分析表明,该序列和酵母、烟草、人等生物的SQS序列有较高的同源性,说明它是裂殖壶菌SQS cDNA的一段序列。根据它的核苷酸序列设计出一对特异性引物,利用CLOTECH SMART RACE克隆系统,得到一段cDNA序列的5'末端和3'末端,从而拼接出全长的cDNA序列。这一序列全长为1672bp,其中,阅读框1338bp,编码446个氨基酸,其5'端和3'端分别有一个含35个碱基和299个碱基组成的非编码区,3'末端有真核生物典型的polyA加尾结构,说明它的序列是完整的(图1),其中GenBank登录号为DQ464066,推导的其蛋白质分子质量为47.1kD。
2.2 SQS基因的Southern杂交分析

图2 SQS基因在裂殖壶菌基因组中的Southern杂交结果Fig.2 Southern blot analysis of S.limacinum SQS gene

图3 裂殖壶菌SQS与其他物种SQS的氨基酸序列比对Fig.3 SQS gene-encoded amino acid sequence alignment between Schizochytrium limacinum and other species
分别用EcoRⅠ、HindⅢ、SalⅠ和XbaⅠ酶切20μg裂殖壶菌基因组DNA,以SQS cDNA的402bp特异片段为探针,进行Southern杂交,结果均出现单一条带(图2),表明该基因在裂殖壶菌基因组中以单拷贝形式存在。
另外,在开放阅读框的两端(包括整个ORF)设计一对特异引物,以裂殖壶菌基因组DNA为模板进行PCR扩增,得到一条约1.3kb的片段,回收后连接到T载体上进行测序,发现该序列与SQS的cDNA序列完全一致,说明得到的裂殖壶菌鲨烯合酶基因序列中不含内含子。
2.3 同源性分析
用软件Blastp分析发现,推导的SQS的氨基酸序列与其他已知的SQS序列具有一定的同源性和相似性,但同源性较低,与烟草、酵母、鼠和人SQS序列的同源性分别为38%、37%、40%和39%。与已知的SQS序列相比,裂殖壶菌SQS在Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ区显示出了SQS家族氨基酸序列的保守性(图3),在Ⅱ区存在典型的DXXXDD基序,Ⅳ区有保守的DXXED基序,确认了该序列是SQS家族成员。
2.4 进化分析

图4 鲨烯合酶系统进化分析Fig.4 Phylogenetic tree based on SQS gene-encoded amino acid sequence
运用CLUSTL W程序对裂殖壶菌鲨烯合酶和其他已知的鲨烯合酶氨基酸序列进行系统进化分析,结果如图4所示。裂殖壶菌的鲨烯合酶基因氨基酸序列并没有与酵母等真菌类的鲨烯合酶基因氨基酸序列聚类,而是先与伊氏锥虫、布朗葡萄藻及几种植物的鲨烯合酶基因氨基酸序列聚类,其次再与动物的鲨烯合酶基因氨基酸序列聚类,然后才与酵母等真菌类微生物聚类。这说明裂殖壶菌的鲨烯合酶基因与植物的鲨烯合酶基因在进化源祖上较接近,而真菌中鲨烯合酶基因呈多元分化。2.5目的融合蛋白的表达
在裂殖壶菌SQS基因的开放阅读框两侧设计一对特异引物,分别加上EcoRⅠ和NotⅠ的酶切位点,以裂殖壶菌cDNA为模板,进行PCR扩增。将测序正确的PCR扩增产物定向连接到融合表达载体pGEX-4T-3多克隆位点EcoRⅠ和NotⅠ之间,转化大肠杆菌BL21,用PCR法筛选重组子,经测序鉴定,得到融合表达重组体pGEX-SQS。
收集经IPTG诱导的重组菌体,经超声破壁后,进行SDS-PAGE分析,结果表明在分子质量73kD(pGEX-4T-3中的谷胱甘肽S-转移酶26kD与目的蛋白SQS 47.1kD融合)左右处有一条明显的蛋白条带(图中箭头标示),同预计的大小一致,而空载体及未经IPTG诱导的重组体则没有明显的该条带,表明pGEX-SQS重组质粒在宿主菌BL21中经IPTG诱导能表达融合蛋白。通过比较重组菌体经超声波破碎后的沉淀和上清液的蛋白表达谱,可以看出目的蛋白主要以包涵体的形式存在于破壁沉淀中。

图5 SDS-PAGE电泳检测重组蛋白在E. coli中的表达Fig.5 SDS-PAGE profile of recombinant protein
2.6 表达产物的Western blotting检测
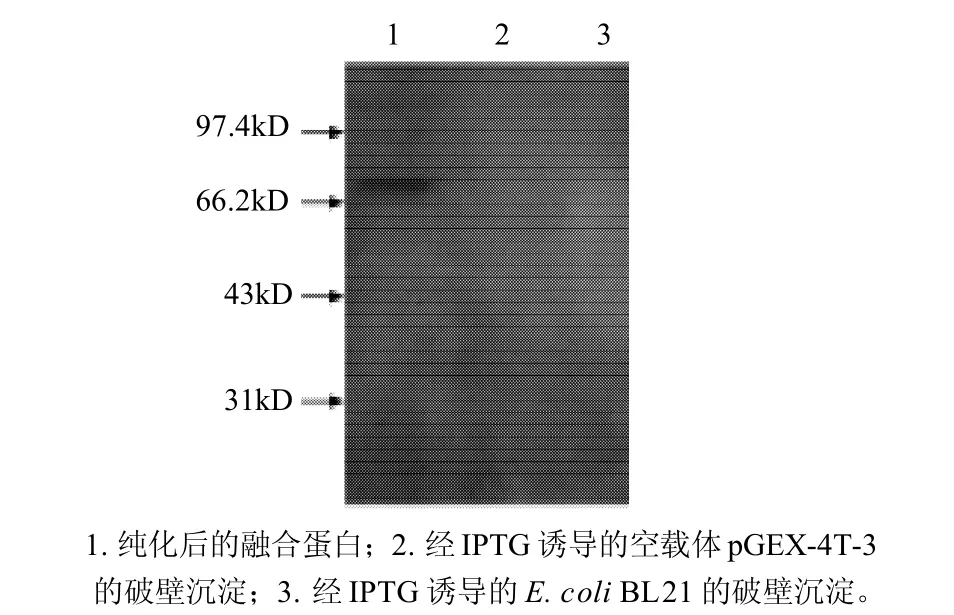
图6 重组蛋白的Western blotting分析Fig.6 Western blotting Identification of recombinant protein
为了验证表达蛋白的正确性,将融合蛋白经GST标签纯化树脂进行纯化,纯化后的融合蛋白进行Westernblotting检测。结果显示,融合蛋白能特异性地与所制备的多克隆抗体进行抗血清反应,在分子质量约73kD处出现了一条特异反应带,携带空载体的菌株蛋白样品结果为阴性(图6),进一步证实了所表达蛋白的正确性并表明其具有免疫原性。
3 讨 论
目前,已有十几个物种的SQS基因被克隆出来,其拷贝数在不同的物种中有所不同。其中,人和酵母的SQS基因都以单拷贝的形式存在[12-13],而辣椒和绿藻Botryococcus braunii等物种的SQS基因至少为两个拷贝[2-3]。本研究发现裂殖壶菌的SQS基因以单拷贝的形式存在,且不含内含子。这说明SQS基因具有多样性。SQS基因的另一个特点是植物、动物和真菌之间的SQS氨基酸序列相似性比较低,同源性在35%~40%之间,但在植物之间(烟草与拟南芥)、动物之间(人与鼠)相似性较高,而真菌中呈多元分化的趋势[14]。研究表明裂殖壶菌的SQS基因的氨基酸序列与烟草、酵母、鼠和人SQS序列的同源性分别为38%、37%、40%和39%,均不是很高,这与前人的研究结果一致[14]。比较不同物种的SQS氨基酸序列,发现有6个比较保守的区域,其中区域Ⅰ保守性较差,而Ⅱ、Ⅲ、Ⅳ和Ⅴ区高度保守,这4个区域被认为与该酶的催化活性相关[15]。其中,Ⅱ区和IV区分别存在着富含天冬氨酸残基的序列DXXEDD和DXXED,这两个区被认为是底物法尼基二磷酸的结合位点[16];Ⅲ区和Ⅴ区被认为是酶活性中心的催化位点,位点突变分析证实Ⅲ区中保守的酪氨酸(Tyr)和Ⅴ区中的苯丙氨酸(Phe)和谷氨酸(Glu)对保持SQS酶活性具有关键作用[17]。Ⅵ区(C末端区)的保守性最低,但含有一个高度疏水序列,被认为与酶和内质网膜的结合有关,可能是鲨烯合酶的一个膜靶位点和锚定信号[2,17]。本研究发现,裂殖壶菌的SQS氨基酸序列也含有这6个保守区域,其中,Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ区保守性较高,而且在Ⅱ区和Ⅳ区也分别存在着典型的DXXXDD和DXXED基序;Ⅵ区的保守性很低,但仍为一个疏水区域。这些结果与相关文献相符。
总之,本研究通过简并引物与RACE相结合的方法克隆出了裂殖壶菌鲨烯合酶基因的全长cDNA片段,同源性分析发现它是SQS基因家族的新成员;并对其编码区进行了原核表达,为下一步的功能分析以及进一步研究该基因在裂殖壶菌甾醇合成调控中的具体作用提供资料。
[1]布坎南B B, 格鲁依森姆W,琼斯R L. 植物生物化学与分子生物学[M]. 瞿礼嘉, 顾红雅, 白书农, 等, 译. 北京: 科学出版社, 2004: 1035-1036.
[2]LEE J H, YOON Y H, KIM H Y, et al. Cloning and expression of squalene synthase cDNA from hot pepper[J]. Mol Cells, 2002, 13(3): 436-443.
[3]OKADA S, DEVARENNE T P, CHAPPELL J. Molecular characterization of squalene synthase from the green microalga Botryococcus braunii, race B [J]. Archives of Biochemistry and Biophysics, 2000, 373(2): 307-317.
[4]LIU Yan, YE Hechun, WANG Hong, et al. Molecular cloning, Escherichia coli expression and genomic organization of squalene synthase gene from Artemisia annua[J]. Acta Botanica Sinica, 2003, 45(5): 608-613.
[5]冯丽玲, 卢文婕, 曾庆平. 啤酒酵母鲨烯合酶基因的克隆及其基因表达载体的构建[J]. 广州中医药大学学报, 2009, 26(4): 394-397.
[6]戴住波, 钱子刚, 胡运乾, 等. 金铁锁鲨烯合酶cDNA的克隆和功能鉴定[J]. 药学学报, 2008, 43(12): 1245-1250.
[7]李娜, 王世明, 陈军, 等. SEFA-PCR 法克隆灵芝鲨烯合酶基因启动子及其序列分析[J]. 菌物学报, 2006, 25(4): 592-598.
[8]YUE Jiang, KING Waifan, RAYMOND T S Z, et al. Fatty acid composition and squalene content of the marine microalga Schizochytrium mangrovei[J]. J Agric Food Chem, 2004, 52(5): 1196-1200.
[9]萨姆布鲁克J, 拉塞尔D W. 分子克隆实验指南[M]. 黄培堂, 译. 3版. 北京: 科学出版社, 2002.
[10]HE Xianhui, XU Lihui, LIU Yi. Procedure for preparing peptidemajor histocompatibiliy complex tetramers for direct quantification of antigen - specific cytotoxic T lymphocytes[J]. World J Gastroenterol, 2005, 11(27): 4180-4187.
[11]徐丽慧, 洪岸, 何贤辉, 等. 重组人bFGF的原核表达及其高效价抗血清的制备[J]. 免疫学杂志, 2005, 21(3): 186-189.
[12]JENNINGS S M, TSAY Y H, FISCH T M, et al. Molecular cloning and characterization of the yeast gene for squalene synthase[J]. Proc Natl Acad Sci USA, 1991, 88(6): 6038-6042.
[13]SUMMERS C, KARST F, CHARLES A D. Cloning, expression and characterization of the cDNA encoding human hepatic squalene synthase, and its relationship to phytoene synthase[J]. Gene, 1993, 136(2): 185-192.
[14]赵明文, 钟家禹, 王南, 等. 鲨烯合酶的研究进展[J]. 微生物学报, 2003, 43(5): 676-680.
[15]ROBINSON G W, TSAY Y H, KIENZLE B K. Conservation between human and fungal squalene synthase: similarities in structure, function, and regulation[J]. Mol Cell Biol, 1993, 13(5): 2706-2717.
[16]TANSEY T R, SHECHTER I. Structure and regulation of mammalian squalene synthase[J]. Biochim Biophys Acta, 2000, 1529(1/3): 49-62.
[17]GUAN Guimin, DAI Peihua, OSBORNE T F, et al. Multiple sequence elements are involved in the transcriptional regulation of the human squalene synthase gene[J]. J Biol Chem, 1997, 272(8): 10295-10302.
Cloning and Prokaryotic Expression of Squalene Synthase Gene from Schizochytrium limacinum
ZHU Lu-ying1,2,ZHU Qing-hua3,2,ZHANG Xue-cheng2,*
(1. School of Life Sciences, Ludong University, Yantai 264025, China;2. College of Marine Life Sciences, Ocean University of China,Qingdao 266003, China;3. Department of Biology, Dezhou College, Dezhou 253023, China)
A full length cDNA of squalene synthase (SQS) gene was isolated from Schizochytrium limacinum using homologybased cloning and RACE methods. Molecular biological analysis showed that the full length cDNA was of 1672 bp, with a 1338 bp open reading frame encoding 446 amino acids, and the SQS gene was a single copy gene in Schizochytrium limacinum. Homology analysis showed that Schizochytrium limacinum SQS cDNA had five consensus regions. The SQS cDNA was constructed into the prokaryotic expression vector pGEX-4T-3 and expressed in E.coli BL21. SDS-PAGE and Western blotting analyses showed that the recombinant protein was mainly in the form of inclusion body, of which molecular weight was as expected, and had good immunogenicity.
Schizochytrium limacinum;squalene synthase;cDNA cloning;prokaryotic expression
Q786
A
1002-6630(2010)19-0263-05
2010-06-27
鲁东大学校基金项目(LY20063307);鲁东大学学科建设经费资助项目
朱路英(1974—),女,讲师,博士,研究方向为生物化学。E-mail:lyzhu@126.com
*通信作者:张学成(1939—),男,教授,硕士,研究方向为海洋生物学。E-mail:xczhang@ouc.edu.cn
