不同成熟期栀子果实有效成分累积的研究
2010-09-15何国振汤丽云马力敏徐鸿华
何国振,周 妹,汤丽云,马力敏,徐鸿华
1广州中医药大学中药学院,广州 510006;2华南农业大学生命科学学院,广州 510642
不同成熟期栀子果实有效成分累积的研究
何国振1*,周 妹1,汤丽云2,马力敏1,徐鸿华1
1广州中医药大学中药学院,广州 510006;2华南农业大学生命科学学院,广州 510642
根据果实颜色可以将栀子成熟期划分为全青期、2/3青 1/3黄期、半青半黄期、1/3青 2/3黄期、全黄期、枯黄期。采用 HPLC法测定栀子果实在不同成熟时期 3种主要有效成分栀子苷、绿原酸、西红花苷-1的含量。结果表明:栀子苷、绿原酸、西红花苷-1含量均出现两个高峰期,峰形陡峭;高峰出现的时期不完全一致。栀子苷的含量在全青期和 1/3青 2/3黄期最高,而西红花苷-1的含量在全青期和全黄期最高。全青期为栀子苷和西红花苷-1的最佳采收期。根据果实颜色及时采收才能获得高含量的目标活性成分。
栀子苷;绿原酸;西红花苷-1;最佳采收期;含量测定
栀子为茜草科植物栀子Gardenia jasm inoidesEllis的干燥成熟果实,具有泻火除烦,清热利尿,凉血解毒等功效[1]。化学成分研究表明,栀子中含有 3类主要有效成分,即环烯醚萜苷类,有机酸类和色素类。栀子苷、绿原酸和西红花苷-1分别为 3类成分的主要物质[2]。为了获得高含量栀子有效成分,近年来人们研究了不同采收期对栀子苷含量的影响[3,4],认为不同采收期栀子中栀子苷、熊果酸的含量有显著变化,并各自对合理采收期提出了不同的建议。栀子质量的优劣应是多种成分的综合表现。从栀子果实的不同发育期研究其主要药效成分的动态变化规律,对控制栀子的质量具有重要意义。
栀子果实的体积达到最大后,进入成熟期。整个成熟期的栀子果实颜色经历全青到枯黄的变化。本文以栀子果实不同颜色细分其成熟期,测定果实中栀子苷、绿原酸和西红花苷-1等 3种成分的含量,探索这些成分的动态变化规律,为科学确定栀子的采收期、获得高含量有效成分栀子作参考。本研究未见报道。
1 仪器与试药
1.1 仪器
LC2000高效液相色谱输液泵;L2030紫外检测器;L2200自动进样器;T2000P色谱工作站 (上海天美科学仪器有限公司)。
1.2 试剂
栀子苷,绿原酸和西红花苷-1对照品购自中国药品生物制品检定所,批号分别为 110749-200613, 110753-200413,111588-200501。乙腈为色谱纯(Merck,Ger many),其余试剂均为分析纯。
1.3 样品
不同颜色的栀子果实于 2008年 10月 21日采自广东省梅州市平远县黄花陂栀子 GAP基地。在约 120株植株上随机采集各颜色果实,混合后按颜色分成 6组,即:全青 (1)、2/3青 1/3黄 (2)、半青半黄 (3)、1/3青 2/3黄 (4)、全黄 (5)、枯黄 (6)(见彩图)。原植物经作者鉴定为茜草科植物栀子Gardenia jasm inoidesEllis。
2 方法与结果
2.1 色谱条件
色谱柱 PhenomenexLuna C18(25 mm×4.6 mm, 5μm),SecurityGuard Analytical(KJ0-4282)。栀子苷:流动相乙腈-水(15∶85),检测波长 238 nm,流速1.0 mL/min;绿原酸:流动相乙腈-0.4%磷酸 (13∶87),检测波长 327 nm,流速 0.8 mL/min;西红花苷-1∶流动相乙腈-水 (23∶77),检测波长 440 nm,流速1.0 mL/min。柱温均为室温。对照品及样品的分离情况见图 1~3。
2.2 对照品溶液的制备
精密称取栀子苷、绿原酸和西红花苷-1对照品适量,于容量瓶中分别加入甲醇、70%甲醇和 50%甲醇制成含栀子苷 0.202 mg/mL、绿原酸 0.03384 mg/ mL和西红花苷-1 0.0654 mg/mL的对照品溶液。

图 1 栀子苷对照品和栀子样品HPLC图谱Fig.1 Typical HPLC chromatograms of authentic geniposide and the extract ofGardenia jasm inoidesEllis.

2.3 供试品溶液的制备
栀子经干燥后粉碎,过四号筛,得栀子粉末。
2.3.1 栀子苷样品溶液的制备
精密称取栀子粉末 0.1 g,置于具塞锥形瓶中,加入甲醇 25.0 mL,加塞,称重。超声处理 20 min,冷却,再称重。用甲醇补足失重,摇匀。进样前用0.45μm微孔滤膜过滤。
2.3.2 绿原酸样品溶液的制备
精密称取栀子粉末 0.5 g,置于具塞锥形瓶中,加入 70%甲醇 25.0 mL,加塞,称重。超声处理 20 min,冷却,再称重。用 70%甲醇补足失重,摇匀。进样前用 0.45μm微孔滤膜过滤。
2.3.3 西红花苷-1样品溶液的制备
精密称取栀子粉末 0.1 g,置于具塞锥形瓶中,加入 50%甲醇 25.0 mL,加塞,称重。超声处理 40 min,冷却,再称重。用 50%甲醇补足失重,摇匀。进样前用 0.45μm微孔滤膜过滤。
2.4 线性范围考察
精密吸取栀子苷对照品溶液 1、3、7、10、20μL,绿原酸对照品溶液 1、5、10、15、20μL,西红花苷-1对照品溶液 1、3、7、10、20μL,进样,测定色谱峰面积,以进样量(X)对峰面积(Y)进行线性回归,回归方程如表 1。

表 1 3种活性化合物的回归曲线(n=5)Table 1 Calibration curve for the three active compounds(n=5)
2.5 精密度试验
精密吸取上述各对照品溶液 10μL,连续进样 6次,以各成分峰面积计算 RSD,所得结果:栀子苷0.47%,绿原酸 2.47%,西红花苷-1 1.95%。结果表明精密度良好。
2.6 稳定性试验
精密吸取上述各对照品溶液 10μL,按 0、2、4、8、12 h分别进样分析,测定峰面积值。三种成分的结果分别为:栀子苷 RSD 1.57%、绿原酸 RSD 1.50%、西红花苷-1 RSD 1.81%。表明栀子苷,绿原酸和西红花苷-1在 12 h内均稳定。
2.7 重复性试验
取同一批栀子药材 18份,精密称定,照供试品溶液制备方法制备,分别取 10μL进样分析,测定栀子苷、绿原酸和西红花苷-1含量,栀子苷 RSD为1.85%,绿原酸 RSD为 2.17%,西红花苷-1 RSD为1.56%,表明该方法重复性良好。
2.8 加样回收率试验
精密称取已知含量的供试品定量,分别精密加入栀子苷、绿原酸及西红花苷-1对照品溶液适量,按供试品溶液制备方法分别处理,同法测定含量,计算得栀子苷平均回收率为 101.44%,RSD为 1.16 %;绿原酸平均回收率为 99.87%,RSD为 2.77%;西红花苷-1平均回收率为 101.02%,RSD为 2.01 %。测定结果见表 2。
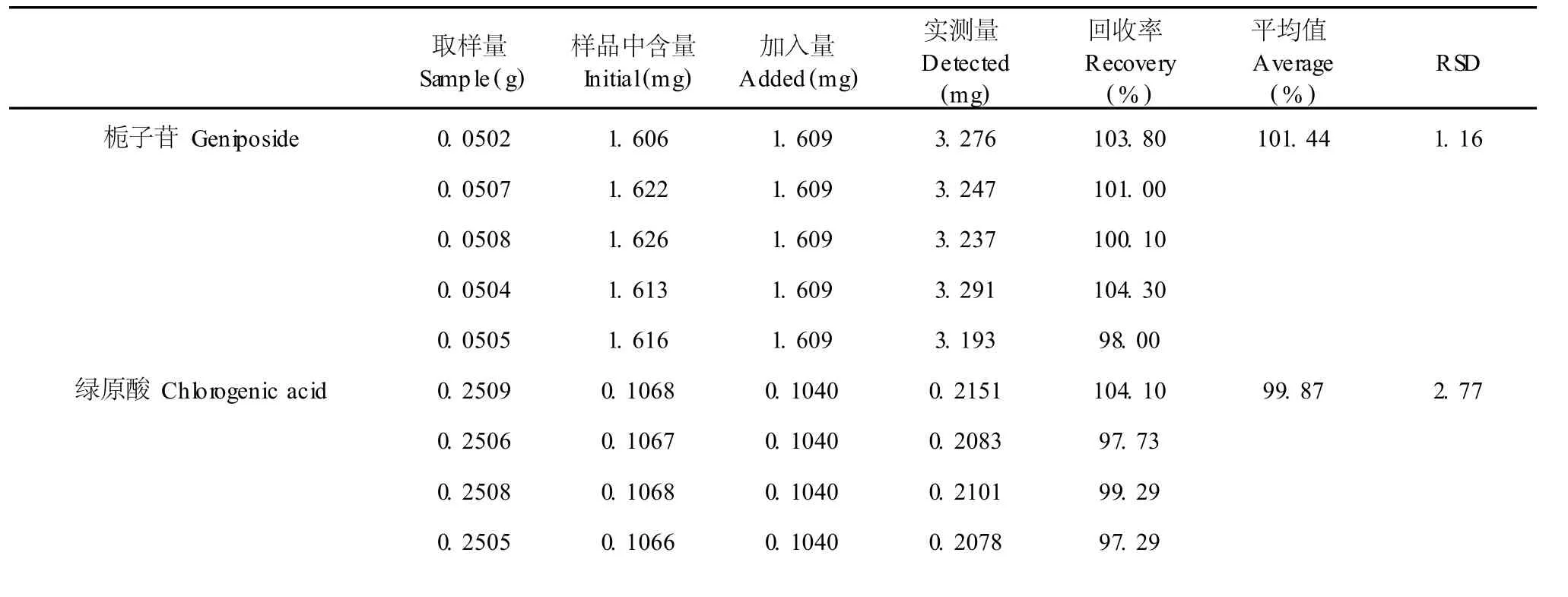
表 2 加样回收率试验结果 (n=5 or 6)Table 2 Results of recovery test(n=5 or 6)
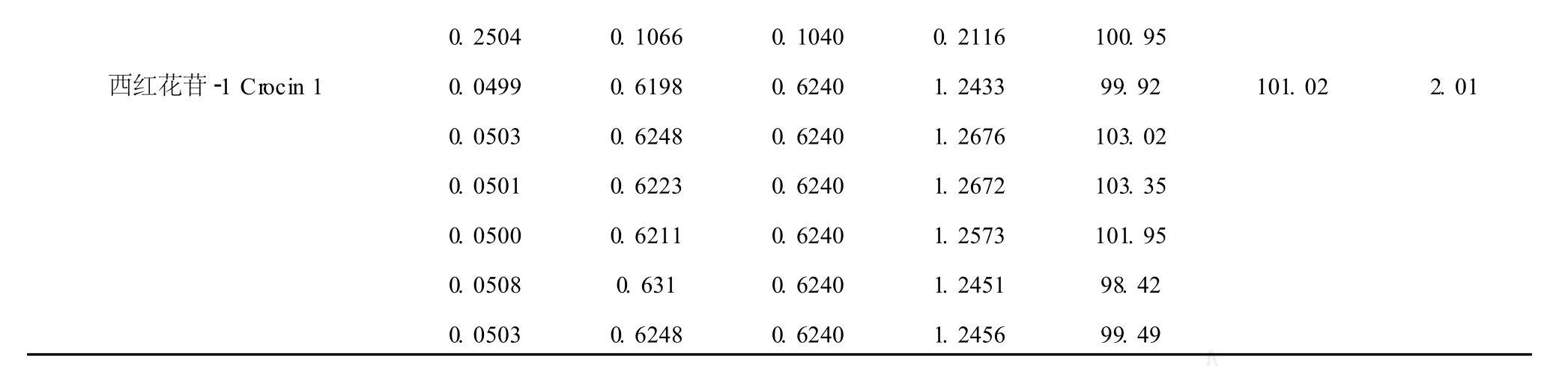
0.2504 0.1066 0.1040 0.2116 100.95西红花苷-1 Crocin 1 0.0499 0.6198 0.6240 1.2433 99.92 101.02 2.01 0.0503 0.6248 0.6240 1.2676 103.02 0.0501 0.6223 0.6240 1.2672 103.35 0.0500 0.6211 0.6240 1.2573 101.95 0.0508 0.631 0.6240 1.2451 98.42 0.0503 0.6248 0.6240 1.2456 99.49
2.9 样品测定
取不同颜色栀子果实干燥粉末(过四号筛)各 3份,精密称定,按 2.3项下方法制备各供试品溶液,分别精密吸取各供试品溶液 10μL进样,测定结果见图 4~7。
3 讨论
3.1 预实验时考察了超声、回流处理对绿原酸和西红花苷-1提纯效果的影响,2种成分 2种提取方法提取率均相当,但超声提取法操作更简便,因此采用超声提取样品;提取溶剂考察结果显示 70%甲醇对绿原酸的提取率最高,而 50%甲醇对西红花苷-1的提取率最高;提取时间考察结果显示 20 min对绿原酸提取完全,对西红花苷-1则是 40 min;考察冰浴与室温对西红花苷-1的提取效果,结果显示室温提取率较高且操作简便,因此采用室温提取。


3.2 文中建立的各色谱方法适用于各成分的测定,由图 1,2,3可以看出供试品中各组分与其他组分均达到基线分离,且基线平稳。虽然现有很多文献[5]采用DAD检测器同时测定栀子中多种成分,但是每种成分分别在最佳提取及分离条件下测定而得到的含量应该更准确。
3.3 图 4的结果表明,栀子苷在栀子果实成熟过程中出现两个含量高峰,一个高峰出现在果实达到最大体积、颜色为青色时;另一个高峰出现在果实完全成熟之前,即颜色为 1/3青 2/3黄时;因而栀子苷的累积规律表现为“高-低-高-低”的趋势。付小梅等[3]也认为栀子苷在果实发育期有两个高峰。绿原酸在整个栀子果实成熟过程中,也有两个含量高峰,第一个较小,第二个出现在果实完全成熟之前,与栀子苷的第二个高峰重叠(图 5)。西红花苷 -1与栀子苷的累积规律相似,同样有两个含量高峰,第一个高峰与栀子苷的第一个高峰重叠,但第二个高峰出现在果实完全成熟、即果实颜色为全黄色时(图 6)。同时比较三种活性成分的累积规律 (图7),可以看出,绿原酸在三种活性成分中的相对含量最低,栀子苷的相对含量最高。三种成分的累积高峰都比较陡峭。
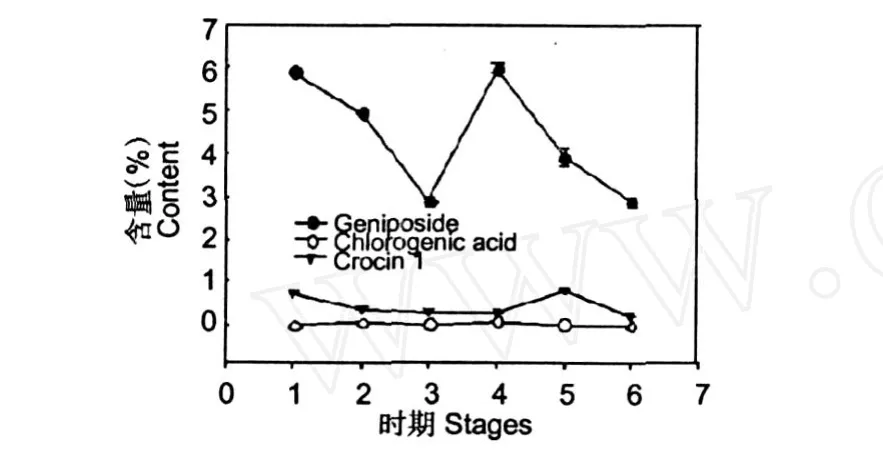
图7 不同发育时期栀子果实中三种有效成分的含量变化Fig.7 Dynamic variation of the content of three active compounds from the fruits ofGardenia jasm inoidesin different ripening stages
本研究是以果实的颜色来划分栀子果实发育过程,并同时考察栀子苷、绿原酸和西红花苷-1等三种活性成分的累积规律。以颜色划分果实发育过程并考察活性成分含量,比考察不同采收期仅栀子苷的含量要更能全面、准确反映活性成分的累积规律。
详细研究栀子活性成分在果实发育过程中的累积规律,可以为栀子的采收提供更加科学的依据。药典仅规定了栀子苷的含量作为有效成分的指标,因此在全青期和 1/3青 2/3黄期都可以采收。由于西红花苷的抗氧化作用的发现[6],该类化合物的药理作用越来越受到重视。根据西红花苷-1的累积规律,如果需要获得西红花苷-1高含量的果实,则应在栀子全青或全黄期采收。
由于三种活性成分的累积高峰都表现得比较陡峭,因而根据每一个果实的颜色来适时采收,才能获得最高含量的目标活性成分。
致谢:广州中医药大学中药学院 2005级学生林诗东和谭宏韬协助采集本研究的材料。
图 8 不同发育时期的栀子果实Fig.8 Fruits ofGardenia jasm inoidesin different developing stages
1 Ch P(中国药典).Beijing:Chemistry Industry Press,2005. 173.
2 Xu J(徐娟),Tu BK(涂炳坤),Deng XZ(邓先珍),et al. Advances on development and utilization of compositions withinGardenia jasm inoides.Hubei Forestry Sci Tech(湖北林业科技),2005,136:42-43.
3 Fu XM(付小梅),Chu XL(褚小兰),Fan JS(范佳生),et al.Content analysis on gardenoside in grown and ungrown fruits of gardenia from different habitats.J ChinM edM at(中药材),2000,23:754.
4 Zhao J(赵静),You GJ(游国钧),Li H(李辉).Deter mination of jas minoidin in gardenia at different culling period.Guiding J TCM(中医药导报),2007,13(7):102.
5 HeML,Cheng XW,Chen JK.Simultaneous deter mination of five major biologically active ingredients in different parts ofGardenia jasm inoidesfruits byHPLC withDiode-Array detection.Chrom atographia,2006,64:713.
6 Chen Y,Zhang H,Tian X,et al.Antioxidant potential of crocins and ethanol extracts ofGardenia jasm inoidesELL IS andCrocus sativusL.:A relationship investigation be tween antioxidant activity and crocin contents.Food Chem istry,2008, (109):484-492.
Studies on the Accumulation ofMajor Active Compounds from Gardenia jasm inoidesFruits in D ifferent Ripen ing Stages
HE Guo-zhen1*,ZHOU Mei1,TANGLi-yun2,MA Li-min1,XU Hong-hua1
1College of Traditional ChineseM edicine,Guangzhou University of ChineseM edicine,Guangzhou 510006,China;2College of L ife Science,South China Agricultural University,Guangzhou 510642,China
According to the color,the whole ripening stage of gardenia(Gardenia jasm inoidesEllis)fruit can be divided into stages of cyan,2/3 cyan and 1/3 yellow,half of cyan and yellow,1/3 cyan and 2/3 yellow,yellow and scorch.The contents of three major bioactive compounds of geniposide,chlorogenic acid and crocin-1 were determined by HPLC method.The result shows that two accumulation peaks of each bioactive compound appeared during ripening stage.The shapes of all the peakswere sharp.And the stageswhich peaks appeared were not exact the same.The peaks of geniposide appeared at cyan stage and stage of 1/3 cyan and 2/3 yellow,whereas the peaks of crocin-1 appeared at cyan and yellow stages.The best harvesting time should be decided by colorof each fruit,and cyan stage should be the t ime for geniposide and crocin-1.To obtain higher content of target bioactive compound,fruits should be collected in t ime.
geniposide;chlorogenic acid;crocin-1;best harvesting stage;content deter mination
R284.1;Q946.91
A
1001-6880(2010)04-0678-05
2009-06-15 接受日期:2009-09-08
广东省重大科技专项 (2007A032200001);广州市科技攻关重大项目(2007Z1-E5035)
*通讯作者 Tel:86-20-39358553;E-mail:heguozhen@yahoo.com
