香螺血清、肌肉和唾液腺凝集素凝集性能的初步研究
2010-09-15许高云饶小珍陈寅山
陈 琳,许高云,饶小珍,陈寅山
福建师范大学生命科学学院,福建闽侯 350108
香螺血清、肌肉和唾液腺凝集素凝集性能的初步研究
陈 琳,许高云,饶小珍,陈寅山*
福建师范大学生命科学学院,福建闽侯 350108
研究香螺 (Naptunea cum ingicrosse)肌肉、血清和唾液腺凝集素对 7种脊椎动物红细胞、人的 4种红细胞、4种单细胞藻类和 11种微生物细胞的凝集性能,同时进行 pH敏感性、热稳定性、糖抑制性、EDTA、金属离子以及盐浓度影响试验。结果表明,3种凝集素对各种细胞的凝集效应存在差异,以家兔红细胞的凝集效果最佳。肌肉和血清凝集素在 pH<7.0时均失活,唾液腺凝集素的热稳定性最强,温度为 90℃仍具有活性。此外,不同的糖溶液对3种凝集素凝集效果的影响不同,在 EDTA浓度为2.00~0.25 mmol/L范围内,3种凝集素的凝集效价均受到不同程度的抑制。在金属离子影响试验中发现,Zn2+能明显提高肌肉和血清凝集素的凝集活力,而对唾液腺凝集素有抑制的作用。当盐浓度为 12~18 g/L时,可增加香螺肌肉凝集素的凝集效价,而当浓度为 24~60 g/L时却会抑制肌肉凝集素的凝集活性。
香螺;凝集素;凝集活力;性质
凝集素是一类具有糖结合专一性的糖蛋白或蛋白质,其不仅能够区分不同的单糖,同时能够特异性连接不同低聚糖,检测糖复合物结构的细微不同[1],这使它们成为生物化学、细胞生物学、免疫学及医学领域研究的有用工具[2]。凝集素广泛存在于生物体中,目前在动物、植物、微生物中均有发现,其中以植物凝集素的研究最早、最多,近年来由于发现凝集素在无脊椎动物中具有重要的作用[3],无脊椎动物凝集素逐渐成为研究的热点。
香螺 (N.cum ingicrosse)是属于腹足纲 (Gastropoda),前鳃亚纲 (Prosobranchia),狭舌目 (Stenoglossa),蛾螺科 (Buccinidae)的温带海水螺类,是我国沿海重要的海产螺类,个体大,足部肌肉肥大,有较大的经济价值,其凝集素研究至今未见报道。本文从香螺血清、足部肌肉、唾液腺中提取凝集素,研究其对 7种脊椎动物红细胞、人的 4种红细胞、4种单细胞藻类和 11种微生物细胞的凝集性能,同时进行pH敏感性、热稳定性、糖抑制、EDTA、金属离子以及盐浓度影响试验,为寻找凝集素来源及探讨凝集反应发生的复杂生理机制提供基础资料,也为进一步的分离纯化凝集素、开发凝集素的新来源提供科学依据。
1 材料和方法
1.1 材料
香螺购自福州市西营里农贸市场。家兔 (O ryctolagus cuniculus)由福建医科大学实验动物房提供,家鸡(Gallus gallus),半番鸭(Carina m oschata),家鸽(Colum ba livia dom estica),鹌鹑(Coturnix coturnix),白鲢(Hypophtha lm ichthys m olitrix)等 5种动物血样取自福州市闽侯上街农贸市场,小鼠(M us m usculus)由福建师范大学发育生物学实验室提供,人的A型、B型、AB型、O型等 4种血样的全血由福州市第二医院提供。各种单细胞藻类由福建师范大学藻类学实验室提供,微生物菌种由本实验室提供。
1.2 凝集素的制备
将香螺洗净,用滤纸吸干其表面水分,砸开螺壳,收集其血液以 8000 r/min,4℃离心 20 min,离心后取上清液,为血清凝集素,4℃保存备用。另外分别取下肌肉、唾液腺,组织捣碎机充分捣碎后放入烧杯,按 1:1(v/v)加入 PBS缓冲液,搅拌后用保鲜膜封口,4℃静置过夜。第二天取出分别以 10000 r/ min,和 15000 r/min 4℃离心 20 min,然后分别取上清液即为肌肉凝集素和唾液腺凝集素,4℃保存备用。
1.3 蛋白质含量的测定
采用考马斯亮蓝法测定 3种凝集素的蛋白质含量,以结晶牛血清蛋白(BSA)为标准蛋白。
1.4 凝集实验
1.4.1 动物和人血细胞凝集实验
动物血样(用 3.8%柠檬酸钠抗凝)以及人的A型、B型、AB型、O型等4种血样的全血经1500 r/ min离心 5 min除去血浆,用生理盐水离心洗涤 3次,再用生理盐水配制成体积分数为 2%的细胞悬浮液,供实验用。
凝集反应在 96孔V型微量血凝板中进行。先在每孔中加入 25μL生理盐水,再往第一孔中加入25μL凝集素,混匀后,从第一孔中吸取 25μL加入第二孔中,以此类推做倍比稀释,最后在每孔中分别加入 25μL 2%红细胞悬浮液,以 25μL的生理盐水作对照,均匀摇动 1 min,在室温下静置 2 h,肉眼或显微镜下观察实验结果。
1.4.2 单细胞藻类的凝集实验
海产小球藻 (Chlorella vulgaris)、心形扁藻(Platym onas cordifor m is)、云微藻(Chlorella sp.)、金藻(Porphyridium purpureum)用无菌海水离心洗涤 2次再稀释配成藻类细胞悬液,最终浓度为 8.0×106个∕mL。凝集实验在双凹片上进行,先取 40μL样品,然后再加入等量的单细胞藻悬液,混匀 2 h后镜检结果。用等量的无菌海水代替样品溶液作为对照。
1.4.3 细菌和真菌的凝集实验
大肠杆菌 (Escherichia coli.)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(B acillus subtilis)、甘薯薯瘟病原细菌(Fasarium axyssporam)、绿脓杆菌(Pseudom onas eruginosa)用牛肉膏蛋白胨培养基活化,以 0.85%无菌生理盐水配成终浓度为108个 /mL的菌悬液。青霉 (Penicilliumchrysogenum.)、黑曲霉(Aspergillus niger)、根霉(Rhizopus stolonoifer.)、玉米大斑病菌(Helm inthos porium)、稻瘟病病菌(Piricularia oryzae)则用孟加拉红培养基活化,再以无菌生理盐水配成 108个/mL的孢子悬液。凝集实验在双凹片上进行,方法同上,针对不同的菌种,分别用等量的无菌生理盐水代替样品溶液作为对照。
1.5 理化性质实验
1.5.1 温度和 pH敏感性实验
3种凝集素各用 EP管分装 7管,再分别放入30、40、50、60、70、80、90℃恒温水浴锅中 15 min,在V型微量血凝板中进行倍比稀释,用家兔红细胞悬浮液检测其凝集活性的变化情况,以不做任何处理的样品做对照。
把各凝集素 pH调至 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0,4℃放置 2 h后,再将各溶液的pH调回7.2,然后在V型微量血凝板中测定各样品的凝集活力。需以未处理过的样品做对照。
1.5.2 糖抑制实验
将D-葡萄糖(D-glucose)、蔗糖(Sucrose)、D-半乳糖 (D-galactose)、D-乳糖 (D-lactose)、D-甘露糖(D-m annose)、D-树胶醛糖 (D-A rabinose)、木糖(Xy-lose)、果糖(Fructose)、麦芽糖(M altose)等 9种糖配成浓度均为 0.2 mol/L的糖溶液。在V型微量血凝板中将 3种凝集素进行倍比稀释后,向每孔中各加入 25μL的糖溶液,均匀摇动 1 min,静置 1 h后再加入25μL的家兔红细胞悬浮液,2 h后观察实验结果。用生理盐水代替糖溶液作空白对照。
1.5.3 EDTA、金属离子和盐度的影响实验
用 EDTA的钠盐配置浓度分别为 2.00、1.00、0.50、0.25 mmol/L的 EDTA溶液,凝集实验方法同糖抑制实验,观察不同浓度的 EDTA对凝集性能的影响。以生理盐水代替 EDTA溶液作为空白对照组。
用 CaCl2、ZnCl2、MnCl2·4H2O和MgCl2·6H2O分别配成浓度为 0.01 mol/L的溶液,方法同上,观察不同金属离子对凝集性能的影响。用生理盐水代替金属溶液作空白对照。
将样品用盐度为 6、12、18、24、30、36、48(g/L)等不同浓度的盐水进行倍稀释后,检测对兔红细胞的凝集活性。以生理盐水代替盐溶液做对照实验。
2 结果与分析
2.1 蛋白质含量
所提取的肌肉粗蛋白的浓度为 21.61 mg/mL,血清粗蛋白的浓度为 1.47 mg/mL,唾液腺粗蛋白的浓度为 4.68 mg/mL。
2.2 对动物和人血细胞的凝集作用
香螺肌肉、血清和唾液腺等 3种凝集素对11种血细胞的凝集结果见表 1,结果显示,肌肉和血清凝集素对兔血的凝集活力最强,发生凝集所需的最低蛋白质浓度分别为 0.169 mg/mL和 0.735 mg/mL,肌肉凝集素对半番鸭、家鸽、鹌鹑的血细胞无凝集活性,对小鼠和人的 4种红细胞发生凝集反应的所需的最低蛋白质浓度在 1.351~2.702 mg/mL之间。血清凝集素只对兔血和人的 A型血细胞有凝集活力,唾液腺凝集素对家鸡、半番鸭、家鸽、鹌鹑亦无凝集活力。以后实验中均以 2%兔血红细胞作为指示细胞。

表 1 香螺 3种凝集素对 11种红细胞的凝集活性Table 1 The agglutinating activities of 3 agglutinins fromN.cum ingicrosse on 11 kinds of erythrocytes
2.3 对单细胞藻类和微生物的凝集作用
由表 2和表 3可知,3种凝集素对不同微生物的凝集效价不同,肌肉凝集素只对海产小球藻、金藻发生凝集,血清凝集素只对心形扁藻无凝集,唾液腺凝集素则对各种单细胞藻类和微生物细胞均无凝集作用。肌肉凝集素对绿脓杆菌无凝集作用,对根霉和稻瘟病病菌有凝集作用。血清凝集素对真菌也均无凝集作用。
2.4 pH和温度对凝集活性的影响
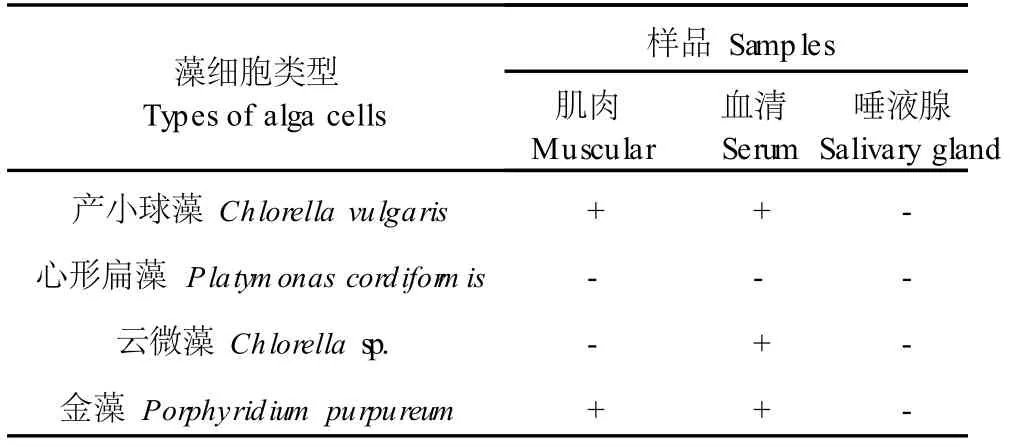
表 2 香螺 3种凝集素对单细胞藻类的凝集作用Table 2 The agglutinating activities of 3 agglutinins fromN. cum ingicrosse on alga cells
实验设置的 8个 pH(3.0~10.0)和 7个实验温度(30~90℃)对 3种凝集素凝集活性影响见表 4。结果显示,香螺的肌肉和血清凝集素均不耐酸而耐碱,当 pH <7.0时均失活,而 pH >7.0时都具有活力,其中肌肉凝集素在 pH=8.0时活性有明显的提高,发生凝集的最低蛋白质浓度只需 0.006 mg/mL。唾液腺凝集素表现出很强的酸碱耐受性,pH 3.0~ 9.0范围内都具有活性。温度方面,当温度在 50℃之后,肌肉凝集素开始没有凝集活力,血清则在 40℃起就无凝集效果,而不同温度处理后的唾液腺凝集素的凝集活性变化影响不大,其热稳定性最好。

表 3 香螺 3种凝集素凝集微生物细胞或孢子的活力Table 3 The agglutinating activities on the unicellularmicrobe of 3 agglutinins fromN.cum ingicrosse

表 4 pH和温度对香螺 3种凝集素凝集活性的影响Table 4 The effect of the pH and temperature on the agglutinating activities of 3 agglutinins fromN.cum ingicrosse
2.5 糖溶液对凝集活性的影响
表 5为 9种糖类对 3种凝集素凝集活力的影响结果。由表 5可知,供试的 9种糖中,只有 D-甘露糖能抑制肌肉凝集素的活性,而 D-甘露糖却不能抑制血清和唾液腺凝集素的活性。各种糖溶液对血清凝集素的凝集作用均无抑制效果。此外,D-树胶醛糖和D-乳糖可抑制唾液腺凝集素的凝集作用。

表 5 糖溶液对香螺 3种凝集素凝集活性的影响Table 5 The effect of the glycose solution on the agglutinating activities of 3 agglutinins fromN.cum ingicrosse

“+”表示有抑制用用;“-”表示无抑制作用。“+”is having agglutinating activities;"-”is no agglutinating activities.
2.6 金属离子和盐度对凝集活性的影响
EDTA对 3种凝集素凝集活力的影响见表 6。由表 6可知,经过不同浓度的 EDTA处理,3种凝集素的凝集活力受到不同程度的抑制,当 EDTA浓度为 2.00 mmol/L时,肌肉凝集素发生凝集所需的最低蛋白质浓度在 0.169~2.702 mg/mL之间,当 EDTA浓度的降低至 0.50 mmol/L时,发生凝集所需的最低蛋白质浓度升为 10.805 mg/mL,凝集活力降低。还可以看出血清和唾液腺凝集素也受到不同程度的抑制。
4种金属离子对 3种凝集素凝集家兔红细胞的影响实验结果见表 6。由表 8可以看出,4种金属离子中 Zn2+能明显提高肌肉和血清凝集素对家兔红细胞的凝集活力,而对唾液腺凝集素反而有抑制的作用。而Mn2+、Mg2+和 Ca2+对 3种凝集素的凝集活性没有明显的影响。
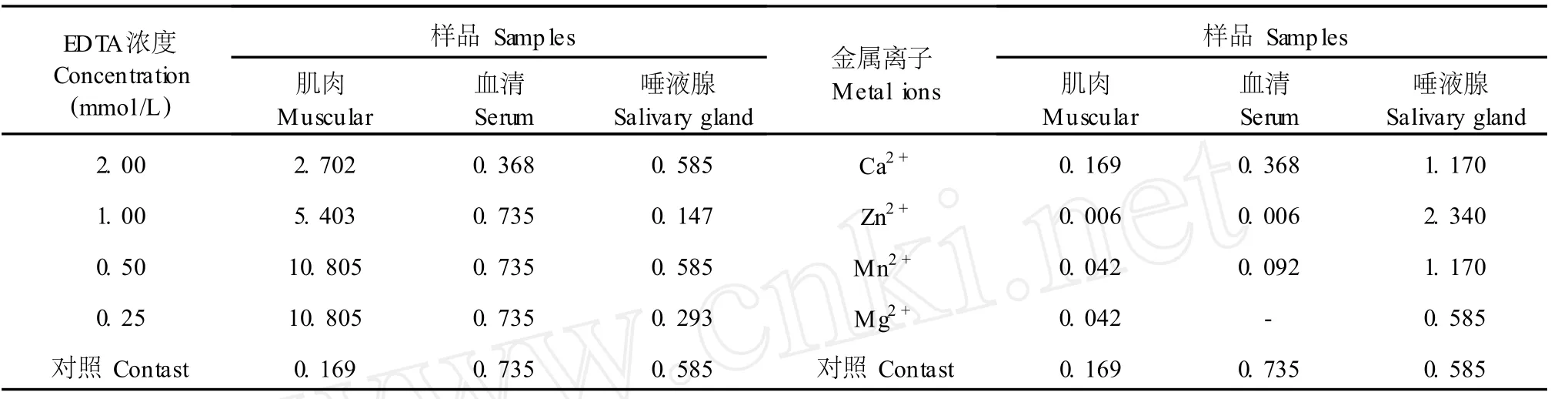
表 6 EDTA及金属离子对香螺 3种凝集素对家兔红细胞凝集活性的影响Table 6 The agglutinating activities of 3 agglutinins fromN.cum ingicrosse on different densities of EDTA and metal ions
盐度对香螺的肌肉凝集素的凝集活性具有一定的影响,而对香螺血清和唾液腺凝集素的凝集效价影响不明显,见表 7,当盐度为 12 g/L时,肌肉凝集素发生凝集所需的最低蛋白质浓度为 0.042 mg/ mL,从盐度为 24 g/L起就是起到抑制作用,同比之下,血清和唾液腺凝集素受盐度的影响不大,血清凝集素的凝集作用所需的最低蛋白质浓度在 0.368~0.735 mg/mL间波动,而唾液腺凝集素则在 0.585~1.170 mg/mL之间。

阿拉伯数字表示样品溶液产生凝集反应的最低蛋白质浓度(mg/mL);“-”表示无凝集反应。The arabic figures isminimum level of apolipoprotein on agglutinating activities(mg/mL);"-”is no agglutinating activities.
3 讨论
3.1 细胞凝集作用是凝集素最重要的生物学功能之一,它是基于凝集素分子与细胞表面糖分子的专一性结合。早在 20世纪初,Landsteiner和 Raubitschek就证明了凝集素的血凝作用具有供血动物种属专一性,同时还与血型有关。之后又发现,凝集素除了凝集红细胞外,对某些微生物细胞、精子、骨髓细胞、胚胎来源的细胞甚至是癌细胞也具有凝集作用[4-7]。
本实验分别从香螺的肌肉、血清和唾液腺中提取凝集素,这 3个不同来源的凝集素对 11种脊椎动物血细胞、4种单细胞藻类以及 11种微生物细胞的凝集性能存在着较大的差异,表明香螺体内含有不同的凝集素,这和许高云等[8]对蚶形无齿蚌凝集素的研究结果相似。实验结果显示 3种凝集素均对兔红细胞的凝集活力较强,这和 Fabregas[9]、Ainouz[10]、陈寅山[11]等得出的结论一致。而同种凝集素对不同的红细胞凝集程度呈现差异,这和薛江楠[12]、梁青龙[13]等研究的结果相似。这些差异主要与凝集素分子的大小、糖结合位点的数量和细胞分子表面的特性等有关[4]。当某种凝集素与某种红细胞不发生凝集时,则说明该红细胞表面不存在与这种凝集素专一性结合的糖分子。如本实验中,3种凝集素均对半番鸭、家鸽和家鸡的红细胞不发生凝集作用。此外,本研究中,受试的微生物细胞对香螺的 3种凝集素的凝集反映敏感性较低,仅专一的对某些微生物具有凝集作用。这与 Bird等[14]早期研究藻类凝集素对细菌的凝集作用的结果相似。张岚等[15]认为唾液凝集素主要通过识别细菌表面蛋白来介导细菌的凝集或黏附。3种凝集素对微生物的凝集活性的不同,除了凝集素本身的不同引起外,还可能与这些细胞表面结构和细胞外产物有关,同时还可能与这些微生物自身的运动习性和生活习性等有关,这还有待于进一步研究。本研究将为凝集素在不同类型细胞表面糖分子特征及细胞鉴别等方面的研究提供理论的依据,同时对弄清螺类病原微生物的致病机理提供帮助。
3.2 香螺的肌肉,血清和唾液腺 3种凝集素的 pH值的适应范围存在着差异,肌肉和血清凝集素比较相近,在 pH 7.0~10.0上具有凝集活性,而唾液腺凝集素则具有更广的适应范围,pH 3.0~9.0均表现出凝集活性。这表明了,不同的凝集素保持凝集活性的 pH范围不同,这与许多研究的结果相似,如三角帆蚌肌肉凝集素在 pH 6.0~8.0普遍表现出较强的凝集活性[16],九孔鲍血清凝集素的活性在 pH 6.0~12.0,凝集活性没有变化[17],日本对虾(Penaeus japonicus)的凝集素活性在 pH 5.0~7.5时稳定,pH 8.0~9.0时迅速下降[18]。导致这些差异一方面可能是因为 pH的变化影响溶液中离子键的相互作用,从而影响凝集素表面的发生变化,导致凝集活性的改变,另一方面可能是因为当 pH处在与动物内环境相近的酸碱度时,表现出较强的凝集活性,这只是一种正常反应。此外受试细胞的代谢状态和表面电荷也可能是影响凝集反应的一个原因[19]。
热稳定性方面,3种凝集素耐热性不同,60℃开始肌肉凝集素开始没有凝集活力,血清则在40℃起就已无凝集活性,而唾液腺凝集素表现出强的热稳定性,这可能是和凝集素分子中蛋白质和糖的含量不同有关[20]。受热后的蛋白质结构改变进而失活,这可能是凝集素失活的最主要的原因,糖耐热性好,含糖量高的凝集素其热稳定性就可能较好,由此可以推断唾液腺凝集素的含糖量可能最高。另外,也可能和凝集素的活性位点有关,还可能和香螺的栖息环境温度有关.[21]。
3.3 凝集素有选择地对异物产生凝集反应,主要是由于凝集素带有特异性的糖基决定簇的受体[22]。糖类特别是单糖,有时二糖、三糖或者多糖,能对凝集素的凝集反应起到抑制的作用[23],这在很多的研究中都得到了证实,如丽文蛤的血清凝集活性被 D-甘露糖、D-麦芽糖抑制[24];背角无齿蚌和三角帆蚌的血清凝集素可被多种单糖抑制[12]。但饶小珍[17]等对九孔鲍血清凝集素进行的糖抑制实验却发现10种糖溶液对凝集效果均没有抑制作用。王新生[21]等发现褶纹冠蚌肌肉凝集素不能被受试的 7种糖所抑制。本实验结果发现,只有 D-甘露糖抑制了香螺肌肉凝集素的凝集活性,其余的均无抑制作用。各种糖溶液对血清凝集素的凝集作用均无抑制效果。这可能是由于这 3种凝集素表面的糖基结合位点与这些不发生抑制作用的糖之间不存在亲合性。相反,能发生抑制作用的糖,则可被认为其结构互补于所作用的凝集素,进而确定凝集结合部位对糖的特异性。
3.4 一些二价金属离子的参与往往有助于多种凝集素的凝集作用[25],因此 EDTA可能会强烈抑制凝集素的活力,实验结果表明,香螺的 3种凝集素受EDTA不同程度的抑制,这与牟海津等[26]的研究结果一致。说明这 3种凝集素分子中均含有维持活性所必需的一种或多种金属离子,实验结果还表明了, Mn2+、Mg2+和 Ca2+对 3种凝集素的凝集活性没有明显的影响,即无信赖性。而只有 Zn2+能明显提高肌肉和血清凝集素对家兔红细胞的凝集活力。这可能就是由于这 3种凝集素的凝集作用不需要Mn2+、Mg2+和 Ca2+的参与,而肌肉和血清凝集素的凝集作用却与 Zn2+有很大的关系。再次说明了无脊椎动物凝集素的凝集作用常常需要一些二价金属离子的参与[27]。本实验还发现,在一定范围内的盐度可以改变香螺肌肉凝集素的凝集效价。在盐度为 12~18 g/L之间可提高香螺肌肉凝集素的凝集活性, Tamplin[28]等在研究美洲巨蛎的血清对霍乱弧菌的凝集作用发现适当增加反应液的盐度 24~30 g/L,可以提高凝集效价。牟海津等[26]发现在一定范围内增加盐度可提高中国对虾血淋巴的凝集效价的研究结果相似,而在盐度为 24 g/L以上,活性效价就开始下有所下降。这其中的原由还有待进一步的研究。
通过对香螺的肌肉、血清和唾液腺凝集素的比较研究,发现三者的性质等方面存着着较大的差异,所以要进一步的了解三者具体的类型、物理化学结构等,还有待分离纯化等的深入研究。
1 Wang FL(王风玲),et al.Research on application ofLectins in progression,metastasis and prognosisof tumor.Q ilu Phar m Affairs(齐鲁药事),2008,27(1):35-38.
2 ChenWF(陈慰峰).Medical Immunology(医学免疫学). Beijing(北京):People’s Sanitary Perss,2001.120.
3 Drickamer K.Two distinct classes of carbohydrate recognition—domains in animal lectins.J B iol Chem,1988,263: 9557-9560.
4 Zhang CY(张春玉),Sun F(孙非),Lin JW(林景卫),et al.Study and developmenton fungus lectins.Chin J B iol(中国生物制品学杂志),2007,20(2):142-145.
5 Liu Y(刘源),et al.Study and development on mcrobial lectins.J Int Stomatol(国际口腔医学杂志),2007,34(1):1-3.
6 Xiong CN(熊川男),LiW(李伟),Bai XF(白雪芳),et al. Biological activities of lectin from Sea Mussel Crenomytilus grayanus.Fisheies Sci(水产科学),2007,26:400-404.
7 Jing J(荆剑),Zhao X(赵翔),Zhang Y(张页).Purification of Soybean agglutinin and its agglutination activity toward different cancer cell lines.Chin J B iochem M olB iol(中国生物化学与分子生物学报),2003,19:401-405.
8 Xu GY(许高云),Lin J(林静),Chen YS(陈寅山),et al. A preliminary study on lectins of serum,muscular and gonad extract fromAnodonta arcaefor m is.Nat Prod Res Dev(天然产物研究与开发),2008,20(Suppl.):43-47.
9 Febregas J,Llovo J,Munoz A.Hemagglutinins in red seaweeds.BotM ar,1985,18:517-520.
10 Ainou IL,Sampaio AH,BenevidesNMB.Agglutination of enzyme-treated erythrocytes byBrazilian marine algae extracts.BotM ar,1992,35:475-479.
11 Chen YS(陈寅山),et al.Purification and characterization of hemolymph lectin fromTegillarca granosaLinnaeus.J M ol CellB iol(分子细胞生物学报),2006,39:453-461.
12 Xue JN(薛江楠),Shi AJ(石安静).Preliminary study on the hemolymph lectins of two species of freshwater bivalve ofAnodonta woodianaandHyriopis cum ingii.J Sichuan Univ, Nat Sci(四川大学学报,自科版),2000,37:242-246.
13 LiangQL(梁青龙),et al.Comparison on agglutinating activity of serum lectins extract from three species of Crabs.J Fujian Fisheries(福建水产),2005,(2):45-50.
14 Bird KT,et al,Agglutinins from marine macroalgae of the southeastern United states.J ApplPhycol,1993,5:213-218.
15 ZhangL(张岚),HuangDM(黄定明),Zhuo XD(周学东). Research progress of salivary agglutinin.J Intl Stomatol(国际口腔医学杂志),2009,36(2):180-182.
16 Zhuo CH(周春花),et al.Hemagglutination activity of muscular lectin ofHyriopsis cum ingii.J Nanchang Univ,Nat Sic (南昌大学学报:理科版),2009,33(1):64-67.
17 Rao XZ(饶小珍),Chen YS(陈寅山),et al.Activity of hemagglutinin from the serum of Abalone Haliotis diversicolor aquatilis.Fisheies Sci(水产科学),2006,25:496-499.
18 Liao SA(廖绍安),Li Q(李绮),et al.Physicochemical properties of agglutinin fromPenaeus japonicus.J Fishery Sci China(中国水产科学),2001,8(4):1-8.
19 Xiao J(肖静),Zhang L(张鹭),Liu GC(刘跟成).On the agglutinating activity of lectins of lectins from 4 species of Mollusks.J M udanjiang Nor m al Univ,Nat Sci(牡丹江师范学院学报,自科版),2006,(1):1-2.
20 Hu XP(胡新平),Li ZE(李智恩),Xu ZH(徐祖洪).Review on seaweed agglutinins research.M arine Sci(海洋科学),2000.24(8):34-37.
21 Wang XS(王新生),et al.Study on activity of lectins in serum and muscular extraction fromCristaria plicata.J Hydroecol(水生态学杂志),2008,28(6):95-100.
22 Sharon N,Lis H.Lectins cell agglutinating and sugar-specific protiens.Sci,1972,177:949-959.
23 Wang CF(王长法),Zhang SC(张士璀),Wang CL(王昌留).Reserch update of lectin in aquatic invertebrates.M arine Sci(海洋科学),2005,29(4):63-67.
24 Zhu YX(朱越雄),Cao GL(曹广力).Properties of hemagglutinin in serum of bivalveM eretrix lusoria.M arine Sci(海洋科学),2000,24(10):55-56.
25 Drickamer K.Ca2+dependent carbohydrate-recognition domains in animal proteins.Current Opinion in Struct B iol, 1993,3:393-400.
26 Mou HJ(牟海津),et al.Properties of hemagglutinins from the serums of shellfishes.J Ocean Univ Q ingdao,Nat Sic(青岛海洋大学学报,自科版),1999,29:249-254.
27 Chen HW(陈皓文),Sun PX(孙丕喜),Song QY(宋庆云).Lectin-the favorable weapons of aquatic animals defending themselves.J Oceanography Huanghai﹠Bohai Seas(黄渤海海岸),1995,13(3):61-70.
28 TamplinM l,FisherW S.Occurrence and characteristics agglutination ofVibrio cholerae by sreum from the easter oyster,Crassostrea virginica.Appl Environ M icrob,1989,55: 2882-2887.
A Prel im inary Study on Agglutination of Agglutin ins of Serum,M uscular and Salivary Gland fromNaptunea cum ingicrosse
CHEN Lin,XU Gao-yun,RAO Xiao-zhen,CHEN Yin-shan*
College of Life Sciences,Fujian Nor m alUniversity,Fuzhou 350108,China
Serum,muscular and salivary gland agglutinins extracted fromNaptunea cum ingicrossewere tested for agglutinating activities using 7 kinds of an imal erythrocytes,4 kinds of human erythrocytes,4 species of unicellular algae,and 11 species ofmicrobe.Meanwhile the sensibility of pH,thermostability,sugar-inhibiting action,the effect of EDTA,metal hydronium and salinitywere detected.The results showed that therewere differences in the agglutinating activitieson various cells in 3 agglutinins,and the rabbit erythrocyteswere the most sensitive to 3 agglutinins.The agglutinating activities ofmuscule and serum agglutininswere disappeared in pH<7.0 condition.The thermostability of salivary gland agglutinin was the highest,stillwith activities at 90℃.Besides,3 agglutinins showed different results in the sugar-inhibiting experiments.The agglutinating activities of 3 agglutininswere inhibited in the range of 2.00-0.25 mmol/L EDTA.It was found that Zn2+could improve the agglutinating activities ofmuscle and serum agglutinins,but restrain the salivary gland agglutinin.When the salt concentration was at 12-18 g/L,the muscle agglutinin agglutination could be increased, and itwas be inhibited at the concentration of 24-60 g/L.
Naptunea cum ingicrosse;agglutinin;agglutinating activity;characteristics.
R284.2
A
1001-6880(2010)04-0651-08
2009-10-12 接受日期:2010-04-08
福建省科技厅资助项目(2005K018)
*通讯作者 Tel:86-591-22868216;E-mail:biocys@163.com
