医疗器械不良事件监测系统的建设与应用
2010-09-15王玲王刚国家药品不良反应监测中心北京100045
王玲 王刚 国家药品不良反应监测中心 (北京 100045)
医疗器械不良事件监测系统的建设与应用
王玲 王刚
国家药品不良反应监测中心 (北京 100045)
分析建立“医疗器械不良事件监测系统”的必要性,介绍系统建设及应用情况,归纳系统的技术特点,对系统今后的发展目标进行了探讨。
医疗器械 不良事件 监测系统
1 建立“医疗器械不良事件监测系统”的必要性
1.1 监测业务快速发展的需要
众所周知,医疗器械的安全性问题与广大公众的生命安全、身体健康紧密相关。美国1995年以来每年收到死亡和严重不良事件报告10多万件。我国是医疗器械生产和使用的大国,据估计每年发生不良事件至少在4万件以上[1]。社会快速发展、生活水平提高,人们对提高生活质量的需求不断增长,给监测工作提出更高要求。需要我们进一步提升工作质量、提高工作效率、加强工作的科学性,更好的履行医疗器械上市后不良事件监测和再评价的技术工作职责,实现保障公众用械安全的目标。
在我们日常的监测工作中,需要对医疗器械不良事件进行及时报告和收集、科学分析与评价、数据综合利用以及信息反馈;需要加强工作交流与沟通,采取有效的控制措施,降低风险和危害。同样,作为医疗器械不良事件报告主体的生产企业在报告产品不良事件的同时,需要对本企业生产的各个产品在全国的不良事件发生情况有整体了解;对于医疗器械使用单位,医疗器械不良事件的报告、监测、管理和安全性信息的获知及实际应用逐渐成为日常管理工作中的一项重要内容,同时也是确保医疗卫生等工作安全实施、顺利开展的重要手段。总体来说,不论是各级政府监管部门、各级技术监测机构,还是生产企业、经营企业、使用单位,立足于不同工作层面,都需要对不同范围、不同类别的数据信息进行有效的管理和利用,都需要先进的技术手段辅助实施,所以建立一个全国范围的网络化的信息系统势在必行。
1.2 相关管理办法出台,给监测工作提出更高要求
2008年12月,国家食品药品监督管理局、中华人民共和国卫生部联合发布了《医疗器械不良事件监测和再评价管理办法(试行)》(以下简称《办法》),标志着我国医疗器械不良事件监测工作进入了规范化轨
道。《办法》对各级食品药品监管部门、卫生主管部门、医疗器械不良事件监测技术机构的管理职责进行了明确规定;对医疗器械生产企业、经营企业和使用单位提出了相关要求,对不良事件报告、再评价、控制等进行了规定与说明。《办法》中,对医疗器械不良事件的报告主体、报告范围、报告时限、分析评价等进行了规定,提出了更高要求。
从《办法》要求和提升实际工作技术水平出发,都离不开先进的技术环境的有效支撑。
1.3 以往的应用软件不能满足现实要求
从2004年开始到2009年,对于医疗器械不良事件病例报告的管理一直采用Epidata。Epidata是一种免费的专业的报告管理软件。在以往的日常工作中,生产企业、医院等单位将纸质报表报送给省级或市级中心,省级或市级中心人员使用Epidata进行报告录入、评价,通过邮件方式报送到国家中心,国家中心使用Epidata对报告进行汇总和一般性的查询统计工作,如进行比较复杂的统计则将报告导出到EXCEL中操作。Epidata在一定的历史条件下,在以往的工作中承担了报告接收工作,发挥了报告管理功能[2]。
但是,Epidata软件自身存在固有的局限性。Epidata是一种报告管理软件,其重点在于提供数据采集功能,不能对采集的数据进行复杂统计、分析和紧急事件预警等。总体来说,在数据应用方面比较薄弱,技术相对落后,已经不能满足现实工作需求。
1.4 信息化建设的发展规律
根据信息化建设的发展规律,随着业务的快速发展、需求的不断变化,随着信息技术的日新月异,信息系统需要及时更新,生命周期是3~5年,需要根据具体情况来具体分析。
综上所述,需要建立新的应用系统,使用最新技术,具备良好功能,满足当前日常业务应用需求,更好的实现监测工作目标。
2 系统建设与应用
2.1 业务工作职责、工作流程分析
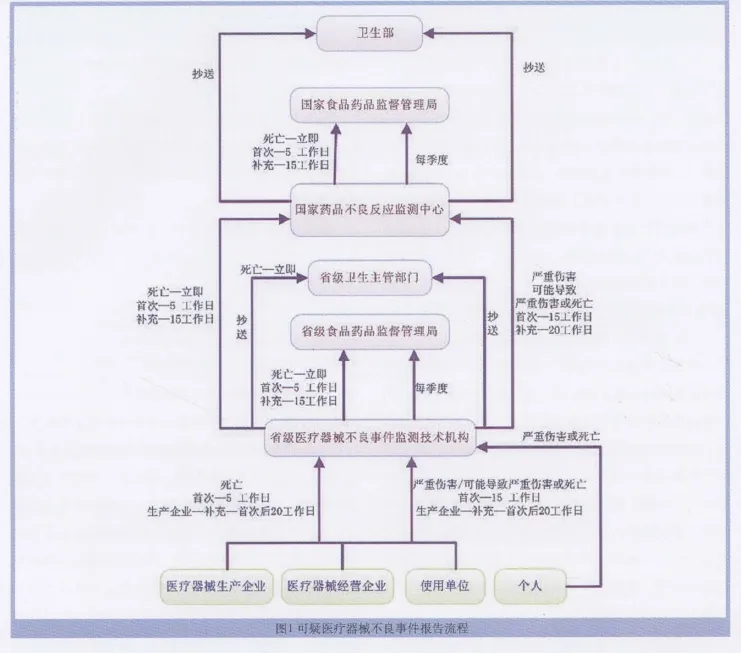
根据《医疗器械不良事件监测和再评价管理办法(试行)》,其中可疑医疗器械不良事件报告流程如图1。
从其中的业务工作流程和信息流转过程可以看出,《办法》对业务工作的及时性、规范性、科学性有了更高的要求,从全局的高度要求进一步加强各单位之间的业务沟通、信息告知,从报告的源头就强化了责任和要求,突出了“协调”职责,促进了监管合力的形成。
从《办法》要求和实际工作出发,对于不良事件报告的及时上报和收集、科学分析与评价,对工作时限的控制,报告数据的综合利用,安全性信息的共享和反馈,预警消息的及时发布,各有关单位间的业务沟通,以及对不良事件的有效控制等等,都是信息系统建设的重要内容。
2.2 系统建设目标
系统建设的总体目标是:通过系统建设,实现对医疗器械病例报告及相关资料的快速、有效收集,及时处理和综合利用,全面提高技术评价、综合分析工作的科学性、实效性,从整体上加强技术监测水平,提升对医疗器械风险的识别、分析、控制能力,更好的履行工作职能,保障公众用械安全。
信息系统的建设应遵照总体规划、分步实施的原则,本期系统建设的工作范围和目标,从现实工作过程来讲,分为几个环节:
(1)实现信息快速上报:通过系统建设,实现医疗器械不良事件病例报告数据及其相关资料的实时上报,使得国家药品不良反应监测中心、34个省级中心等各级技术监测机构能够对医疗器械安全性信息进行快速、有效收集;
(2)报告数据及时处理:实现各级技术监测机构利用网络系统对报告数据进行在线审核、修改,提出评价意见,并根据系统收集的相关产品背景资料、安全性信息进行综合分析;
(3)实现报告数据的管理与利用:利用网络系统,实现系统各级用户对数据进行管理和应用,对不良事件报告数据、机构信息、人员信息的录入、修改、查询、统计等操作;
(4)及时预警并发布:根据报告数据,实现预警,尽早发现风险信号并采用最新技术及时发布;(5)信息共享与反馈:加强系统内用户的信息沟通,实现数据、信息共享,根据不同目标人群及时反馈信息。
2.3 系统设计
2.3.1 技术体系结构
经过应用需求调研,根据业务工作实际情况,结合信息技术发展现状,进行了系统总体设计。系统采用B/S结构进行开发,在国家中心构建一个统一的网络信息平台,在平台上存储、处理医疗器械不良事件监测的相关信息,该平台采用J2EE标准技术和Web技术,基于组件模型和关系型数据库构建,通过国家Internet公网,实现全国各地的信息接入和处理,通过标准数据接口技术与其它系统互联,通过数据抽取技术实现数据的提取和访问。总体设计上包括了基础网络平台和应用系统两级平台。采用当前流行的Struts、 Spring、hibernate结合的技术完成系统开发,采用了先进的四层体系架构,即IE客户端层、Web显示逻辑层、App应用逻辑层、DB数据层。
2.3.2 系统环境
系统硬件平台包括WEB服务器,应用服务器,数据库服务器。系统运行在基于开放平台的主机上,主机部署在国家中心机房,外网网段,能访问数据库服务器,同时隔离在防火墙内。用户端硬件环境只需要支持IE6.0及以上浏览器即可。
网络平台划分为局域网和广域网两部分,局域网采用基于以太网的TCP/IP协议,广域网则充分利用现有的Internet网络基础。
系统采用W indow s操作系统,使用大型关系型数据库Oracle10g和满足J2EE架构的中间件产品WebSphere6.1 Server。
2.4 系统功能与应用
(1)权限管理:对系统内的角色进行定义和划分,不同的角色拥有不同的工作内容和相应的管理权限。如上报角色、评价角色、审核角色等;对系统内的各级用户根据工作职责分配相应的角色、赋予对应的权限。国家中心给省级中心授权,省级中心负责对本省内省级以下的机构授权;
(2)医疗器械不良事件报告管理:对《可疑医疗器械不良事件报告表》(《办法》附件1)进行管理,基本功能包括不良事件报告表的录入、修改、分析、评价、退回、查询、统计、输出等。主要用户为基层单位,即医疗器械生产企业、经营企业、使用单位,监测机构在代替基层用户或个人报告时,也可应用该项功能;
(3)补充报告管理:对《医疗器械不良事件补充报告表》(《办法》附件2)进行管理,基本功能包括与个例报告建立关联关系、录入补充报告、提出分析评价意见、补充报告数据的应用等。主要用户为医疗器械生产企业和监测机构;
(4)年度汇总表管理:对《医疗器械不良事件年度汇总报告表》(《办法》附件3)进行管理,主要功能有年度汇总表上报、评价,数据的应用等。主要用户为医疗器械生产企业和监测机构;
(5)单位管理:实现对系统内用户的统一管理,主要功能有用户注册、审核注册信息、分发用户、用户信息查询等功能。各级技术监测机构,可对本辖区内注册的基层单位、用户进行管理;各单位可对本单位的用户进行管理;
(6)资源及公告管理:主要功能是资源上传及下载、公告发布和浏览,能够给不同目标人群发送相关信息,实现资源共享、系统内各级用户信息沟通;
(7)预警管理:可进行预警条件设置、按照设定周期定期搜索,可进行预警信息的管理,并通过短信提醒功能及时发布预警消息;
(8)基础数据及标准数据管理:对基础数据如ICD、医疗器械分类、产品名称、企业名称等进行管理,主要作用是实现数据标准化,对基础数据进行统一管理,对非标准数据进行手工规整,以进一步提高数据的规范性,实现有效利用;
(9)统计分析:实现各级用户对辖区内报告数据的进一步应用,可根据不同的检索条件如不良事件后果、报告单位类别、时间等对报告数据进行统计分析。
系统的功能结构图如图2。
2.5 系统技术特点
系统具备的技术特点,主要体现在以下几个方面:(1)技术手段先进
①安全性:在系统安全性设计方面采用分级分层管理,分别在网络层、应用层、数据库层进行了安全设计,防止非法访问和数据丢失,保证系统的应用操作安全和数据安全;
②扩展性:信息系统建设完成投入使用后,随着工作环境、业务流程、工作要求的变化,以及在实际应用过程中产生的新的应用需求,都需要对系统进行扩展。该系统可以通过多种机制实现系统的纵向扩展和横向扩展,具备良好的系统扩展性;
③兼容性:系统设计充分利用现有资源,并采用通用技术,具备良好的兼容能力;
④可靠性:系统具备良好的性能,能够保证系统核心功能7×24小时连续运行;
⑤易维护:系统提供了良好的管理和维护工具,降低了管理和维护要求。有利于改正、改动、改进软件功能,实现简单快速的管理、节省时间、降低成本、快速解决问题、减少人为因素故障。
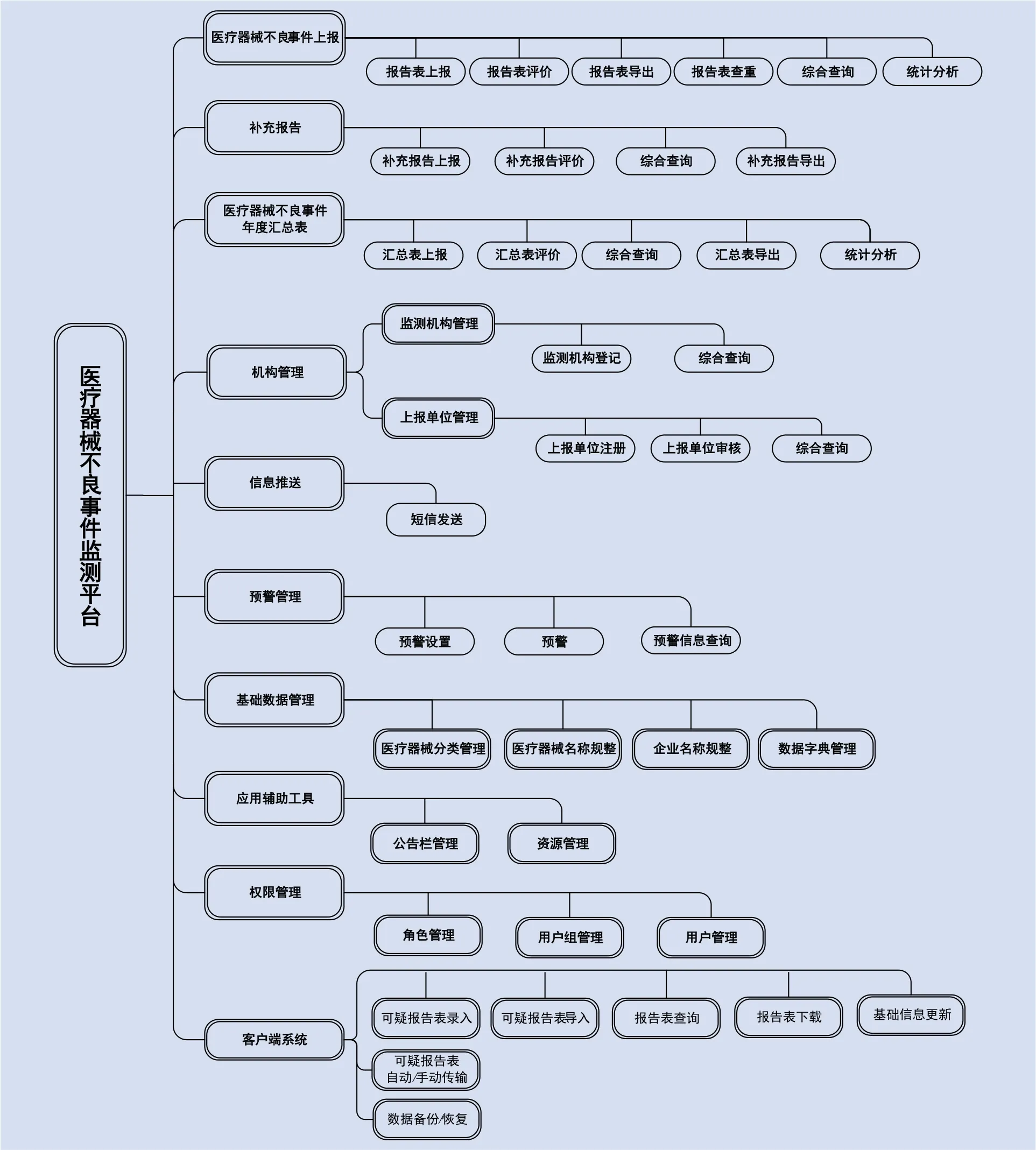
图2 系统功能结构图

(2)用户全面覆盖
系统设计采用B/S结构,基于浏览器的应用,使得全国各地用户的信息接入和处理更加方便,在整个医疗器械不良事件监测体系内,各级用户都可以登录系统,完成不同的操作和应用,相关的用户有:
①基层单位:包括医疗器械生产企业、经营企业、使用单位,主要进行医疗器械不良事件上报、补充报告、汇总报告等操作,查看预警消息,可以查询、统计本单位报告的数据情况,可以查看、下载系统内的相关资源;
②地方监测机构:包括各省、地区、县级医疗器械不良事件监测技术机构,主要进行上报数据分析评价,提出补充资料,查看预警消息,对基础数据进行规整,可以查询、统计本辖区内报告的数据情况,可以查看、下载系统内的相关资源,对下级机构授权;③国家中心:即国家药品不良反应监测中心,主要对上报数据进行审核,提出分析评价意见,设置预警条件并进行预警信息发布,可以综合查询、统计全国范围报告的数据情况,可以建立系统内的相关资源,发布公告,进行系统权限设置与管理,对省级监测机构授权。
(3)多种工作模式
为适应不同地区、不同单位的特殊情况,满足不同应用环境下系统的正常使用,系统存在两种工作模式:离线方式和在线方式。
离线方式:即利用客户端独立运行的应用程序,实现不良事件报告表的录入上报工作,用户不用远程登录网络系统,而是使用本地独立安装的系统程序,进行日常的数据报告与管理工作。这种工作模式,对于没有上网条件和内部对外网使用管理要求较为严格的单位,是一个必要的上报手段;另外,使用离线方式能够提高数据的报告速度、降低成本,是一项有效的辅助报告方法。
在线方式:使用全国网络系统,远程登录系统进行在线操作,可以及时了解系统自动产生的实时性的预警消息、共享数据和系统信息,与相关用户进行沟通交流,可以最大化的利用系统资源。
(4)权限统一管理、灵活配置
权限的配置和管理是一个信息系统重要的组成部分,整个系统运转的安全性、功能性、实用性与之紧密相关。该系统对角色、用户、用户组进行了详细的定义和划分,对于权限管理的设计非常灵活、方便,并具有良好的扩充性和可维护性,是系统具有的明显的特点之一。
(5)过程严格管理
通过系统设计,对于各级用户的权限进行管理,使得系统内所有用户在规定的工作范围内使用系统功能;对业务工作流程、数据流转过程进行了有效控制;明确了数据共享原则。实现了对整个系统应用过程的严格管理。
3 系统发展目标
网络系统的前期建设为今后的发展奠定了基础,今后工作的重点在于充分利用有效资源,建设高标准、高质量、高效率的应用系统。今后的系统建设应紧密结合《办法》要求,一切从实际应用出发,紧密围绕业务工作需求,进一步加强网络系统的建设与应用。
3.1 增强系统功能
进一步增强医疗器械不良事件上报功能,辅助报告录入、辅助分析评价;增加报告质量控制与评估;加强国外安全性信息的采集、处理功能;完善基础数据建设,加强数据规整功能和标准化设计;增强事件预警和控制能力;进一步提升信息共享及反馈能力;加强数据智能化分析能力,提高数据的综合利用功能;增加对突发性群体不良事件报告、境外发生可疑医疗器械不良事件报告的管理和控制。
3.2 加强系统宣传
加强网络系统的宣传、培训与推广,使得各级用户全面了解系统特点和具体功能,提高系统应用质量、增强使用效果,更好的发挥系统的实际作用;广泛征求意见和建议,为系统的进一步发展奠定良好的基础。3.3 建立健全工作规范
各级用户在系统应用过程中,对于系统的操作规范、数据规整相关标准、报告质量的控制要求、报告评价的原则等等,需要逐步建立健全有关的工作规范,在日常的系统应用过程中具体实施,并进行有效的监督和管理。
3.4 开展相关业务工作的研究与应用
应用软件的定制开发与深入应用离不开业务的发展,在统计分析、信号检测、数据挖掘、决策支持等方面需要进一步加强相关项目的研究与应用,在最短时间内完成知识与生产力转化,在实际工作中发挥更好的作用。3.5 加强国际间的合作与交流
美国和欧盟是医疗器械生产和消费大国,已经建立起相对完善的医疗器械法规体系,在国际社会上有着重要影响,对医疗器械的管理也有着较长的历史和值得借鉴的经验[3]。美国FDA、欧盟建立了相对比较完善的不良事件监测网络,欧洲中央数据库为提高制造厂商及其设备的注册、各利害方的信息交换和不同成员国市场监督活动的一致性提供了一个契机[4]。
我国医疗器械监督管理的历史较短,系统的开展医疗器械不良事件监测工作更晚[5]。在工作过程中应注重借鉴国际上发达国家开展医疗器械上市后安全性监测的成功做法,借鉴我国近年来开展药品不良反应监测的管理经验和技术基础[6]。
4 结语
计算机网络信息系统的建设与完善是一个长期的过程,是一项涉及面广、技术规范性强、标准化要求程度高、发展迅速的系统工程[7]。对于不同时期不同的应用需求,需要不断的建设、完善和维护。
我国的监测工作起步较晚,在技术方法上同样存在一定差距。鉴于我国的发展现状,需要我们一切从实际应用出发,紧密结合医疗器械监测工作的业务特点,广泛吸取国内外先进经验与技术,尽早开展相关的基础性研究并采取科学有效的方式方法,运用信息技术,发挥智能化数据分析方法的优势[8],自动发现风险信号、分析识别并及时发布警报,提醒有关部门关注,采取适当的管理措施进行有效控制,对于进一步加强监测工作,改进企业产品,提高使用人员技术、学术水平,避免不良事件重复发生具有重要意义。
[1] 王兰明.“关于我国医疗器械不良事件监测系统建设的若干思考”,中国药业,2004,13(5):5-6.
[2] 孟刚、裴育、王玲.“Epidata软件在医疗器械不良事件监测中应用的可行性研究”,中国卫生信息管理,2006,3(6):52-54.
[3] 孙勤、严梁.欧美医疗器械管理经验及对中国医疗器械法规体系改革的启示,中国医疗器械杂志,2006,30(1):43-52.
[4] 宓现强、潘尔顿、王聪等.中欧医疗器械不良事件报告系统的比较及对我国的启示,中国医院管理,2008,28(12):59-60.
[5] 王兰明.“关于推进医疗器械上市后安全性监测工作的探讨”,中国医疗器械信息,2009,15(4):48-52.
[6] 王兰明.开展医疗器械不良事件监测保障公众用械安全,中国药物警戒,2004,1(1):10-12.
[7] 王玲、张莉莉、李少丽.国家药品不良反应监测网络系统的建设与应用,中国药事,2002,16(5);286-288.
[8] 王玲、陈安、陈中.药品不良反应监测的智能数据分析方法及应用,中国药事,2007,21(7):476. ■
A Study on Construction and App lication
of Medical Device Adverse Event Monitoring System
WANG Ling WANG Gang
National Center for ADR Monitoring, China (Beining 100045)
The necessity for construction of Medical Device Adverse Event Monitoring System were analyzed, the content on construction and Application of the system were given, the technical features of the system were summarized. The system development in the future were discussed.
medical device, adverse event, monitoring system
1006-6586(2010)09-0032-07
R197
A
医疗器械是涉及到人类生命健康和生活质量的特殊产品,被广泛应用于疾病的预防、诊断、治疗、保健和康复。与药品一样,医疗器械具有双重性,在给人类带来效益的同时,还会存在潜在风险,在医疗器械研发、生产、流通、使用等各个环节,风险无处不在。加强医疗器械风险管理、保证产品安全有效是医疗器械监督管理工作的最终目标,医疗器械不良事件(M edical Device Adverse Event,MDAE)监测是上市后监管工作的重要组成部分,是上市后风险管理的重要手段。通过广泛收集、评价、分析医疗器械不良事件病例报告,对医疗器械的风险和效益进行综合分析,及早发现风险信号,采取适当的管理措施进行控制,是当前开展MDAE监测工作的一项主要技术手段。
“医疗器械不良事件监测系统”是国内首个运用当前先进的信息技术方法实现MDAE病例在线报告、评价、分析、预警、发布,并在全国范围内应用的实时网络系统,该系统经过前期的系统分析、系统设计、系统实现、试点运行、全国试运行,已于2010年1月在全国正式运行,该系统的建设与应用使得医疗器械不良事件监测工作迈上了一个新的台阶。本文结合系统的应用现状,对其设计、功能特点进行介绍,对今后发展进行初步探讨。
2010-07-23
王玲,硕士,高级工程师;王刚,工程师
