香港医疗器械监管概述
2010-09-15陈欣宓现强上海理工大学医疗器械与食品学院上海200093
陈欣 宓现强 上海理工大学医疗器械与食品学院 (上海 200093)
香港医疗器械监管概述
陈欣 宓现强
上海理工大学医疗器械与食品学院 (上海 200093)
本文介绍了香港医疗器械主管部门及其相关的法规和监管情况。
医疗器械 香港 监管
1 政治体制[1]
香港实施行政主导的管治模式,并制定由行政长官和行政会议领导的管治体制和代议政制架构。
香港的政府部门通常称为“署”(如卫生署、香港警务署),包括三司十二局,是司长及决策局的统称。主管均为香港公务员,大部份向所属的决策局局长负责,小部分直接向司长负责(如行政署向政务司司长负责),另外还有审计署直接向立法会报告;香港廉政公署和申诉专员公署直接向行政长官负责。
2 医疗器械定义和分类[2]
2.1 医疗器械定义
参照指南GN01第3.2.1段:一般而言,医疗器械指用于人体作诊断、预防、治疗、监察疾病或创伤;或作康复用途;或用以检查、取代及改变身体结构或功能的任何仪器、设备、工具、材料或其他物件,但不包括药物;医疗器械亦包括用作检验来自人体样本的仪器。另外,有些仪器虽然符合医疗仪器的定义,却不属于医疗仪器行政管理制度的现行涵盖范围。
2.2 医疗器械分类
参照全球医疗器械协调工作组(the G lobal Harmonization Task Force,GHTF)的分级规则,按照医疗器械对病人、使用者或他人所致的风险程度把医疗器械分为四类:I类(低风险,如压舌板),II类(中-低风险,如胃窥镜),III类(中-高风险,如矫形外科植入物)和IV类(高风险,如植入式心脏起搏器)。
3 医疗器械监管部门
3.1 医疗仪器管制办公室
医疗仪器管制办公室(M edical Device Control O ffice,MDCO),2004年7月成立,旨在确保公众能及时获得医疗器械的安全有效性信息,达到他们想要的性能。
MDCO部门的工作原则:依据GHTF所建议并经协调的标准和程序,设立一套按风险评级及具有成本效益的制度,以规管医疗仪器的供应和使用。一方面要确保本港市民可以适时使用到安全、有效并按原理设计运作的医疗仪器,另一方面则要避免对业界构成不必要的负担。规管程度应与医疗仪器的相关风险水平相符,因风险水平的增加而增加,并顾及到使用有关仪器所带来的好处。[3]
总体来讲,政府工作透明度好,一些存在潜在危险的医疗仪器安全资讯在卫生署网站上都有公布,可供参考。
3.2 MDCO演化历史
为了与GHTF协调一致,医疗仪器管制办公室(MDCO)于成立之年12月份自发性地成立了医疗仪器行政管理制度(M edical Device Adm inistrative Control System ,MDACS)。协调内容主要有:第II,III、IV 类医疗器械的分类清单;顺应性评估机构的识别;当地生产商的清单;进口商的清单;安全预警系统和召回系统;不良事件报告系统。[4]
其中,协调工作在医疗器械的命名、文件使用语言和涵盖内容上碰到了难点。而且在某些器械上的规范难点有待解决,如:体外诊断仪器;一些边缘医疗器械产品;从人体血液和组织中提取获得的产品;一次性器械的再利用;二手产品的销售。[4]
4 法律法规
除了含有药剂制品或放射性物质的医疗器械外,香港目前没有特定的法律规管医疗器械的进口或销售,只有一些与之相关的法规、条例及指南性文件。
4.1 法规和条例[5]
医疗器械相关的法规或条例可归纳如下:电子产品安全法规(Electrical Products Safety Regulation);辐射仪器的控制法规(Radiation Control of Irradiating Apparatus Regulation);消费品安全条例(Consumer Goods Safety Ordinance);药品及毒药条例(Pharmacy and Poisons Ordinance);不良医药广告条例(Undesirable M edical Advertisement Ordinance)。另外,2004年起,由地方自发性形成了一套列表系统(Voluntary Listing System)。该系统在很多方面都和GHTF所推荐使用的标准一致,主要有:医疗器械的定义、医疗器械安全和性能规范、器械顺应性评估原则等。
4.2 指南性文件[5]
医疗器械相关的指南性文件归纳如下:医疗仪器行政管理制度概览(GN01);第IV级医疗仪器列表指南(GN02);本地负责人医疗事故呈报指南(GN03);认证评核架构及认证评核机构(GN04);第B、C、D级体外
诊断医疗仪器表列指南(GN06)(注:建议文件);第II、III级医疗仪器列表指南(GN05);医疗仪器进口商列表事宜指南(GN07);本地制造商列表事宜指南(GN08);按医疗仪器行政管理制度提交申请产品纳入医疗仪器列表的补充指引(08.6.11)。
5 医疗器械质量管理
5.1 医疗器械安全及性能基本原则[2]
参照指南性文件GN01,所有医疗仪器的设计及制造都应该符合医疗仪器安全及性能基本原则。除一般性的规定外,以下几个方面值得特别注意:
化学、物理及生物特性;感染及微生物污染;制造及环境特性;具有诊断或测量功能的仪器;辐射防护;连接或配备能源的医疗仪器的相关规定;仪器发生危险的保护;因向病人提供能量或物质所带来风险的保护;因病人自行测试或自行使用仪器而带来危险的保护。5.2品质管理系统
制造商必须设立、记录、实施和维持符合ISO13485或同等标准规定的品质管理系统,此品质管理系统还需顾及MDACS的规定。第III类和IV类医疗仪器的制造商必须设立涵盖设计和开发的全面品质管理系统,而第I类和II类医疗仪器的制造商必须设立的品质管理系统则无须包括设计和开发活动。[6]详情参考指南GN08。
6 上市前监管
制造商如以本身的名义把任何级别的医疗仪器推出市面(包括本地或国外市场),必须向MDCO提供有关仪器的名单。名单须包括有关仪器的品牌、型号等资料,并最好载有仪器的级别及常用名称或说明。[7]
上市前的管制分两个方面:包括产品本身和把产品引进香港销售市场的人士。针对产品的管制,其安全及性能必须符合遵循国际协调GHTF所制定的系列标准法规。针对把产品引进香港销售的人士,当局建议规定制造商和进口商须要注册,以便有需要时可确认须采取跟进行动的负责人。[7]
下表列举了因医疗器械的不同风险等级对产品及业界的注册要求:
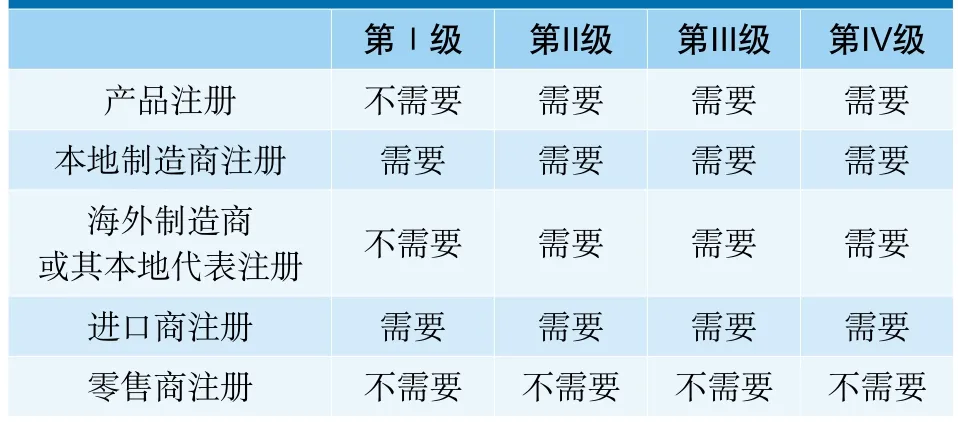
表1 不同风险等级医疗器械注册要求[7]
7 上市后监管
医疗仪器推出市面以后,制造商仍必须确保其安全。医疗仪器的功效,呈报与使用医疗仪器有关的问题,是整个规管过程中的重要一环。上市后监管工作主要涵盖两个具体范畴:主动监察和呈报医疗事故。[7]
7.1 主动监察
建议制造商建立一套制度,针对某些选定的高风险医疗仪器,例如:维持人体生命的永久植入物,就其功效及安全程度广集资料。该仪器若出现问题会对健康构成严重的不良影响,甚至导致死亡。为避免这些仪器的使用对人体的健康构成潜在的危险,应采取各种预防措施。[7]
7.2 不良事件报告和召回
医疗事故的呈报主要包括两个渠道:一是通过网络方式,由当地负责人进行网上在线通报;二是由供应商、使用者和大众通过信件、传真或e-mail自发性通报。
目前尚没有正式的呈报机制,可藉以找出市面上出现严重问题的医疗器械,从而采取跟进行动。机电工程署负责维修卫生署及医药管理局辖下医院医疗仪器的主要机构,若仪器有问题,机电工程署会与仪器的制造商做出跟进。卫生署收到自海外医疗仪器警报通知后,会将信息发布给各私立医院、医院管理局和医护专业人员。现没有法例规定制造商或进口商必须保存分销记录,他们也无须向卫生署呈报医疗事故。一旦出现有问题的仪器流入市场,当局未必能及时采取补救行动来保障公众健康。[8]
[1] 香港-百度百科[EB/OL].[2008-01-16]. http://baike. baidu.com/view/2607.htm.
[2] 医疗仪器行政管理制度概览指南GN-01.[2008-01-16]. http://www.mdco.gov.hk/sc_chi/mdacs/mdacs_gn/files/ gn_01_1sep2005.pdf
[3] 香港卫生署网站[EB/OL].[2008-01-16]. http://www. mdco.gov.hk/sc_chi/abt/abt_mdco/abt_mdco.htm l
[4] Update on Harmonization Efforts by Hong Kong [EB/ OL].[2008-01-16].
[5] 香港卫生署网站[EB/OL].[2008-05-31]. http://www. mdco.gov.hk/sc_chi/mdacs/mdacs_gn/mdacs_gn.htm l
[6] 本地制造商表列事宜指南 GN-08. [2008-01-16]. http://www.mdco.gov.hk/sc_chi/mdacs/mdacs_gn/files/ gn08_2007.pdf
[7] 香港对医疗器械实施的规管 咨询文件[EB/OL].[2008-03-14]. http://www.mdco.gov.hk/sc_chi/emp/emp_ gp/f i les/consultation_document.pdf
[8] 本地负责人医疗事故呈报指南 GN-03. [2008-01-16]. http://www.mdco.gov.hk/sc_chi/mdacs/mdacs_gn/files/ gn_03_2005.pdf
Overview of Medical Device Regulatory Requirements in Hongkong
CHEN Xin M I Xian-qiang
School of Medical Instrument and Food Engineering. University of Shanghai for Science and Technology (Shanghai 200093)
This article describes the medical device regulatory authorities and relevant laws and regulations in HongKong.
medical device, hongkong, regulatory
1006-6586(2010)07-0045-03
R197
A
2010-06-17
宓现强,副教授
