有机溶剂中脂肪酶催化辛酸辛酯的合成
2010-09-13张凤秀张光先
张凤秀,张光先
(1.西南大学化学化工学院,重庆 400715;2.西南大学纺织服装学院,重庆 400715)
有机溶剂中脂肪酶催化辛酸辛酯的合成
张凤秀1,张光先2,*
(1.西南大学化学化工学院,重庆 400715;2.西南大学纺织服装学院,重庆 400715)
以猪胰腺脂肪酶为催化剂合成辛酸辛酯。研究有机溶剂、反应温度、加水量、加酶量、反应时间、底物浓度及底物物质的量比7个因素对酶促酯化反应的影响,优化得到最佳合成条件。结果表明:最佳反应温度45℃、正己烷有机溶剂、加水量29μL、酶质量浓度2.314g/L、反应时间24h、辛酸与辛醇物质的量比为1:1.2~1:1.5、辛酸浓度为0.23~0.33mol/L。在优化条件下,辛酸的转化率达到98.12%以上,并通过IR、1H NMR、13C NMR谱表征了产物结构。酶催化法能在温和的反应条件下合成高产率的酯。
脂肪酶;合成;辛酸辛酯;有机溶剂;酯化反应
Abstract :The synthesis of caprylic caprylate catalyzed by lipase from porcine pancreas in an organic solvent was carried out to explore the effects of organic solvent type, reaction temperature, amount of added water, reaction time, lipase amount,substrate concentration and caprylic acid-to-caprylic alcohol ratio on caprylic acid conversion. The optimum organic solvent for caprylic caprylate synthesis was n-hexane. Reaction temperature of 45 ℃, amount of added water of 29 μ L, caprylic acid-tocaprylic alcohol ratio of 1:1.2-1:1.5, caprylic acid concentration of 0.23-0.33 mol/L, lipase concentration of 2.314 g/L were found optimum. Under these optimized conditions, the conversion ratio of caprylic acid was 98.12%. In addition, the structure of synthesized product was characterized by IR,1H NMR and13C NMR. This synthesis method can yield a high conversion ratio of caprylic acid under mild reaction conditions.
Key words:lipase;synthesis;caprylic caprylate;organic solvent;esterification
酯类化合物通常有一定的芳香味,广泛应用于配制各种果汁、食用香精、食品添加剂及化妆品中[1-2]。在工业上,酯类化合物常采用浓硫酸为催化剂的传统方法合成。该合成方法存在反应时间长、副反应多、产率低以及对生产设备带来严重腐蚀等缺点[3]。为此,许多学者在催化剂改进方面开展较多研究工作,比如采用氨基磺酸、甲烷磺酸、芳基磺酸(盐)(如苯磺酸和对甲苯磺酸)、树脂以及无机盐类(如高分子负载氯化铁、硫酸钛、三氯化铝)等催化剂合成酯[4-9]。虽然这些催化剂引起的副反应及对设备的腐蚀性比浓硫酸较小,且具有良好的催化性能,但仍存在一定的腐蚀性和环境污染问题,同时催化剂的回收利用率较低。
酶作为一种生物催化剂,它具有强的专一性、高的催化效率、反应条件温和、酶可回收利用、反应耗能低、原料要求低、产品质量高等优点,被认为是一种绿色催化剂[10-11]。因而,酶催化技术已广泛地应用于油脂、化工、食品、化妆品等行业中[12-14]。
食用香料辛酸辛酯属中、长碳链酯,其沸点高,有似玫瑰和蘑菇香气。目前,在工业上仍然采用浓硫酸为催化剂直接酯化法合成[15]。由于该合成方法需要的酯化温度高,这样会导致产物和反应物炭化严重,产率低,且产物的分离提纯需要的工艺条件较高。因此,本实验用猪胰腺脂肪酶为催化剂合成辛酸辛酯,考察底物浓度、底物物质的量比、反应温度、加酶量、加水量、有机溶剂和反应时间对酶催化合成辛酸辛酯的影响,探讨并优化最佳反应条件,并用IR谱、1H NMR和13C NMR谱表征产物结构,以期得到辛酸辛酯高转化率的最佳酶催化合成方法。
1 材料与方法
1.1 材料与试剂
猪胰腺脂肪酶(lipase from porcine pancreas TypeⅡ)美国Sigma公司;辛酸 中国医药上海化学试剂公司;辛醇 宁波大川精细化工有限公司;以上或其他试剂均为分析纯或化学纯。所有试剂使用前用3A分子筛干燥24h,使其脱去水分。
1.2 仪器与设备
SHA-B恒温振荡器 常州国华电器有限公司;HH系列六孔恒温水槽 江苏金坛中大仪器厂;Speclmm GX型红外光谱仪 美国PE公司;Av-300型核磁共振仪 瑞士Bruker公司。
1.3 方法
1.3.1 酯化反应
取100mL的带塞三角瓶,用微量取样枪移取一定体积的辛酸和辛醇,然后再向瓶中加入5mL有机溶剂、一定量酶粉、适量pH7.9的磷酸缓冲溶液及27mg无水硅胶组成反应体系,用带盖的橡胶塞子密闭。在一定温度,120r/min旋转振荡反应24h或设定一定时间,取样检测。每组实验设3次重复。
1.3.2 酯化反应转化率的测定
辛酸辛酯的沸点高,采用液相色谱法测定辛酸转化率与酸碱中和滴定法测定误差仅在2%左右。因此,本实验采用酸碱中和滴定法测定辛酸转化率以表示辛酸辛酯的产率。定时吸取一定量的反应液,立即向反应瓶中加入体积比2:1的乙醇-丙酮溶剂5mL终止反应。加10mL蒸馏水稀释,再加两滴酚酞指示剂,用0.05mol/L标准NaOH溶液滴定直至刚好出现粉红色为止,计算辛酸的转化率。转化率按式(1)计算。所得数据为3次重复实验的平均值。
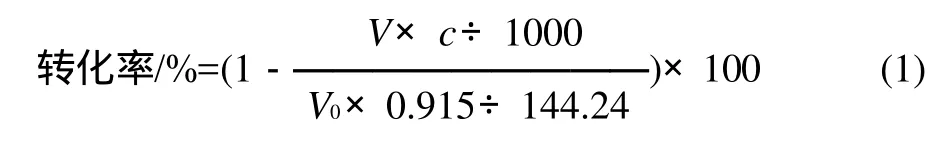
式中:V0为辛酸的初始体积/mL;144.24为辛酸的相对分子质量;0.915为辛酸的相对密度/(g/mL);V为消耗NaOH溶液的体积/mL;c为NaOH溶液的浓度/(mol/L)。
1.3.3 产物的分离提纯
收集转化率98%以上的反应液,抽滤除去反应液中的酶粉。将滤液转入100mL分液漏斗中,加入饱和Na2CO3溶液30mL,摇匀,静置、分层,除去下层溶液,保留上层液。这样连续操作2~3次,除去残余的辛酸。然后,用二次蒸馏水充分摇匀,洗涤2~3次。上层有机相转入100mL干燥的三角瓶中,加入适量的无水硫酸钠,干燥。在减压蒸馏下收集138~140℃馏分。得浅黄色辛酸辛酯纯品。
1.3.4 产物表征
用红外光谱仪(直接用辛酸辛酯液体压膜)测定IR谱。用核磁共振仪(TMS内标,CDCl3溶剂)测定1H NMR、13C NMR谱。
2 结果与分析
2.1 底物浓度对酶促酯化反应的影响
在辛酸与辛醇物质的量比为1:1、酶质量浓度为2.314g/L、加水量29μL、正己烷溶剂、45℃反应时间24h的反应条件下,考察底物浓度对酶促酯化反应的影响,结果见表1。
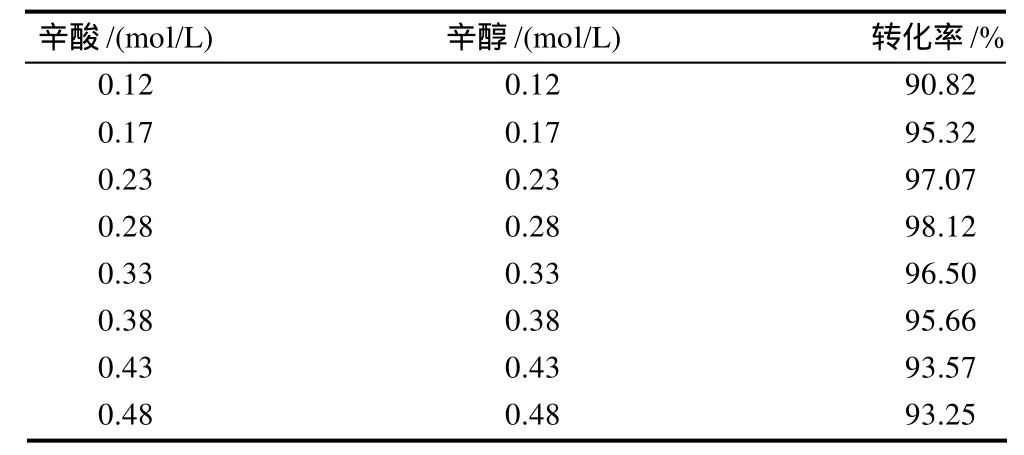
表1 不同底物浓度对酶促酯化反应的影响Table 1 Effects of caprylic acid and caprylic alcohol concentrations on caprylic acid conversion
由表1可知,当辛酸、辛醇的浓度低于0.28mol/L时,酯化反应的转化率随底物浓度的增加而增加。而高于0.28mol/L时,则转化率随底物浓度的增加而降低。酯化反应是一个可逆反应,为了提高产率,通常采用增加反应物的浓度方法来实现。但对于酶催化酯化反应,已有大量研究表明底物浓度过高会出现双底物的抑制作用[16-18]。因此,辛酸和辛醇底物浓度不宜过高,否则会起抑制作用,转化率下降。所以底物浓度为0.23~0.33mol/L最佳。
2.2 底物物质的量比对酶促酯化反应的影响
在酶质量浓度为2.314g/L、加水量29μL、正己烷溶剂、反应温度45℃、反应时间24h的条件下,考察底物物质的量比对酶促酯化反应的影响,结果见表2。
从表2可以看出,当辛酸浓度为0.30mol/L时,且辛酸与辛醇物质的量比为1.2:1,即辛酸过量时转化率最低。表明辛酸对酶的抑制作用较大,这可能是因为辛酸过量,降低了反应体系的pH值,从而对酶的活性起抑制作用。当辛酸浓度为0.25mol/L时,底物辛醇过量,辛酸与辛醇物质的量比在1:1.2~1:1.5范围,转化率最大,达到98%以上。但辛醇的浓度继续增加时,其物质的量比由1:1.7增加到1:3.0时,转化率明显递减。因此,辛酸与辛醇的物质的量比在1:1.2~1:1.5适宜。辛酸与辛醇的物质的量比为1:1.5最佳。但在实际生产上,综合考虑成本和经济效益,所以选择辛酸与辛醇的物质的量比为1:1.2为宜。
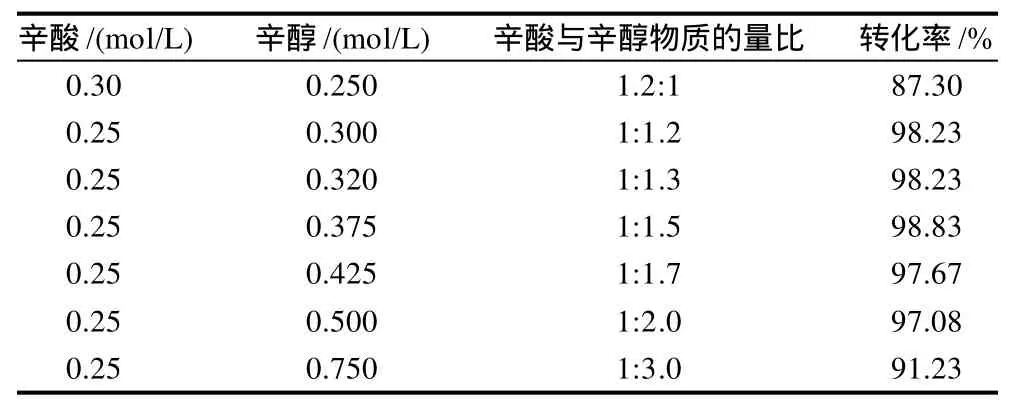
表2 底物物质的量比对酶促酯化反应的影响Table 2 Effect of caprylic acid-to-caprylic alcohol ratio on caprylic acid conversion
当辛酸浓度比辛醇过量20%时,转化率大幅度降低;而辛醇浓度比辛酸过量20%时,转化率不但没有下降,反而还升高。这表明辛酸浓度对酶的催化活力影响程度比辛醇大。脂肪酶的催化活力对羧酸浓度高低更为敏感。当然,辛醇浓度太高,也直接影响酶的催化活力,使转化率下降。可见,辛酸和辛醇对酶催化有双底物抑制作用。这是因为反应过程中有可能形成一种三元络合物酶-辛醇-辛酸,反应速率则由三元络合物的浓度确定。只有当两底物取合适的比例时,酶-辛醇-辛酸络合物的浓度最大,反应速率最快,转化率高。理论上当两底物物质的量比为1:1时,三元络合物的浓度最大,反应速率应最快。但本实验体系中转化率最高值时的酸醇物质的量比为1:1.2~1:1.5。这是因为在生成酯的过程中,存在着脂肪酸进入酶的底物结合部位并与酶形成酯化酶复合物,而辛醇接近酶的活性位点,会阻碍酯化酶复合物形成酯的关键步骤。
2.3 反应温度对酶促酯化反应的影响
反应温度对酶促酯化反应影响很大。温度过高或过低,都会直接影响酶的催化活力。在辛酸0.25mol/L、辛醇0.30mol/L、辛酸与辛醇物质的量比为1:1.2、加水量29μL、酶质量浓度为2.314g/L、反应时间24h、正己烷溶剂的反应条件下,考察35~60℃不同温度对酶促酯化反应的影响,结果见图1。
由图1可知,在低温阶段(35~45℃),随着反应温度的升高转化率逐渐增加;当反应到一个临界温度即最适温度(45℃)时,酶的活力出现最佳状态,转化率最大。当反应温度超过最适温度(>45℃)时,随着温度逐渐升高,转化率呈下降趋势;当反应温度高于50℃时,转化率下降幅度越来越大。这是因为酶分子的构象对反应温度的变化十分敏感。低温时酶分子的柔性不够,因而催化活力不够高。随着温度的逐渐升高,酶分子的柔性也逐渐增加;当增加到45℃时,酶分子的柔性达到最佳状态,此时表现出最佳的催化活力。继续增加温度,酶分子的柔性增加过大,其催化活力会逐渐下降。在较高的反应温度下,有部分酶分子出现变性现象,已经丧失了其催化能力。因而辛酸的转化率急剧下降。由此可知,猪胰腺脂肪酶催化辛酸辛酯合成的最佳温度为45℃。

图1 反应温度对酶促酯化反应的影响Fig.1 Effect of reaction temperature on caprylic acid conversion
2.4 加水量对酶促酯化反应的影响
在有机溶剂中维持脂肪酶催化活性的构象需要微量的水分,因此,在反应体系中加入一定量的水是必需的[13-14]。由于加水量的多少会直接影响酶的构象变化,从而影响酶的催化活力。在辛酸0.25mol/L、辛醇0.30mol/L,辛酸与辛醇物质的量比为1:1.2、酶质量浓度为2.314g/L、温度为45℃、反应时间为24h、正己烷溶剂的反应条件下,考察加水量对酶促酯化反应的影响,结果见图2。
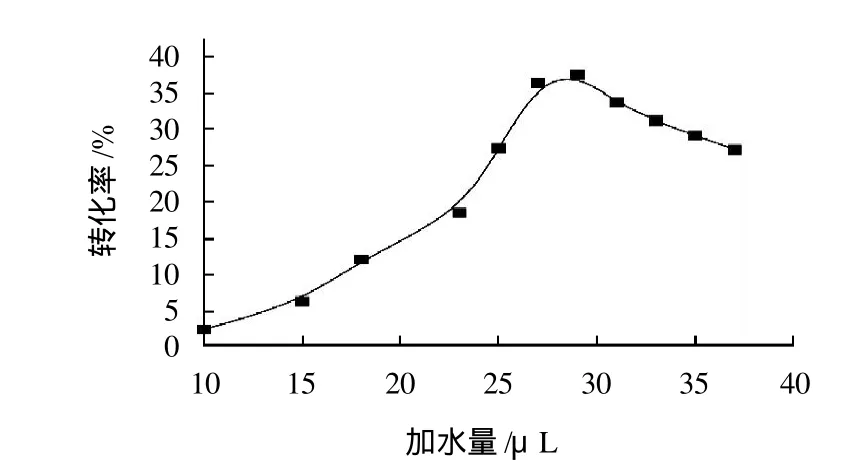
图2 加水量对酶促酯化反应的影响Fig.2 Effect of amount of added water on caprylic acid conversion
由图2可知,随反应体系加水量的递增,辛酸的转化率呈钟形曲线。在10~29μL范围,随着加水量的增加,转化率也随之增加。而加水量在27~29μL范围,酶的活力最佳,转化率高。继续增加水量,转化率则呈现下降的趋势。这是因为维持酶蛋白分子结构的几种非共价键相互作用(静电引力、范德华力、氢键和疏水间作用力)都与水有关。当水量低于最适水量时,酶构象过于“刚性”,失去催化活力。过多的水量会导致酶的柔性增加程度过大,引起其热力学稳定状态的变化,不利于维持酶分子活性的三维立体空间构象,使酶的活性下降。只有适量的水量才使酶结构的动力学“刚性”和热力学稳定性之间达到最佳平衡点,酶的催化活性处于最佳状态[19]。因此,本实验中适宜的加水量为29μL。
2.5 有机溶剂对酶促酯化反应的影响
脂肪酶在有机溶剂中的活性与溶剂的疏水性大小有关[14]。有机溶剂的疏水性与酶活力之间的关系用一个参数lgP作为衡量指标。lgP表示一种有机溶剂在正辛醇-水两相溶液中的分配系数的对数,其中P为分配系数。lgP值越大,溶剂的疏水性越高。有机介质中生物催化一般遵守以下规律[19-20]:lgP<2的极性溶剂不适合生物催化系统;2<1gP<4的溶剂对酶表面水层的干扰不大;lgP>4的溶剂不干扰酶的必需水层,酶能保持活性构象。在辛酸0.25mol/L、辛醇0.30mol/L、辛酸与辛醇物质的量比为1:1.2、酶质量浓度为2.314g/L、加水量为29μL、温度为45℃、反应时间为24h的反应条件下,考察4种有机溶剂:苯、甲苯、正己烷、吡啶对酶酯化反应的影响,结果见图3。
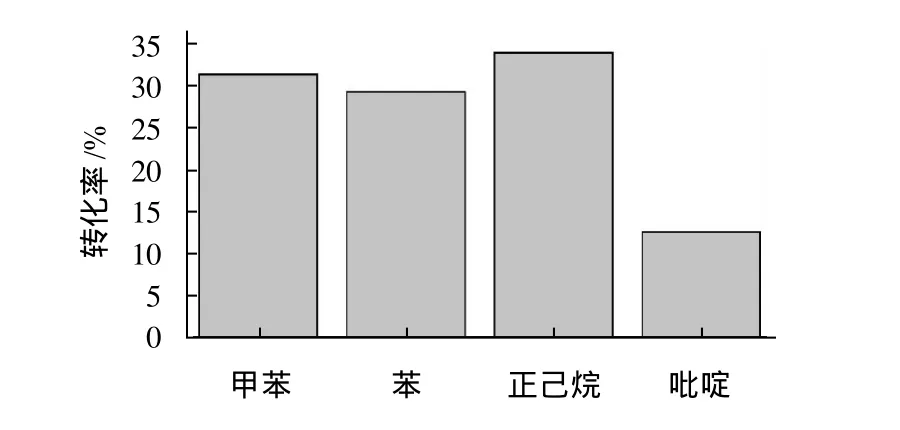
图3 有机溶剂对酶促酯化反应的影响Fig.3 Effect of organic solvent type on caprylic acid conversion
实验所用4种有机溶剂的疏水性大小(lgP)次序为:正己烷(lgP=3.5)>甲苯(lgP=2.5)>苯(lgP=2.0)>吡啶(lgP=1.04)。正己烷的疏水性最好,而吡啶的亲水最强。由图3可以看出,酯化反应在4种溶剂中辛酸的转化率由高到低的次序为:正己烷>甲苯>苯>吡啶。这与溶剂的疏水性大小一致。这可能是由于吡啶溶剂亲水性较强,易剥夺酶分子表面的必需水层,使酶容易失活。而疏水性强的正己烷溶剂不会干扰酶分子表面的必需水层,也不会干扰底物向酶表面扩散,从而使脂肪酶很好地发挥催化作用。
2.6 反应时间对酶促酯化反应的影响
在辛酸0.25mol/L、辛醇0.30mol/L、辛酸与辛醇物质的量比为1:1.2、酶质量浓度为2.314g/L、温度为45℃、加水量为29μL、正己烷溶剂的反应条件下,一定时间取样测定转化率,得酯化反应转化率随反应时间的变化曲线,结果见图4。
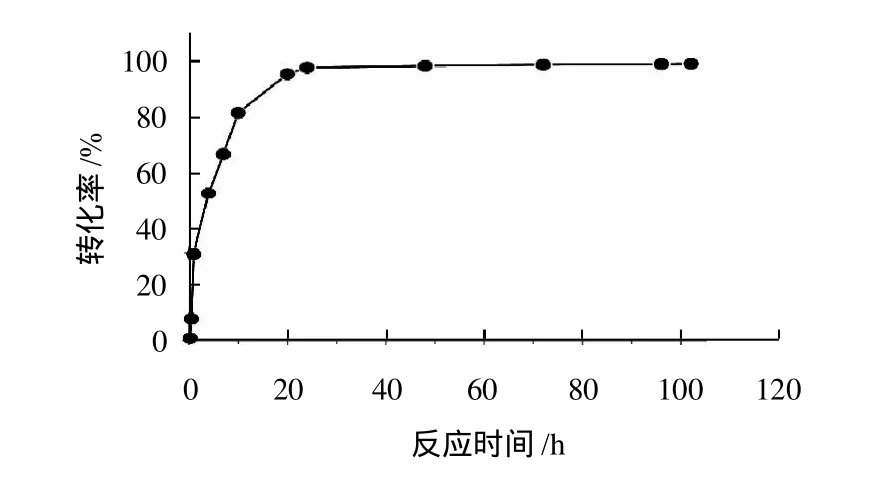
图4 反应时间对酶促酯化反应的影响Fig.4 Effect of reaction time on caprylic acid conversion
从图4可以看出,在反应10h内,随着时间的增加,反应速度加快,转化率几乎成呈线性上升。在反应10h时,转化率已达到82.38%。10h以后,反应速度开始减慢,转化率提高幅度不大。在反应24h,其转化率为97.8%。24h以后,转化率几乎没有提高。这是因为酯化反应是一个可逆反应,在反应开始时(10h内),由于反应物的浓度高,正反应速度加快,转化率大幅度提高。当反应到达一定时间(10h)以后,随着产物酯浓度的增加,正反应速度逐渐减小,而逆反应速度逐渐增大,转化率提高幅度不大。在24h以后酯化反应基本达到动态平衡,因此转化率提高幅度更小。所以反应时间确定24h为宜。
2.7 加酶量对酶促酯化反应的影响
在辛酸0.25mol/L、辛醇0.30mol/L、辛酸与辛醇物质的量比为1:1.2、温度为45℃、加水量为29μL、反应时间为24h、正己烷溶剂的反应条件下,考察不同加酶量对酯化反应的影响,结果见图5。

图5 不同加酶量对酯化反应的影响Fig.5 Effects of lipase amount on esterification
由图5可以看出,当酶质量浓度较低(低于2.314g/L)时,随着酶质量浓度的增加,转化率逐渐增高。在酶质量浓度为2.314g/L时的转化率达到最大。继续增加酶质量浓度,其转化率几乎没有增加。这是因为在反应体系中酶以酶-底物络合物的形式存在。当酶质量浓度较低时,这种酶-底物络合物的质量浓度不高,因此辛酸的转化率不高。随着酶质量浓度的增加,酶-底物络合物的质量浓度增加,其转化率也增加。而酶质量浓度过高,则过剩的酶没有被充分利用,导致酶浪费,所以酶质量浓度为2.314g/L为宜。
2.8 产物结构表征
产物经分离提纯后,分别经过红外光谱(IR)、核磁共振氢谱(1H NMR)和核磁共振碳谱(13C NMR)表征,见图6~8。
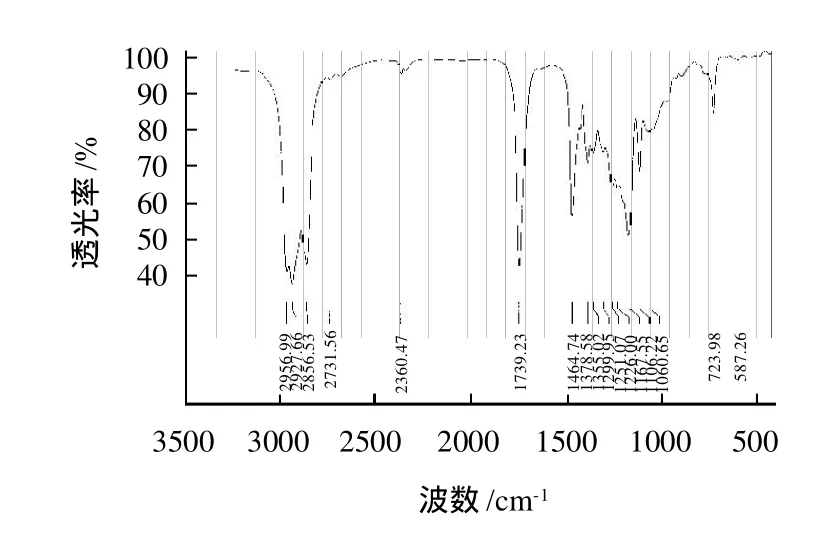
图6 产物的红外吸收光谱Fig.6 IR spectrum of the synthesized product
由图6可知,在3600cm-1附近没有辛醇的羟基(—OH)特征吸收峰,同时在1680cm-1与3200cm-1附近也没有辛酸的羰基(C=O)及羟基(—OH)的特征吸收峰,可以判断辛酸、辛醇已经被除去。在2856.57~2958.41cm-1处出现甲基(—CH3)和亚甲基(—CH2)的强伸缩振动吸收峰,并在1378.58~1464.74cm-1出现甲基(—CH3)和亚甲基(—CH2)碳氢键(C—H)的弯曲振动峰;723.98cm-1为亚甲基(—CH2)面内摇摆振动峰。在1739.74cm-1处出现饱和脂肪酸酯羰基(C=O)的强伸缩振动吸收峰,并在1106.22~1299.95cm-1处出现脂肪酯碳氧键(C—O)的强伸缩吸收峰,这个区域的吸收峰又与亚甲基(—CH2)的弯曲振动峰重合。因此,可以判断产物是酯类化合物。
IR谱从产物结构基团角度,确认产物有酯基、甲基和亚甲基的存在。为了进一步确认产物的结构,通过测定1H NMR谱和13C NMR谱来确定产物中氢原子、碳原子的种类和个数。其1H NMR谱和13C NMR谱图的结果见图7、8。
由图7、8可以得到产物中各种氢原子和碳原子的化学位移(δ),其数据如下:1H NMR(CDCl3,300MHz)δ:0.86~0.88(d, J=6.28Hz, 6H, 2CH3);1.28 (s, 18H,9CH2);1.594~1.638(t, J=6.52Hz, 4H, 2CH2);2.265~2.316(t, J=6.79Hz, 2H, CH2);4.034~4.079(t, J=7.13Hz, 2H,CH2)。13C NMR(CDCl3,300MHz)δ:14.05、14.07、22.59、22.65、25.03、25.9、28.64、28.93、29.11、29.18、29.20、31.66、31.77、34.41、64.39、172.9。
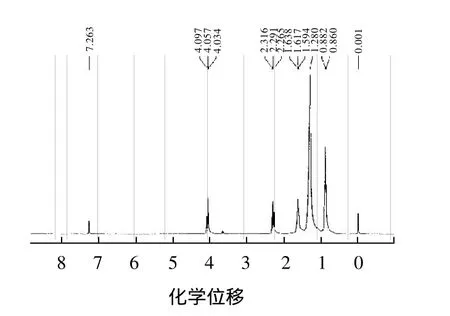
图7 产物核磁共振氢谱(1H NMR)Fig.71H NMR spectrum of the synthesized product
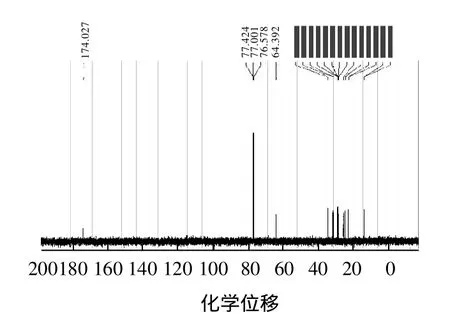
图8 产物核磁共振碳谱(13C NMR)Fig.813C NMR spectrum of the synthesized product
根据1H NMR、13C NMR数据分析,可以推测出产物结构及相关数据归属,结果见图9。
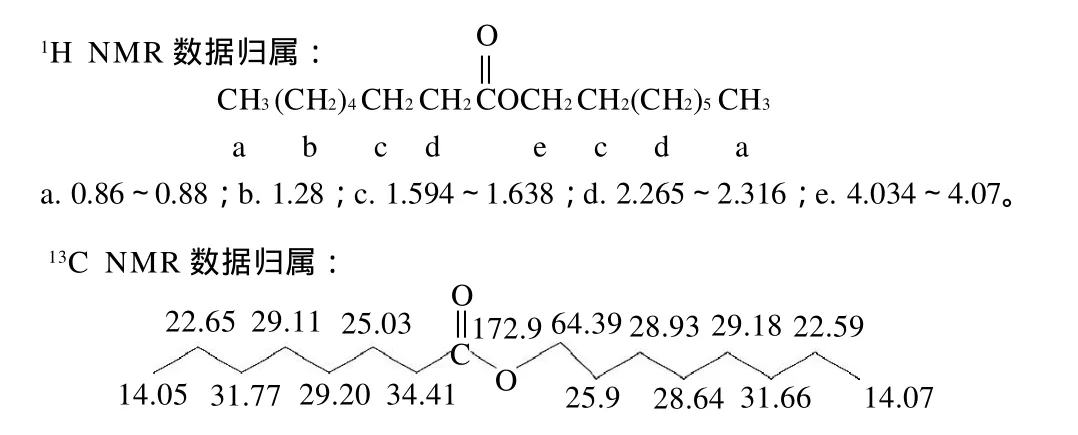
图9 产物的结构式及1H NMR、13C NMR谱数据归属Fig.9 Structure of the synthesized product and1H NMR and13C NMR spectral assignment
通过IR、1H NMR、13C NMR谱表征,证实了辛酸辛酯产物的结构。
3 结 论
采用猪胰腺脂肪酶催化辛酸与辛醇的酯化反应,优化得到最佳反应条件:正己烷溶剂、反应温度45℃、加水量29μL、酶质量浓度2.314g/L、反应时间24h、辛酸浓度为0.23~0.33mol/L、辛酸与辛醇的物质的量比为1:1.2~1:1.5。在优化条件下,辛酸的转化率达到98.12%以上,并通过IR、1H NMR、13C NMR谱表征了产物结构。酶催化法能在温和的反应条件下合成得到高产率的酯,可为中、长碳链的生物合成实现工业化生产提供一定的实验依据。
[1] 济南市轻工业研究所. 合成食用香料手册[M]. 北京: 中国轻工业出版社, 1985: 364-521.
[2] 许戈文, 李布青. 合成香料产品技术手册[M]. 北京: 中国商业出版社, 1996: 284-285.
[3] 章思规. 精细有机化学品技术手册: 上册[M]. 北京: 科学出版社, 1992:149.
[4] 赵汝琪. 氨基磺酸催化合成丁酸异戊酯的研究[J]. 化工科技, 2000,5(5): 30-32.
[5] 勒通收, 杨军红. 以甲磺酸为催化剂合成苯甲酸乙酯[J]. 化学试剂,1993, 15(3): 180; 185.
[6] 王敏, 姜恒, 宫红, 等. 甲烷磺酸铜催化合成丁酸酯的性能[J]. 应用化学, 2004, 21(6): 617-620.
[7] 翁文, 许丽华, 李国平, 等. 四氯化锡催化合成乙酸异戊酯的合成[J].应用化学, 2001, 18(3): 244-245.
[8] 平伟军, 俞善信, 张鲁西. 氯化铁催化合成羧酸异戊酯[J]. 湖南化工,1998, 28(6): 26-27.
[9] 吴晓松, 杨志成, 林享应. 树脂催化合成丁酸异戊酯的研究[J]. 华东地质学院学报, 2000, 23(1): 45-48.
[10] 刘海洲, 刘均洪, 张媛媛, 等. 微生物脂肪酶的最新应用研究进展[J].食品研究与开发, 2009, 30(1): 141-143.
[11] 曾家豫, 周兴辉, 张继, 等. 有机介质中酶催化合成己酸乙酯的研究[J]. 食品科学, 2009, 30(6): 123-127.
[12] ZAKS A, KLIBANOV A M. Enzymatic catalysis in organic media at 100 degrees[J]. Science, 1984, 224(15): 1249-1251.
[13] 吴小梅, 辛嘉英, 张颖鑫, 等. 无溶剂体系中的脂肪酶催化反应研究进展[J]. 分子催化, 2006, 20(6): 597-603.
[14] 陈惠黎, 李文杰. 分子酶学[M]. 北京: 人民卫生出版社, 1983: 232.
[15] 化学工业出版社组织. 中国化工产品大全[M]. 北京: 化学工业出版社, 1998: 759.
[16] SUN Shuyang, XU Yan, WANG Dong. Novel minor lipase from Rhizopus chinensis during solid-state fermentation: Biochemical characterization and its esterification potential for ester synthesis[J]. Bioresource Technology, 2009, 100(9): 2607-2612.
[17] 赵天涛, 张丽杰, 高静, 等. 脂肪酶催化乳酸与乙醇合成乳酸乙酯的反应动力学[J]. 催化学报, 2008, 29(2): 141-144.
[18] GAO Yinyu, CHEN Wenwei, LEI Hanwu, et al. Optimization of transesterification conditions for the production of fatty acid methyl ester(FAME) from Chinese tallow kernel oil with surfactant-coated lipase[J].Biomass and Bioenery, 2009, 33(2): 277-282.
[19] 曹淑桂. 有机溶剂中酶催化研究的新进展: 酶催化活性和选择性的控制与调节[J]. 化学通报, 1995(5): 5-12; 17.
[20] 曹淑桂, 刘占斌, 冯雁丁, 等. 脂肪酶在有机溶剂中催化酯合成和酯交换反应[J]. 高等学校化学学报, 1991, 12(11): 1555-1557.
Enzymatic Synthesis of Caprylic Caprylate in an Organic Solvent
ZHANG Feng-xiu1,ZHANG Guang-xian2,*
(1. College of Chemistry and Chemical Engineering, Southwest University, Chongqing 400715, China;2. College of Textile and Garment, Southwest University, Chongqing 400715, China)
TS225 3
A
1002-6630(2010)15-0044-06
2009-12-23
重庆市科委自然基金项目(CSTC,2008BB4250);西南大学博士基金项目(swu109052)
张凤秀(1965—),女,副教授,博士,研究方向为生物有机合成。E-mail:zhangfx656472@sina.com
*通信作者:张光先(1965—),男,教授,博士,研究方向为生物有机合成。E-mail:zgx656472@sina.com
