穿琥宁体外稳定性研究
2010-09-13王鹏江云鸥张志勇四川大学华西药学院成都市610041四川大学华西医院药剂科成都市610041
王鹏,江云鸥,张志勇(1.四川大学华西药学院,成都市 610041;2.四川大学华西医院药剂科,成都市 610041)
穿琥宁体外稳定性研究
王鹏1,2*,江云鸥1,2,张志勇2#(1.四川大学华西药学院,成都市 610041;2.四川大学华西医院药剂科,成都市 610041)
目的:研究穿琥宁的体外酸碱及酶稳定性。方法:将穿琥宁溶解于不同pH值(2.0~9.0)的磷酸缓冲液、人工肠液和不同浓度的肝组织匀浆液中,37℃恒温水浴,于不同时间取样,高效液相色谱法测定穿琥宁的浓度,考察其降解情况或降解动力学。结果:穿琥宁在酸性(pH 2.0~5.0)条件下迅速降解(温孵1 h后残余量低于10%);在pH 7.0磷酸溶液、人工肠液中相对稳定,2 h内各取样点的穿琥宁含量均高于95%;37℃下,在50%肝匀浆液中温孵24 h后,降解23%;在25%肝匀浆液中温孵24 h后,降解15%,且随肝匀浆液浓度的增大而降解加快。结论:穿琥宁在pH<5.0的环境下极不稳定;而胰酶对其几无影响;在肝匀浆液(pH 7.0)中不稳定,肝微粒体酶对其有一定影响。
穿琥宁;肝匀浆;酸碱稳定性;酶稳定性
穿琥宁(Potassium Dehydroandrographolide Succinate,PDS)是以穿心莲叶提取之穿心莲内酯在吡啶催化下与琥珀酸酐反应所得的穿心莲内酯琥珀酸半酯单钾盐[1],具有抗菌消炎、清热解毒、促进肾上腺皮质功能及镇静作用。目前多以静脉注射给药,但残留其中的吡啶容易引起副作用,且使用不方便。郑永等[1]将PDS制备成肠溶胶囊,回避了胃液对其的降解问题[2],但研究结果表明,其绝对生物利用度仍然较低。此外诸如中空栓剂[3]等非注射制剂,生物利用度也均不理想。为此,笔者考察了PDS在不同pH值溶液、人工肠液、大鼠肝匀浆液中的稳定性,采用体外方法探讨胃液、肠液及肝微粒体酶可能产生的影响,推测其口服生物利用度较低的原因,为该药制剂的进一步开发提供依据。
1 仪器与材料
1.1 仪器
UV-2401型紫外分光光度计(日本岛津公司);LC-10AT-vp型高效液相色谱(HPLC)仪、SPD-M10Avp型紫外检测器(美国Waters公司);pHS-4C型pH计(成都方舟电子有限公司);TG16-WS型台式高速离心机(湘仪离心机仪器有限公司);ZSQ型恒温水浴锅(上海志成分析仪器制造有限公司);DZF-6020型真空干燥箱(上海一恒科学仪器有限公司);YKH-I型快速混合器(北京泰立电子技术有限公司)。
1.2 试药
胰酶(美国Sigma公司);脱水穿心莲内酯琥珀酸半酯对照品(中国药品生物制品检定所,批号:111598-200807);穿琥宁原料药(四川广汉市维康植化有限公司,批号:070228);水为纯化水,甲醇为色谱纯,其余试剂均为分析纯。
1.3 动物
SD大鼠5只,♀,体质量约170 g,由四川大学华西实验动物中心提供(合格证号:0003481)。
2 方法
2.1 色谱条件[4]
色谱柱:Phenomenex C18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.05%KH2PO4水溶液(pH 2.51,65∶35);流速:1 mL·min-1;柱温:30 ℃;进样量:20 mL;检测波长:251 nm。
2.2 不同pH值溶液[5]与肝匀浆液的制备
称取磷酸二氢钾3.4 g,加水溶解稀释至500 mL,分成10份,每份50 mL,4份用磷酸分别调pH至 2.06、3.03、3.99、4.49,另6份用1%氢氧化钠分别调pH至5.01、5.50、6.01、7.00、7.98、9.01。
SD大鼠禁食过夜,断头处死,立即取肝脏,剔去脂肪与结缔组织,冰浴下以生理盐水洗去残留血液,再冰浴下以20%磷酸缓冲液(pH 7.0)手动匀浆,即得。
2.3 PDS在不同pH值磷酸缓冲液中的稳定性
精密称取真空干燥至恒重的PDS 3.9 mg若干份,用不同pH值磷酸缓冲液50 mL溶解混匀后,置于37℃水浴中,水浴1 h后迅速冷却至室温,以微孔滤膜滤过,各取20 μL,测定PDS浓度。
2.4 PDS在最适pH值溶液、人工肠液(不含胰酶)、人工肠液(含有胰酶)[6,7]中的稳定性
精密称取真空干燥至恒重的PDS 3.9 mg,溶于pH 7.00溶液与人工肠液(不含胰酶)各50 mL中,混匀,置于37℃水浴中,20 min后取样1次,迅速冷却至室温,以微孔滤膜滤过,各取20 μL,测定PDS浓度。
精密称取PDS 30.9 mg,定容于10 mL50%甲醇液中,取5 mL于人工肠液(含胰酶)中制成50 mL温孵液,置于37.5℃水浴中,每20 min取样1 mL,迅速添加冰乙腈3 mL,5 000 r·min-1离心10 min,取上清各20 μL,测定PDS浓度。
2.5 PDS在肝匀浆液中的稳定性
分别精密称取PDS 3.6 mg若干份,分别溶解于25 mL 50%肝匀浆液、25 mL 50%煮沸灭活肝匀浆液、25 mL 25%肝匀浆液、25 mL 25%煮沸灭活肝匀浆液中,(37.5±0.5)℃水浴温孵,分别于0、1、2、4、8、24 h各取1 mL,添加3 mL冰乙腈,漩涡2 min混匀,5 000 r·min-1离心10 min,取上清20 μL进样,测定PDS浓度。
3 结果
3.1 PDS各模拟生物液和肝匀浆液中分析方法的建立
在“2.1”项下色谱条件下,肝匀浆液中的杂质不干扰样品测定,PDS的保留时间为9.0 min左右,分离效果较好。
在模拟pH液中,标准曲线为A=21 019.095 28C-24 446.520 24(r=0.999 9),线性范围为14.88~178.56 μg·mL-1;平均回收率介于96.45%~99.80%之间,精密度RSD<2%。在肝匀浆液(25%)中,标准曲线为A=90 326.482 03C-19 040.503 97(r=0.999 9),线性范围为16.8~463.2 μg·mL-1;平均回收率介于96%~105%之间,日内精密度RSD<1%,日间精密度RSD<2%。PDS的HPLC见图1。
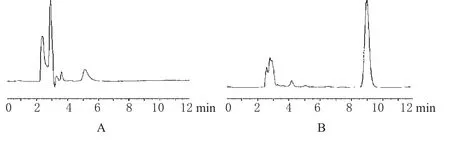
图1 穿琥宁的HPLC图A.空白肝匀浆;B.PDS肝匀浆Fig 1 HPLC chromatograms of PDSA.blank liver homogenate;B.blank liver homogenate with PDS
3.2 PDS在不同溶液中的稳定性
在pH<4.5段,温孵1 h后,PDS完全降解;在4.5<pH<5.5段,PDS有不同程度的降解,该pH区域是PDS降解程度变化较大的区域;5.5<pH<8.0段,温孵1 h后,PDS少量或者几乎无降解;pH 7.0为PDS的最适pH值。不同pH值条件下PDS的稳定性见图2。
人工胃液pH值为1.5~2.0,说明PDS在人工胃液中极不稳定,与文献报道家兔ig PDS无法测得血药浓度的原因[2]相符。故选择在人工肠液中测定PDS降解率。
3.3 PDS在人工肠液中的降解率
37℃下温孵1 h,PDS在pH 6.0~8.0段较稳定,2 h内各取样点的浓度均高于96%。进一步观察在pH 7.0下PDS降解情况,37℃温孵2 h后,PDS在pH 7.0溶液仅少量降解(低于3%),2 h内各取样点PDS浓度均高于97%。pH 7.0下PDS的稳定性见图2。
当药物进入人体消化道后,降解不仅受pH值的影响,还受到人体众多消化酶的影响,为此考察PDS在人工肠液中的降解情况。人工肠液的pH为6.8,同时在不含胰酶的人工肠液与含有胰酶的人工肠液中37℃温孵2 h,各取样点下PDS的含量均高于95%,后经SPSS 17.0软件进行统计学分析,两者之间无显著差异(P<0.05)。人工肠液中PDS的稳定性见图3。
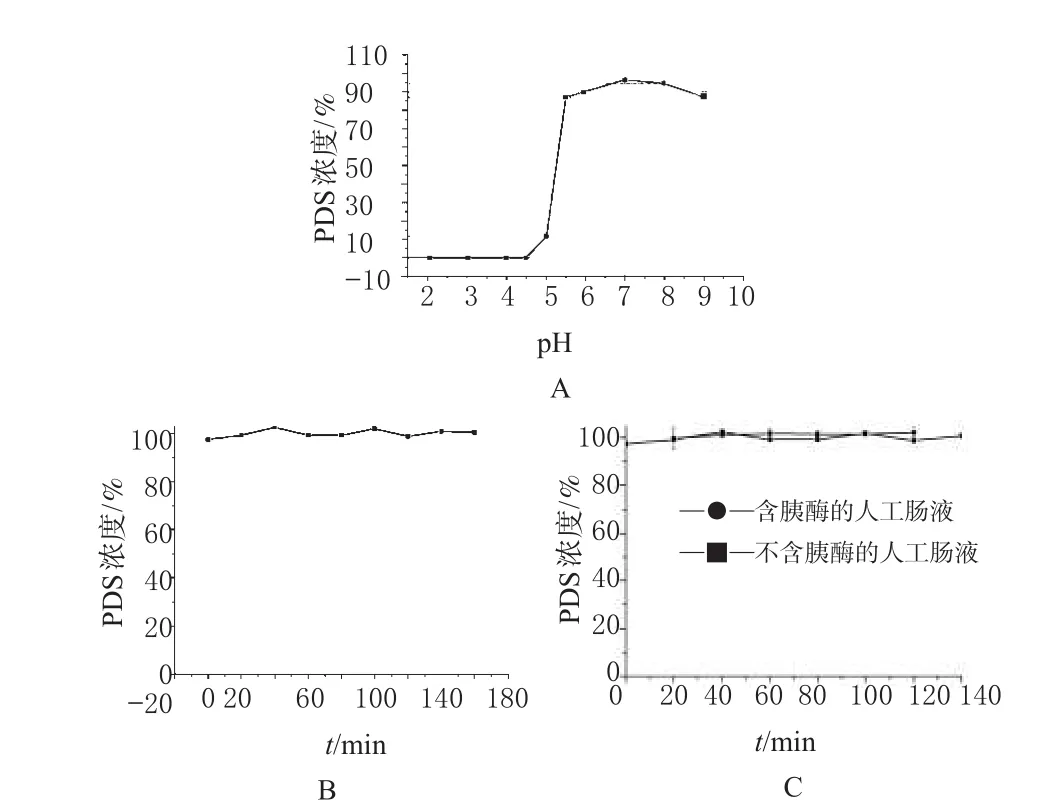
图2 穿琥宁的稳定性A.不同pH值条件下;B.pH 7.0;C.人工肠液中Fig 2 The stability of PDSA.at different pH value;B.pH 7.0;C.stimulated intestinal fluid
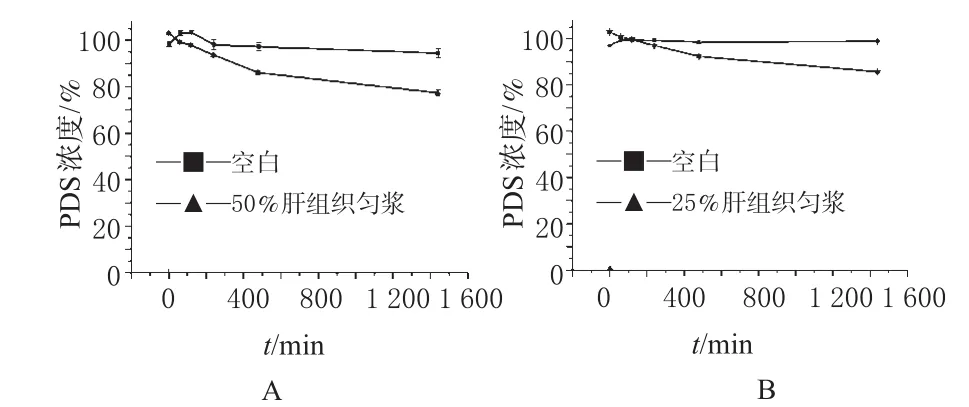
图3 穿琥宁降解过程(n=3)A.在50%肝组织匀浆中;B.在25%肝组织匀浆中Fig 3 Degradation process of PDS(n=3)A.50%liver homogenate;B.25%liver homogenate
3.4 PDS肝组织匀浆液中的降解动力学
结果表明,PDS在50%、25%肝组织匀浆中均有一定程度的降解,而在相应浓度的灭活肝匀浆液中,PDS则较稳定。2组实验中,对照组与实验组之间PDS浓度具有明显差异。PDS降解过程见图5。
由图5可知,当PDS浓度为50%时,t1/2=27.26 h;浓度为25%时,t1/2=42.77 h。
4 讨论
PDS作为一个常用的抗菌消炎药,临床应用的剂型主要是注射剂等,药动学研究也大多集中在iv后的药动学上,对于其口服体内过程的研究较为欠缺。本研究旨在通过体外考察PDS的稳定性,探讨生物利用度较低的原因,结合已有文献资料,考察PDS的主要代谢部位。
本研究发现该药对低pH环境极为敏感,在pH<4.5的模拟胃肠道环境中,1 h后即完全降解,印证了张志勇等[2]给家兔直接ig PDS却无法测得血药浓度的结论。在4.5<pH<5.5的环境中,PDS有不同程度的降解,而肠道中局部pH可达到该区间,推测郑永等[1]对小鼠结扎幽门,肠腔注射PDS,而绝对生物利用度低下的原因可能是因为局部pH较低,使得PDS部分降解。
胰酶对照实验结果表明,肠道胰酶对PDS几无影响。但小肠上皮细胞中也存在CYP450药物代谢酶系。
37℃下温孵24 h,发现PDS在不同浓度的肝匀浆液中有不同程度的降解,说明PDS可能存在一定程度的首关效应,而肝内及小肠上皮中均可能存在代谢该药的酶。
PDS在pH低于5.0的胃肠道环境中代谢明显快于其他组织,提示该药可能是一个具有一定肝首关效应且对酸碱环境极为敏感的药物,适宜制备成能保护其不受肠道酸性环境影响,又能一定程度上减轻首关效应的制剂。
[1]郑 永,陈峰杰,周远大,等.穿琥宁药代动力学及绝对生物利用度的实验研究[J].实用医药杂志,2004,21(4):349.
[2]张志勇,廖工铁,王炳南,等.脱水穿心莲内酯琥珀酸半酯单钾盐在家兔体内的药代动力学研究[J].华西药学杂志,1991,6(3):129.
[3]刘海净,于宝成,白秋江,等.穿琥宁中空栓的制备及质量控制方法研究[J].中国药房,2007,18(33):2 586.
[4]黄 瑛,周益芬,付 平,等.HPLC法测定穿唬宁注射液的含量[J].中国药品标准,2003,5(4):34.
[5]邓 鸣,刘会臣.普伐他汀在模拟体内酸碱环境中的稳定性[J].中国医院药学杂志,2006,26(1):37.
[6]国家药典委员会编.中华人民共和国药典(二部)[S].2005年版.北京:化学工业出版社,2005:附录ⅩⅤ、附录158.
[7]陈怀侠,杜 鹏.东莨菪碱及其大鼠肝匀浆代谢物的液相色谱-质谱法分析[J].中草药,2009,40(5):719.
Study on the Stability of Potassium Dehydroandrographolide Succinate in Vitro
WANG Peng,JIANG Yun-ou(West China School of Pharmacy,Sichuan University,Chengdu 610041,China)
WANG Peng,JIANG Yun-ou,ZHANG Zhi-yong(Dept.of Pharmacy,West China Hospital of Sichuan University,Chengdu 610041,China)
OBJECTIVE:To investigate the stability of Potassium Dehydroandrographolide Succinate(PDS)in vitro in different pH and enzymatic solutions.METHODS:PDS was dissolved in different phosphate buffer solutions with pH of 2.0~9.0,stimulated intestinal fluid and liver homogenate of SD rats,thermostatically maintained at 37℃.The concentrations of PDS were determined by HPLC to investigate the degradation kinetics and stability of PDS.RESULTS:PDS was degraded in acid solution(pH 2.0~5.0)immediately(more than 90%PDS was degraded after 1 h of incubation),stable in phosphoric solution(pH 7.0)and stimulated intestinal fluid.The contents of PDS at different sampling points were more than 95%in 2 h.After 24 h of incubation at 37℃,23%PDS was degraded in 50%liver homogenate and 15%in 25%liver homogenate.The degradation speed up as the concentration of liver homogenate increased.CONCLUSION:PDS is instable in solution with pH<5.0 and liver homogenate(pH 7.0).The hepatomicrosome enzyme possesses effect on the stability of PDS while pancreatic enzymes is not.
Potassium Dehydroandrographolide Succinate(PDS);Liver homogenate;Acid-based degradation;Enzymatic degradation
R285;R97
A
1001-0408(2010)39-3664-03
2009-11-09
2010-03-12)
