低渗诱导栉孔扇贝三倍体及与其它方法的比较
2010-09-13张晨晨王昭萍于瑞海邸炜鹏
张晨晨,王昭萍,于瑞海,邸炜鹏,孔 静,刘 剑
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
低渗诱导栉孔扇贝三倍体及与其它方法的比较
张晨晨,王昭萍**,于瑞海,邸炜鹏,孔 静,刘 剑
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
采用低渗抑制受精卵第2极体(PB2)的释放诱导栉孔扇贝(Chlamys f arreri)三倍体。水温20℃时,分别进行不同盐度处理(8~20)、不同起始处理时间(受精后15~40 min)和不同持续处理时间(10~25 min)的实验,对三倍体处理组和对照组幼虫的生长进行观察,同时将低渗、6-DMAP、热休克、冷休克4种诱导方法进行对比。结果表明:受精后30 min开始处理20 min,诱导率最高,可达(92.36±2.41)%,卵裂率为(49.78±6.51)%,孵化率为(61.82±1.63)%;D形幼虫期,处理组幼虫表现出明显的生长优势(P<0.01),不仅生长速度快,而且发育到变态时个体比二倍体大;低渗诱导的三倍体率与6-DMAP相比无显著差异(P>0.05);与热休克和冷休克相比差异显著(P<0.01)。
栉孔扇贝;三倍体;低渗诱导
栉孔扇贝(Chlamys f arreri)味道鲜美,营养丰富,是我国北方扇贝养殖的主要种类,占扇贝养殖总产量的70%以上。已有的研究结果证实,三倍体栉孔扇贝与二倍体相比,具有明显的生长优势[1],闭壳肌和软体部的重量均大于二倍体[2-3],开发利用三倍体的生物学优势对提高我国扇贝养殖业的技术水平和经济效益具有重要意义。
自1990年代初以来,我国研究者先后用温度休克[4]、细胞松驰素B(简称CB)[5]、6-二甲基氨基嘌呤(简称6-DMAP)[6]等方法进行了栉孔扇贝三倍体的诱导研究。各种方法均能诱导产生三倍体但又各具其缺点。其中CB和6-DMAP诱导效果较好但诱导剂的毒副作用大大降低了幼虫的孵化率[5-6],操作繁琐,且诱导剂的安全性也有待进一步验证;温度休克虽然无毒,但其诱导率较低[4];四倍体与二倍体杂交的生物方法安全稳定,理论上三倍体率可高达100%,但目前通过抑制第一极体,仅得到5个栉孔扇贝四倍体稚贝[7],且未能保存下来,四倍体的培育仍是一道待攻克的难关。
低渗处理是1种诱导多倍体的新方法,在虾夷扇贝三倍体诱导中取得了较好效果[8]。本文报道了采用低渗方法诱导栉孔扇贝三倍体的结果,以及三倍体与二倍体的生长情况,并与其他诱导方法进行对比。
1 材料与方法
1.1 亲贝暂养、产卵、受精
实验用亲贝取自青岛仰口海区,壳长6~7 cm。雌、雄贝分开暂养于16℃的水体中,室内促熟培育。实验时挑选性腺充分成熟的雌、雄亲贝,阴干1 h后,分别放入2个水槽中,加入新鲜升温过滤海水,诱导排放。分别收集卵液和精液,人工受精。
1.2 低渗诱导
在40%~50%受精卵出现第一极体(PB1)时进行低渗处理,抑制PB2释放以获得三倍体。低渗盐度梯度为8,10,12,14,16,18,20,持续处理15 min。孵化后收集幼虫进行倍性分析,以确定最适低渗盐度。
采用最适低渗盐度,分别在受精后15,20,25,30, 35,40和45 min开始处理,持续处理15 min后放回正常海水孵化,根据幼虫倍性分析结果,确定最佳处理时机。
在上述实验基础上,采用得出的最佳处理盐度和最佳处理时机,分别对受精卵低渗处理10,15,20和25 min,根据幼虫倍性分析结果,确定最佳处理持续时间。
以上实验均重复3次以上,产卵及孵化水温均保持在20℃。
1.3 幼虫培育
采用最适诱导条件(低渗盐度、处理时机和处理持续时间)诱导栉孔扇贝的受精卵,以未处理的受精卵作为对照组,池内孵化,观察胚胎发育及卵裂情况;D形幼虫时用300目筛绢选幼,放入新池中培育,检测孵化率和诱导率。每日投饵、换水、观察幼虫生长及摄食情况,每2 d测量实验组与对照组幼虫的壳长,每次测量20个幼虫,从选幼开始到变态附着结束。
1.4 不同三倍体诱导方法比较
水温20℃,催产同一批扇贝的精卵,采用低渗、6-DMAP、热休克和冷休克4种方法诱导三倍体,比较其诱导效果。低渗处理采用本研究确定的最佳方按,其他方法采用文献报道的最佳处理方案:①低渗:本研究确定最佳盐处理条件;②6-DMAP:浓度60 mg/L,处理时间15 min[6];③热休克:30℃,处理时间15 min;④冷休克:1℃,处理时间20 min[4]。设对照组,统计受精率、孵化率和三倍体率。
1.5 幼虫倍性检测方法及相关参数
收集D形幼虫,加入DAPI荧光染液,采用Partec PAⅡ流式细胞仪(FCM)进行倍性检测。
卵裂率为分裂卵数占总处理卵数的百分比。孵化率为D型幼虫数占受精卵数的百分比。三倍体诱导率为三倍体分裂相占分裂相总数的百分比,由FlowMax Software软件计算得出。实验数据以平均值±标准差(mean±SD)表示,所有统计分析采用SPSS 13.0软件进行。
2 结果
2.1 流式细胞仪倍性检测结果
图1为对照组与最佳处理组的流式细胞仪倍性检测图,三倍体率高达94.93%。

图1 流式细胞仪倍性检测结果Fig.1 Ploidy level revealed by flow cytometry
2.2 不同低渗盐度的诱导效果
水温20℃条件下,40%~50%受精卵出现PB1时,用盐度为8~20的低渗海水处理15 min,结果见图2。盐度8~20的低渗海水均能诱导栉孔扇贝产生三倍体,当盐度达到14时,三倍体诱导率最高,为(87.76 ±2.77)%;盐度继续升高,三倍体诱导率呈现下降趋势,由此可以确定最佳低渗诱导盐度为14。
低渗盐度的变化对受精卵的发育和孵化影响较大,卵裂率和孵化率随着盐度的升高而持续升高,在最适盐度14时,卵裂率和孵化率分别为(50.92± 5.83)%、(63.22±5.06)%,比对照组(80.90± 4.53)%、(86.65±6.52)%低。2.3处理时机对诱导效果的影响

图2 不同低渗盐度处理对受精卵孵化、卵裂及获得三倍体的影响Fig.2 Results of hatchery,cleavage,triploidy with hypotonic treatment at different salinity
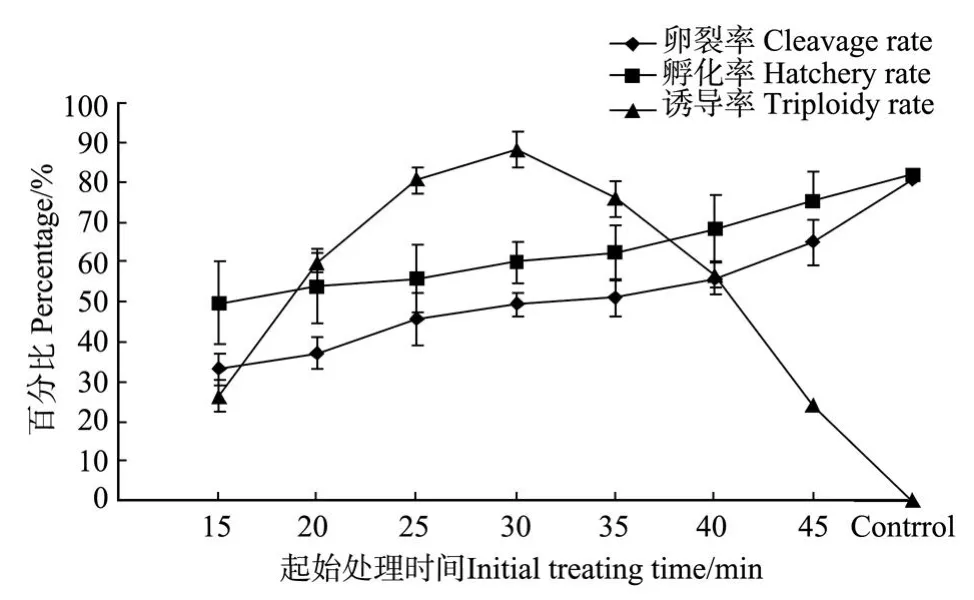
图3 不同起始处理时间对受精卵孵化、卵裂及获得三倍体的影响Fig.3 Results of hatchery,cleavage,triploidy with hypotonic treatment at different initial treating time
以最佳低渗盐度S=14,在受精后15~40 min处理受精卵15 min,结果见图3。起始处理时间不同,诱导率不同,其中以受精后30 min开始处理,诱导率最高,达(88.07±3.25)%;卵裂率和孵化率在受精后15 min开始处理时最低,随着起始处理时间的推迟而增加。由此可确定最佳处理时机为受精后30 min。

图4 不同持续处理时间对受精卵孵化、卵裂及获得三倍体的影响Fig.4 Results of hatchery,cleavage,triploidy with hypotonic treatment under different duration of treatment
2.5 幼虫生长
在20℃水温条件下,采用最佳诱导条件,受精后30 min,以低渗盐度S=14处理受精卵20 min,诱导栉孔扇贝三倍体,并进行幼虫培育。图5为三倍体处理组(3n)与二倍体对照组(2n)的生长曲线。诱导群体D形幼虫的三倍体率为90.15%,卵裂率为45.74%,孵化率为60.47%;二倍体对照组的卵裂率为71.23%,孵化率为80.77%。处理组胚胎发育速度较对照组慢,至D形幼虫时相差4~5 h;诱导组的初孵D形幼虫壳长((113.5±4.6)μm)也比对照组((116.8±3.7)μm)略小,但生长较快,至第4天,3n的壳长逐渐超过2n;第2天~第6天,3n与2n的生长速度差异不显著P> 0.05,第8天到附着变态,2组生长差异显著P<0.01,处理组幼虫表现出明显的生长优势。3n从受精到附着变态为稚贝共13 d,2n对照组为15 d。
2.6 4种方法的诱导效果比较
水温20℃,催产获得同一批精卵,同时受精,分别采用低渗处理、6-DMAP、热休克和冷休克诱导处理,三倍体诱导率以低渗处理组最高为(91.43±4.14)%, 6-DMAP处理组次之为(91.25±3.49)%;热休克和冷休克诱导率较低,分别为(25.85±4.94)%和(21.86± 2.04)%(见图6),低渗与6-DMAP处理组的卵裂率、孵化率及诱导率明显高于热休克和冷休克组,差异显著,P<0.01;低渗的诱导效果与6-DMAP相比无显著差异,P>0.05。
2.4 不同持续处理时间对诱导效果的影响
在精卵受精后30 min,以最佳低渗盐度S=14处理受精卵10~25 min,结果见图4。卵裂率和孵化率随着持续处理时间的延长而降低,三倍体诱导率以持续处理20 min组最高,为(92.36±2.41)%,由此可确定最佳持续处理时间为20 min。

图5 三倍体处理组和对照组幼虫的生长比较Fig.5 Difference of larval growth between treated group and control
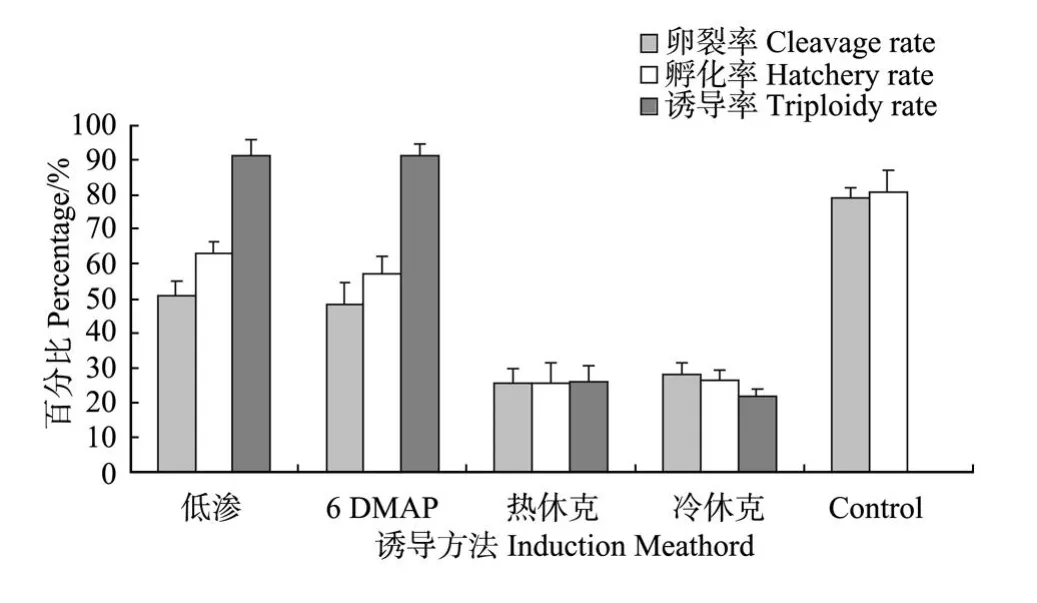
图6 不同三倍体诱导方法对受精卵孵化、卵裂及获得三倍体的影响Fig.6 Results of hatchery,cleavage,triploidy with different triploid induction methods
3 讨论
从1981年Stanley利用细胞松弛素B诱导美洲牡蛎(Crassostrea virginica)获得三倍体以来,三倍体贝类就以其不育性、生长快、品质好等优点而成为贝类细胞遗传育种研究的热点。迄今为止,已在牡蛎、扇贝、鲍等30余种贝类中进行了多倍体的育种研究[3]。已有的研究表明,三倍体扇贝可以产生较大的闭壳肌[1],从而使得三倍体的优势在扇贝中表现更为突出,也因此扇贝三倍体的研究更受重视。
3.1 低渗方法诱导扇贝多倍体的优势
国内外学者对扇贝的多倍体育种做了大量的研究,诱导方法多种多样,包括CB[5]、6-DMAP[6]等化学诱导、冷休克、热休克[4]及低渗处理[8]等物理方法。各种方法均能诱导产生三倍体。已有的报道中,栉孔扇贝三倍体诱导以6-DMAP的诱导效果最好,三倍体率最高为88.4%[6],但6-DMAP价格昂贵,操作繁琐,其安全性也有待于进一步验证;CB是1种剧毒化学药物,有强致癌性,且价格昂贵,已报道的栉孔扇贝三倍体诱导率最高为50%[5];冷休克和热休克虽然无毒,但诱导效果较差,已报道的研究中最高诱导率分别为30.4%和27.6%[4]。低渗处理安全无毒,且操作简单,迄今只用于虾夷扇贝三倍体诱导,在栉孔扇贝和其他贝类中尚未见报道。
本研究探索了低渗诱导栉孔扇贝三倍体的最佳诱导参数,在受精后30 min开始,以低渗盐度14处理受精卵20 min,三倍体诱导率可高达(92.36±2.41)%,超过已报道的所有方法的诱导效果。
本研究采用同一批受精卵用不同方法处理,比较其诱导效果,以减少系统误差。结果显示,低渗和6-DMAP处理的诱导效果较好,三倍体诱导率分别为(91.43±4.14)%和(91.25±3.49)%,明显高于热休克和冷休克的诱导效果;低渗和6-DMAP的诱导效果无明显差异,但低渗处理组的孵化率为(63.22± 5.06)%,高于6-DMAP诱导组(57.23±5.64)%。从操作过程来看,低渗处理操作简单,处理结束后可以直接移入较大体积的海水中培育,不需像6-DMAP处理那样要洗卵去除药液;从成本来看,低渗处理成本几乎为零,而6-DMAP价格昂贵;从安全性来看,低渗处理安全无毒,而6-DMAP具有一定的毒副作用,其安全性尚有待于进一步验证。综合来看,低渗方法具有诱导率高、安全无毒、操作简便、成本低等优点,适于生产应用,具有广阔的应用前景。
3.2 影响低渗诱导效果的主要因素
影响贝类多倍体诱导的因素很多,除了诱导方法上的差异外,处理时机和处理强度是影响诱导率高低的关键性因素,尤其是处理时机的把握是多倍体诱导成功与否的决定性因素。只有合适的时机施加适当的处理才能抑制极体的释放,从而获得多倍体,过早或过晚处理都将错过抑制减数分裂的最佳时机,无法达到染色体加倍的目的。一般认为当40%~50%受精卵出现第一极体是较为适宜的处理时机[2]。栉孔扇贝胚胎发育最佳温度为18.0~22.0℃,盐度为30.0~32.5;幼虫培育最佳温度为19.0~22.0℃,盐度为27.0~32.0[12]。通过预实验,养殖海区的盐度为31,栉孔扇贝在20℃时受精,第一极体出现的时间为受精后15 min,受精后25~30 min第一极体排出40%~50%,第二极体出现。从实验的结果来看,受精后30 min开始处理是最佳诱导时机,诱导率最高,与按照极体出现的百分率时间相符,开始处理时间过早或过晚,其诱导效果都较差。
处理强度(处理的剂量和处理持续时间)对多倍体的诱导效果影响也很大,一般诱导率随诱导强度的增大而升高,但处理强度的加大会导致胚胎的畸形发育,影响孵化率和成活率,从而造成诱导率降低的现象[8]。本研究中低渗诱导栉孔扇贝三倍体的最佳诱导强度为:低渗盐度S=14,持续处理时间20 min。
多倍体诱导率的高低很大程度上还受胚胎发育同步性的影响,只有受精卵同步发育,经过适宜的诱导处理才能获得较高的诱导率。受精卵发育同步与否,与卵子是否同步受精有关,也与卵子的质量有关。充分成熟的亲贝产出的卵子发育的同步性较高[6]。对栉孔扇贝而言,尽量延长亲贝暂养时间,避免人为刺激提早产卵,是目前研究条件下获得充分成熟卵子的有效方法。另外,受精卵发育的同步性与操作过程中的方法有关,雌雄贝应分开暂养,在处理过程中雌雄亲贝严格隔离,以避免精子污染,采用人工授精,以保证卵子同步受精。
3.3 三倍体扇贝的生长优势
三倍体贝类的生长优势已在几乎所有研究的贝类中得以证实。从细胞遗传学角度来看,三倍体是非偶数染色体组,故阻碍了生殖细胞正常的减数分裂,结果常常导致性腺发育的衰退或非整倍体配子的产生。三倍体最明显的优势在于其具有不育性,使其只有极少能量用于性腺发育,更多的能量用于生长。人工诱导的三倍体贝类在正常二倍体性腺未成熟前与二倍体大致相同,但在二倍体繁殖期间,三倍体的生长也不停滞,产卵期之后的生长明显优于二倍体[13-14]。三倍体贝类的生长优势不仅表现在性腺发育阶段,从幼虫阶段开始生长速度就较快,这可能与多倍体的巨态发育有关。贝类的发育属于“嵌合型”,即发育分化主要取决于形态发生因子的分离,发育的进程由分裂的次数决定,缺乏补偿机制,细胞体积增大而细胞数目并不减少,结果导致三倍体个体的增大[15]。本实验的结果支持了这一假说,三倍体诱导组幼虫的生长速度明显快于二倍体对照组,且比对照组早两天附着变态,充分显示出了三倍体的生长优势。
3.4 低渗诱导方法的应用前景
本研究探索了低渗诱导栉孔扇贝三倍体的最佳参数,诱导率达91.43%±4.14%,在已有报道的结果中最高,具有安全无毒、操作简便、成本低、诱导率高等优于其他多倍体诱导方法的优势,是一种新型的安全、高效、环保、简便的多倍体诱导方法,适合于生产应用,并能适用于其它海洋生物的多倍体诱导,具有广阔的应用前景。低渗诱导三倍体的作用机理目前尚不明确,可能与低渗引起的能量代谢紊乱影响微管和微丝的形成有关,还有待于进一步的研究。
[1] 杨爱国,王清印,张岩,等.栉孔扇贝三倍体与二倍体的生长比较[J].海洋科学,2000,24(8):21-23.
[2] 王昭萍,王如才,于瑞海,等.多倍体贝类的生物学特性[J].青岛海洋大学学报,1998,28(3):309-403.
[3] 常亚青,王子臣,杨旦光.贝类多倍体育种研究现状[J].水产科学,2002,21(1):31-36.
[4] 王子臣,毛连菊,陈来钊,等.温度休克诱导栉孔扇贝和虾夷扇贝三倍体的初步研究[J].大连水产学院学报,1990,5(3/4):1-6.
[5] 吕隋芬,王如才.细胞松驰素B诱导栉孔扇贝产生三倍体的研究[J].海洋湖沼通报,1992,2:40-45.
[6] 杨爱国,王清印,孔杰,等.6-二甲基嘌呤诱导栉孔扇贝三倍体[J].水产学报,1999,23(3):241-247.
[7] Scarpa J,Wada K T&Komaru A.Induction of tetraploidy in mussels by suppression of polar body formation[J].Nippon Suisan Gakkaishi,1993,59:2017-2023.
[8] 王昭萍,赵婷,于瑞海,等.一种新方法——低渗诱导虾夷扇贝三倍体的研究[J].中国海洋大学学报:自然科学版,2009,39(2): 193-196.
[9] Stanley J G,Hidu H,Allen S KJr.Growth of American oysters increased by polyploidy induced by blocking meiosis I but not meiosisⅡ[J].Aquaculture,1984,37:147-155.
[10] Downing S L L,Allen S K Jr.Induced triploidy in the Pacific oysterCrassostrea gigas:optimal treatments with cytochalasin B depend on temperature[J].Aquaculture,1987,61:1-15.
[11] 张国范,常亚青,宋坚,等.不同方法制备的三倍体长牡蛎养殖效果的比较[J].水产学报,2000,24(4):324-328.
[12] 梁玉波,张福绥.温度、盐度对栉孔扇贝(Chlamys f arreri)胚胎和幼虫的影响[J].海洋与湖沼,2008,39(4):334-340.
[13] 孙振兴,宋志乐,李诺,等.皱纹盘鲍三倍体生长的初步研究.海洋湖沼通报,1992(4):70-75.
[14] 姜卫国,许国强,林岳光,等.合浦珠母贝三倍体和二倍体的生长比较.热带海洋,1991,10(3):1-7.
[15] Guo X,Allen S KJr.Sex determination and polyploid gigantism in the dwarf surfclam(Mulinia lateralisSay)[J].Genetics, 1994,138:1199-1206.
[16] 范兆廷.水产动物育种学[M].北京:中国农业出版社,2005: 140-143.
Abstract: Hypotonic treatment was used in triploid induction inChlamys f arreriby inhibiting polar bodyⅡ(PB2)releasing.Different hypotonic treatments,including salinity(8~20),initial treating time (15~40 min after fertilization),and duration time(10~25 min),were tested at 20℃water temperature. Triploid group and diploid group were designed to imestigate the growth of larva.Four different triploid induction methods were compared including hypotonicity,6-DMAP,cold shock and heat shock.The Results indicated that the optimal hypotonic treatment was 30 min after fertilization,which can resulted in the highest triploidy rate which was up to(92.36±2.41)%,(49.78±6.51)%cleavage rate and(61.82 ±1.63)%hatchery rate.The triploid group showed obvious growing advantage in the larvae stage(P< 0.01),the growing speed of triploid larvae was rapid,and the shell length was longer than diploid larvae when it growed to metamorphosis.Comparison of triploidy rate showed no significant difference between the treatment of hypotonicity and 6-DMAP,while there was significant difference between the treatment of hypotonicity and temperature shock.
Key words: Chlamys f arreri;triploid;hypotonic treatment
责任编辑 于 卫
Triploid Induction in Chlamys farreri by Hypotonic Treatment and The Comparison with Other Treatment Methods
ZHANG Chen-Chen,WANG Zhao-Ping,YU Rui-Hai,DI Wei-Peng,KONGJing,LIU Jian
(The Key Llaboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China)
S963.8
A
1672-5174(2010)09Ⅱ-071-05
国家自然科学基金项目(30771622);国家高技术研究发展计划项目(2006AA10A401)资助
2010-01-12;
2010-03-29
张晨晨(1985-),女,硕士生,主要从事贝类养殖研究。E-mail:zhangchenchen1985@163.com
Tel:0532-82031623;E-mail:zpwang@ouc.edu.cn
